Tidligere publisert i Ugeskriftet nr. 34/1999, 23.8. 1999
Med alderen ses markante og komplekse ændringer i funktionen af stort set alle immunsystemets komponenter (fig 1). Det er nærliggende at spørge, om disse ændringer er udtryk for immundysfunktion/-dysregulering, eller om immunsystemets funktion tilpasses med alderen. Det forhold, at ældre har både flere og mere alvorlige bakterie- og virusinfektioner, støtter antagelsen om, at der eksisterer en aldersassocieret immunsvækkelse af klinisk betydning. En kausal sammenhæng mellem det senile immunsystem og høj infektionsrisiko er dog endnu ikke vist. Øget forekomst af autoimmune antistoffer og monoklonale (M)-komponenter kan tolkes som tegn på aldersrelateret immundysregulering, og inflammation indgår i patogenesen ved en række aldersassocierede sygdomme. Immunsystemet er også blevet betragtet som indikator for generel helbredsstatus eller «biologisk alder». Lymfocytfænotype og -funktion prædikterer således mortalitetsrisikoen i flere ældrekohorter. Et tilbagevendende problem i geronto-immunologien er imidlertid, om nedsat immunfunktion hos ældre afspejler biologisk alder eller underliggende sygdom. Man har derfor indført snævre kliniske og biokemiske selektionskriterier som fx SENIEUR-protokollen (1).
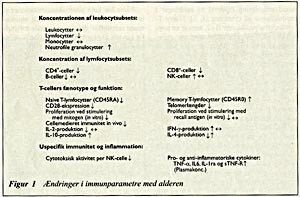
Figur 1 Ændringer i immunparametre med alderen
Det er især aldersrelaterede ændringer i T-celler, som har været genstand for intensiv forskningsaktivitet, mens ændret funktion af det øvrige immunsystem ofte bliver betragtet som sekundær til dysregulering udøvet af T-lymfocytterne. T-celler omfatter CD4+-celler, der har vigtige immunregulatoriske funktioner, og CD8+-celler, som især er vigtige for bekæmpelse af virusinfektioner. Ældre har nedsat samlet koncentration af lymfocytter i blodet, hvilket især skyldes nedsat forekomst af CD8+-celler, men også antallet af CD4+-cellerne er nedsat (2).
Proliferation af T-lymfocytter er essentiel for klonal ekspansion, som udgør det første trin i et adaptivt immunrespons. Nedsat lymfocytproliferation ved mitogenstimuleringer in vitro og nedsat respons ved såkaldt cellemedieret immunitet in vivo er et af de mest karakteristiske træk ved det ældede immunsystem. Derimod er der uenighed om, hvorvidt der er bevaret evne til at reagere på antigener, man tidligere har været udsat for (recall-antigener). Alt tyder på, at ældre især har svært ved at generere et specifikt immunrespons ved eksposition for nye patogener (1).
Ældre har forholdsmæssigt færre naive celler (CD45RA+), som har et stort proliferationspotentiale, og flere memory-celler/aktiverede celler (CD45R0+) med mindre proliferationspotentiale. Nedsat koncentration af T-celler i blodet og en samtidig forskydning i fænotypen tilskrives traditionelt aldersbetinget thymusatrofi, som medfører nedsat produktion af naive T-lymfocytter samtidig med, at antigenstimulation gradvist medfører omdannelse af naive celler til memory-celler gennem hele livet (1, 2). Især CD8+-celler udviser tegn på reduceret T-cellereceptorrepertoire i form af oligoklonal ekspansion, nedsat ekspression af det costimulatoriske glykoprotein CD28 og forkortede telomerer (3). Alder er således associeret med øget forekomst af differentierede effektorceller, men nedsat forekomst af udifferentierede celler, hvilket underbygger hypotesen om, at ældre er mest sårbare over for nye patogener. Endvidere udviser naive celler fra ældre individer tegn på nedsat proliferation og interleukin (IL)-2-produktion.
T-lymfocytter i kultur udviser begrænset proliferativ kapacitet med gennemsnitlig 35 populationsfordoblinger, hvorefter de undergår apoptose (programmeret celledød). Dette fænomen kaldes the Hayflick limit . Figur 2 er en hypotetisk model, som illustrerer, at T-cellers replikative endestadium teoretisk kan nås efter kun to eller tre ganges udsættelse for antigendrevet ekspansion. Memory -celler udfører fortsat celledelinger, hvorved deres replikative endestadium nås i løbet af en årrække (3). En molekylærbiologisk forklaring på, at T-cellers evne til proliferation brænder ud med alderen, er tab af telomerer ved gentagen klonal stimulation. Telomerer er repetetive DNA-sekvenser i enderne af kromosomerne. Enderne af kromosomet replikeres ikke ved celledeling, hvorved der tabes telomersekvenser, hvilket medfører, at cellen til sidst ikke længere kan dele sig. Telomerlængdetab kan således forklare, hvorfor celler kun kan dele sig et begrænset antal gange. Dette får særlig betydning for lymfocytter, fordi hurtig klonal ekspansion er essentiel for deres funktion (3). Naive celler har kortere telomerer end memory -celler, og lymfocytter fra ældre har kortere telomerer end dem fra unge. Endvidere er telomerlængdetabet accelereret i lymfocytter fra personer med præmatur aldring som fx trisomi 21 samt Werners syndrom og fra hiv-seropositive, hvor den konstante tilstedeværelse af virus medfører kronisk stimulering og «tidlig aldring» af immunsystemet, (fig 3) (3, 4). Kønsceller har høj aktivitet af enzymet telomerase, der reparerer telomerlængdetabet og dermed sikrer artens overlevelse. Maligne celler
kan inducere telomeraseaktivitet, hvilket medfører uhæmmet tumorcellevækst. Regulering af telomerlængder i T-lymfocytter er kompleks, idet der induceres telomeraseaktivitet i den initiale fase af lymfocytaktivering. Denne aktivitet forsvinder imidlertid efter få celledelinger, og det er endog meget sandsynligt, at den nedsatte lymfocytproliferation hos ældre i hvert fald delvis kan relateres til korte telomerlængder (4).
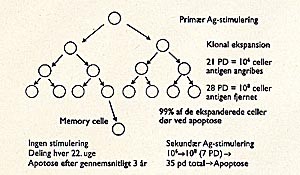
Figur 2 Hypotetisk figur for T-celleresponset ved antigenstimulering. Primær stimulering med antigen (Ag) udløser specifik klonal ekspansion; 21 populationsfordoblinger (PD) er et eksempel; det præcise tal kendes ikke. Efter clearing af Ag dør størstedelen af cellerne ved apoptose. De tilbageværende celler danner en pool af memory-celler, som ved manglende Ag-stimulering persisterer i et begrænset tidsrum. Ved at kombinere data på CD45R0 turnover in vivo og overlevelsesdata på kloner in vitro kan varigheden af memory estimeres til gennemsnitligt tre år og maksimalt 22 år. Hvis memory-cellerne modtager en sekundær Ag-stimulering, vil der ske en hurtig klonal ekspansion, som fører til klonal død efter gennemsnitlig 35 PD. Effros et al (3)
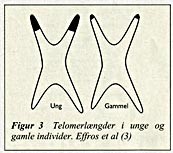
Figur 3 Telomerlængder i unge og gamle individer. Effros et al (3)
Nedsat T-lymfocytfunktion med alderen er også blevet kædet sammen med ændringer i signal-transduktionssystemer, akkumulation af DNA-beskadigelse og mutationer, øget aktiveringsinduceret apoptose samt immundysregulering relateret til ændringer i produktionen af cytokiner (1, 5). Naive T-lymfocytter producerer IL-2, som er en nøglefaktor i B-celledifferentiering og cellemedieret immunitet, herunder udvikling af cytotoksiske effektorceller. Memory -celler producerer et bredere spektrum af cytokiner, bl.a. IFN- γ , IL-4 og IL-10, og består af differentierede effektorceller (5). CD4+- og CD8+- memory -celler kan yderligere inddeles i henholdsvis Th1/Tc1-celler, som producerer fx IFN- γ og IL-2, der driver immunresponset i retning af cellemedieret immunitet, og Th2/Tc2-celler, som producerer fx IL-4, IL-10, IL-6, der hæmmer cellemedieret immunitet, men aktiverer B-cellerne. Det er en almindelig antagelse, at evnen til IL-2-produktion falder med alderen parallelt med faldet i naive celler, hvorved evnen til at danne nye effektorceller bliver kraftigt reduceret, men data er kontroversielle. Det er uklart, om produktionen af IFN- γ er øget eller uændret; produktionen af IL-4 er både rapporteret øget og nedsat, hvorimod T-celle-produktion af IL-10 er rapporteret øget (1, 5). Reduceret cellemedieret immunitet og øget forekomst af autoantistoffer og M-komponenter sammenholdt med samtidig nedsat IL-2-produktion og øget IL-10-produktion er blevet tolket som, at der med alderen sker en forskydning i balancen mellem Th1 og Th2-cytokiner (5). Det forhold, at produktionen af IFN-
ont type = “Symbol”> γ er normal eller øget hos ældre, peger derimod på, at forskydninger i T-cellernes cytokinproduktion kan tilskrives forskydninger i forholdet mellem naive og memory -celler (1, 5).
Ældre har høje plasmakoncentrationer af immunglobuliner omfattende dels autoimmune antistoffer, dels monoklonale antistoffer knyttet til ekspansion af enkelte B-cellekloner (6). Autoantistofferne har ofte lav affinitet og er ikke nødvendigvis patologiske hos ældre (2). Antistofresponset ved immunisering er ofte præget af lille antistoftiterstigning, kort varighed, lav affinitet, mindre beskyttelsesgrad og høj autoreaktivitet (6). Hos yngre individer aktiverer den primære immunisering en multiklonal B-cellepopulation, som efterhånden bliver domineret af nogle få kloner. Efter 6 – 7 dage sker der hypermutation i de rearrangerede variable (V) gener i de aktiverede B-celler i lymfeknudernes germinalcentre, hvorved mutanter med høj affinitet kommer til at dominere memory -cellerne, mens mutanter med lavere affinitet eller autoreaktivitet bliver elimineret ved apoptose. Med stigende alder er der tiltagende rekruttering/ekspansion af B-celler med lav-affinitetsreceptorer, frekvensen af mutationer i de rearrangerede V-gener er reduceret, og germinalcentre samt plasmacytære foci i lymfeknuderne er mindre veludviklede (6). Hjælp fra CD4+-T-celler er essentiel for hvert skridt i affinitets-«modningen», og dysregulering medieret af disse er ansvarlige for en stor del af de aldersassocierede ændringer i humoral medieret immunitet (1, 6). Responset på T-celleuafhængige antigener er bedre end responset på T-celleafhængige antigener, men defekt B-cellefunktion i sig selv spiller dog også en rolle (6). Koncentrationen af B-lymfocytter er både rapporteret uændret (6) og nedsat (2), og der er fundet ændringer i knoglemarvens modningsproces. Antistofresponset ved vaccination mod fx pneumokokker
og influenza er dog tilstrækkeligt til, at man opnår effekt på morbiditet og mortalitet ved vaccination af ældre mennesker.
Er ældre immundefekte, eller undergår immunssystemet en kompleks remodellering med alderen? Det er blevet foreslået, at nedsat funktion af det adaptive immunsystem kompenseres ved øget aktivitet af det innate immunforsvar (2). Det hurtigt aktiverbare uspecifikke innate immunforsvar har populært sagt betydning for, om man bliver infektionssyg, mens det specifikke immunforsvar er af betydning for, om man bliver rask igen. Ældre har højere koncentration af natural killer (NK)-celler i blodet, men lav aktivitet per NK-celle. Velbevaret NK-celleaktivitet er associeret med «succesfuld aldring», idet raske 100-årige stort set har normal NK-celleaktivitet (2).
Tilsyneladende raske ældre udviser tegn på kronisk inflammation i blodet. Der er således høje cirkulerende niveauer af proinflammatoriske cytokiner (tumornekrotiserende faktor [TNF]- α og IL-6), antiinflammatoriske cytokiner og cytokinhæmmere (IL-1-receptorantagonist [IL-1ra] og cirkulerende TNF-receptorer [sTNF-R]), akut fase-reaktanter (C-reaktivt protein, serumamyloid A m.fl.) og øget koncentration af neutrofile granulocytter (7). Kronisk forhøjelse af inflammationsparametre kan accentuere en allerede tilstedeværende T-celledefekt, hvilket taler for en rolle i en aldersrelateret immundefekt frem for at afspejle en immunologisk kompensationsstrategi. Fx inducerer TNF- α apoptose af T-celler, og dette er mere udtalt for ældre end for unge (8). Høje niveauer af IL-1ra er associeret med lav lymfocytproliferation og IL-2-produktion.
Aldersassocieret kronisk inflammation og immunaktivering er formentlig tæt forbundet med aldersrelateret patologi (fx arteriosklerose, osteoporose og demens) og rækker således ud over de sædvanlige rammer for klassisk immunologi. I en undersøgelse af 126 100-årige fandtes uafhængige sammenhænge mellem høje koncentrationer i blodet af TNF- α og demens, samt mellem TNF- og arteriosklerose (7). De kausale sammenhænge kendes ikke. Inflammation indgår som en vigtig del i patologien for både arteriosklerose (9) og demens (10), men om proinflammatoriske cytokiner i blodbanen accelererer de patologiske processer eller afspejler dem er ikke klarlagt. TNF- α øger bl.a. produktionen af triglycerid, er associeret med lav HDL- og høj LDL-koncentration, og er involveret i udviklingen af insulinresistens. Endvidere er højt plasma-TNF- α prædiktivt for tidlig død blandt ældre plejehjemsbeboere.
Kroniske subkliniske infektioner kunne være årsag til den øgede inflammatoriske aktivitet. Eksempelvist har Chlamydiae pneumoniae været relateret både til Alzheimers sygdom, arteriosclerosis og TNF- α -produktion (10). Endvidere er aldersbetingede ændringer i hormonproduktion (fx østrogen og binyrebarkhormonet dehydroepiandrosteron) associeret med øget produktion af proinflammatoriske cytokiner.
Alder er altså associeret med kronisk inflammatorisk aktivitet; men det er uafklaret, om ældre har nedsat evne til at generere et akut faserespons ved fx en infektion. Nedsat evne til at adaptere stress er således en egenskab, der hyppigt relateres til alder. Det er en almindelig antagelse blandt geriatere, at evnen til at fremkalde feber, som medieres af proinflammatoriske cytokiner og formentlig er vigtig for effektivisering af immunfunktionen ved infektionsbekæmpelse, nedsættes med alderen (11). Dyreforsøg viser, at gamle dyr i forhold til unge dyr genererer mindre temperaturstigning ved infektion med Salmonella typhimurium , og at dette er associeret med et højere bakterieantal (12). Lignende studier er ikke publiceret for mennesker. Lavere koncentration af inflammatoriske cytokiner i serum fra ældre versus unge, der blev indlagt med pneumoni, samt aldersassocieret nedsat in vitro-produktion af proinflammatoriske cytokiner ved E. coli lipopolysakkaridstimulering af monocytter fra raske tyder dog på nedsat produktion af mediatorer i akut fase-responset. Endvidere viste en mindre undersøgelse, at manglende evne til at generere leukocytose og feber ved infektion var associeret med øget mortalitetsrisko for ældre, om end det er uafklaret, om det manglende akut fase-respons var relateret til alder eller underliggende sygdom.
Udtalt fejlernæring er immunsupprimerende, og lettere tilfælde af fejlernæring er måske af klinisk betydning hos ældre ved at virke synergistisk med en biologisk immunsvækkelse. Et tilskud af vitaminer og sporstoffer svarende til en vitaminpille dagligt i 12 måneder gav højere T-lymfocyttal, -proliferation og IL-2-produktion, forbedret antistofrespons ved vaccination, højere NK-celleaktivitet og færre sygedage end i placebogruppen (13). Tilskud til ældre på 65år og derover i en dobbeltblind, placebokontrolleret undersøgelse af vitamin E, der virker som antioxidant, men også påvirker immunfunktionen direkte ved at hæmme produktionen af prostaglandin E2, (der er forhøjet med alderen), forbedrede såvel T-cellefunktion som vaccinationsrespons (14).
Der er ingen tvivl om, at når det gælder immunsystemet, er der et biologisk ur, som tikker. Vi bliver måske ikke ældre, men i hvert fald telomerforkortede! Meget tyder på, at den biologiske immunsvækkelse forstærkes af underliggende sygdom og dårlig ernæring. Den aldersassocierede immunsvækkelse og samtidige kroniske inflammatoriske tilstand er sandsynligvis af væsentlig patogenetisk betydning for en række af de store alderssygdomme, herunder arteriosklerose, Alzheimers sygdom, osteoporose, autoimmune sygdomme, type II-diabetesog øget forekomst af alvorlige infektioner (fig 4).
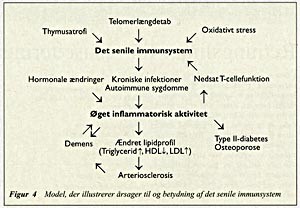
Figur 4 Model, der illustrerer årsager til og betydning af det senile immunsystem
Den demografiske udvikling betyder, at befolkningen i den vestlige verden vil komme til at omfatte flere og flere ældre de kommende år, og aldersassocierede sygdomme vil derfor i stigende omfang komme til at dominere sundhedsvæsenet. Større forståelse af mekanismer ved det senile immunsystem vil kunne føre til relevante interventionsundersøgelser og dermed potentielt reduktion af morbiditet blandt de ældre.