Høydose cellegiftbehandling med autolog stamcellestøtte er en ressurskrevende terapi som i Norge tilbys et fåtall kreftpasienter innenfor spesielle diagnosegrupper. Disse pasientene skal ha en kreftsykdom som har vist seg å være følsom for cellegift (1), det vil si at man oppnår en behandlingseffekt etter et begrenset antall cytostatikakurer med konvensjonelle doser cellegift (induksjonskurer). I tillegg skal det foreligge doserespons-forhold mellom cellegiftdose og kreftdrepende effekt.
I korte trekk innebærer denne behandlingen at pasienten, etter å ha blitt forbehandlet med cellegift og hematopoetisk vekstfaktor, mobiliserer stamceller med CD34-positive overflatemarkør fra beinmargen ut i blodbanen. Ved en såkalt afereseteknikk kan disse stamcellene (CD34-positive celler) høstes fra pasientens blod som et aferese- eller stamcelleprodukt, og nedfryses til − 180 ˚C. Pasienten får deretter høye doser med beinmargstoksiske cellegifter. Etter ca. 72 timer, når cellegiftkonsentrasjonen er under beinmargstoksisk nivå, tines pasientens stamceller opp, for så å reinfunderes intravenøst. Disse cellene finner veien tilbake til beinmargen. Beinmargsregenerasjon med proliferasjon, differensiering og modning av de enkelte cellelinjer finner sted mens pasienten er i en aplasiperiode med svært lavt antall modne blodceller i perifert blod. Som følge av beinmargsregenerasjon vil hematologiske blodverdier vanligvis stige etter ca. to uker og beinmargsfunksjonen gradvis normaliseres.
Det Norske Radiumhospital har lengst og størst erfaring når det gjelder høydosebehandling av onkologiske pasienter med autolog stamcellestøtte høstet fra perifert blod (2, 3). I mars 1995 ble det bestemt at denne behandlingen skulle desentraliseres. Høydosebehandling med autolog stamcellestøtte blir nå utført ved regionsykehusene i Tromsø (4), Trondheim, Oslo og Bergen. Haukeland Sykehus har fått bred erfaring når det gjelder stamcellehøsting og høydosebehandling av forskjellige diagnosegrupper. I perioden 1996 – 98 har det vært utført totalt 117 stamcellehøstinger hos til sammen 49 pasienter. Vi gir i det følgende en oppsummering av våre resultater.
Materiale og metoder
Pasienter
Materialet omfatter 49 pasienter som ble stamcellehøstet i perioden 1996 – 98. Av disse fikk 46 høydosebehandling. To pasienter med testikkelkreft hadde så god respons på induksjonskurene at det ikke var indikasjon for høydosebehandling, det vil si at de i henhold til behandlingsprotokollen fortsatte med konvensjonell behandling. En pasient med høygradig malignt lymfom i hud som var fjernet kirurgisk, kom i komplett remisjon etter ordinær behandling og har nedfryste stamceller i reserve. E…n pasient med testikkelkreft og tre pasienter med sarkom fikk dobbel høydosebehandling. Totalt er det derfor gitt 50 høydosebehandlinger til de 46 pasientene.
I Norge var høydosebehandling med autolog stamcellestøtte inntil desember 1997 utprøvende behandling for tidligere ubehandlede myelomatosepasienter under 60 år. Resultater fra nordisk forsøksprotokoll førte til at fra januar 1998 ble høydosebehandling betraktet som etablert behandling for tidligere ubehandlede myelomatosepasienter under 65 år. Inklusjonskriteriet tilsier at det ikke skal foreligge progredierende sykdom etter tre induksjonskurer.
Høydosebehandling med autolog stamcellestøtte var og er etablert behandling for pasienter med Hodgkins sykdom og høygradig malignt non-Hodgkins lymfom som utvikler residiv eller progredierer under primærbehandlingen. Kravene for å motta høydosebehandling er at det skal foreligge tilnærmet komplett klinisk og røntgenologisk tilbakegang av tumormanifestasjonene etter tre induksjonskurer. Ved tvil blir det gjort biopsi der det er teknisk mulig, og påvisning av vitalt tumorvev blir oppfattet som utilfredsstillende respons.
For de andre pasientene var høydosebehandling med autolog stamcellestøtte utprøvende behandling. Med unntak av e…n pasient med amyloidose var disse pasientene innlemmet i nasjonale eller internasjonale forsøksprotokoller.
Fordeling av pasienter etter diagnose er vist i tabell 1. 15 av de 22 lymfompasientene hadde residiv. Innen sarkomgruppen hadde to pasienter diagnosen Ewings sarkom, en pasient PNET/Ewings sarkom og en hadde rabdomyosarkom.
Mobilisering og høsting av stamceller
Stamceller ble mobilisert med forskjellige cellegiftregimer i henhold til hvilken diagnose pasienten hadde (tab 2), med påfølgende injeksjoner av granulocytt-kolonistimulerende faktor (G-CSF, Neupogen). Pasienten med amyloidose ble mobilisert med G-CSF alene.
Tabell 2 Cellegift som ble brukt for å mobilisere stamceller fra blod til beinmarg i forbindelse med stamcellehøsting (mobiliseringskur), og cellegift som ble gitt i forbindelse med høydosebehandling (kondisjoneringsregime)
|
Diagnose
|
Mobiliseringskur
|
Kondisjoneringsregime
|
|
Hodgkins sykdom og Non-Hodgkins lymfom
|
MIME (Methyl-GAG, ifosfamid, metotreksat, etoposid)
|
BEAM (BCNU, etoposid, cytarabin, melfalan) Høydose cyclofosfamid + helkroppsbestråling ble gitt til en pasient med lymfoblastlymfom
|
|
Myelomatose
|
Cyclofosfamid
|
Høydose alkeran
|
|
Sarkom
|
EVAIA (etoposid, vinkristin, adriamycin, ifosfamid, aktinimysin D), eller IVE (ifosfamid, vinkristin, etoposid), eller cyclofosfamid + etoposid
|
Forskjellige regimer med kombinasjon av: melfalan, etoposid, cyclofosfamid, busulfan og tiotepa
|
|
Testikkelkreft (ikke-seminom)
|
BEF-If (bleomycin, etoposid, cisplatin, ifosfamid)
|
Carboplatin, etoposid, cyclofosfamid, tiotepa
|
|
Brystkreft
|
FEC (5-FU, epirubicin, cyclofosfamid)
|
Carboplatin, etoposid, tiotepa
|
|
Akutt lymfatisk leukemi
|
Cyclofosfamid
|
Høydose cyclofosfamid + helkroppsbestråling
|
Det første året ble stamceller i blod målt fra dag 12 etter oppstart av mobiliseringskjemoterapikur. De to siste årene har vi målt sirkulerende stamceller fra dag 10 dersom leukocyttallet er over 1,5 × 109/l.
Ved påvisning av> 15 – 20 × 103 CD34-positive celler/ml blod og væskestrømscytometrisk synlig populasjon av CD34-positive celler blir høsting (aferese) av mononukleære leukocytter (inkludert stamceller) utført ved bruk av Cobe Spectra afereseutstyr (Cobe Laboratories Inc, Lakewood, USA). Før aferese får pasienten innlagt sentralvenøst dialysekateter med ett løp der fullblod blir trukket ut og ett der fullblod minus mononukleære celler blir returnert.
Etter ca. 3 – 4 timer, når 2,5 – 3 ganger pasientens blodvolum er blitt prosessert i aferesemaskinen, er det høstet et stamcelleprodukt som inneholder 0,5 – 6% CD34-positive celler. Dette produktet blir fortynnet med autologt plasma eller konsentrert til en optimal cellekonsentrasjon på ca. 1 × 108 celler/ml og blandet med frysevæske DMSO (dimetylsulfoksid) 10 %. Cellene blir fordelt i 2 – 3 fryseposer (Baxter Pl 269 Cryocyte Freezing Container, Deerfield, USA) og fryses så ned i flytende nitrogen. Nedfrysingen skjer kontrollert i en nedfrysingsmaskin (Planer Kryo 10, Planer Product Ltd, England).
Stamcellehøstingen må ofte gjentas den påfølgende dag eller dager for å få nok stamceller til en eller flere høydosebehandlinger.
Estimering av CD34-positive celler
Estimering av CD34-positive celler blir utført på blodprøve før pasienten blir stamcellehøstet og fra stamcelleproduktet umiddelbart etter høsting. Denne analysen utføres etter en protokoll anbefalt av nordisk stamcellelaboratoriegruppe (NSCL-G) (5). Røde blodceller lyseres, cellesuspensjonen farges med fycoerytrin merket anti-CD34 (HPCA-2)-antistoff (Becton Dickinson, San Jose, CA, USA) og analyseres med væskestrømscytometri.
Kvalitetskontroll av stamcelleproduktet
Viabilitetsmåling av stamcelleproduktet blir utført umiddelbart før nedfrysing ved hjelp av acridinoransje-/etidiumbromidfarging og avlesning i fluorescensmikroskop. Prøve blir også sendt til bakterologisk undersøkelse.
E…n dag etter nedfrysing tines en liten ampulle stamcelleprodukt og cellene sås ut i et cellekoloniassay for å teste deres evne til å danne kolonier in vitro (Methocult H-4433, Stem Cell Technologies, Inc. USA). Antall kolonier, CFU (colony forming units), leses av etter 14 dager. Antall CFU-er i stamcelleproduktet blir utregnet. Sammen med det absolutte stamcelletallet i produktet blir CFU og celleviabilitet brukt som surrogatmarkører på funksjonell stamcellekvalitet.
Tilbakeføring av stamcelleprodukt
Pasientene får høydosebehandling og eventuelt helkroppsbestråling etter ulike regimer, avhengig av diagnosegruppe. Etter cirka 72 timer blir stamcellene fraktet i flytende nitrogen fra oppbevaringstank på blodbanken til klinisk avdeling. I avdelingen blir cellene tint i 37 ˚C vannbad og infundert umiddelbart etter tining gjennom sentralt venekateter. Før reinfusjon får onkologiske pasienter intravenøst morfin (10 mg), diazepam (5 mg) og deksklorfeniramin (2,5 mg, myelomatosepasienter får paracetamol (1 000 mg) og fenamin (2 mg) tabletter, for å minske bivirkninger av DMSO (frysevæske) som er til stede i stamcelleproduktet. Fra hver pose blir det på nytt tatt prøver til viabilitetstesting.
Resultater
Pasientantall
Antall pasienter som har mottatt høydosebehandling med autolog stamcellestøtte har vært økende, og vi regner nå med å behandle cirka 20 – 30 pasienter per år. Flest høstinger er utført hos pasienter med non-Hodgkins lymfom og myelomatose, men det siste året har vi også fått økende erfaring med pasienter som behandles for sarkom (fig 1).
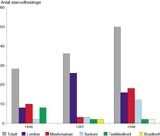
Figur 1 Antall stamcellehøstinger som er foretatt ved Haukeland Sykehus i perioden 1966 – 98. Totalantall og inndeling etter diagnoser
Måling av leukocytter og CD34-positive celler i perifert blod
Som vist i figur 2 var det en klar relasjon mellom antall sirkulerende stamceller og utbyttet av stamceller som ble oppnådd ved en aferese/høsting. Figur 2 viser også at dersom pasienten har mindre enn 20 × 103 CD34-positive celler/ml blod, er det svært liten sjanse for at det ved en stamcellehøsting kan bli samlet en minimumsdose stamceller (definert som 2 × 106 CD34-positive celler/kg), som ansees som nødvendig for å gi pasienten høydosebehandling. Disse pasientene må derfor høstes flere ganger for å oppnå den definerte minimumsdosen med stamceller.
Det var ingen relasjon mellom konsentrasjon av sirkulerende leukocytter og mengden stamceller som ble oppnådd ved e…n høsting, som vist i figur 3. Flere pasienter mobiliserte store mengder granulocytter og hadde en høy LPK-verdi i blod uten at de hadde målbare stamceller. Imidlertid har det vist seg at ingen pasienter begynte å mobilisere tilfredsstillende mengder stamceller i blod før LPK-verdien var> 1,5 × 109/l (fig 3).
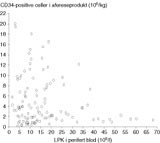
Figur 3 Relasjonen mellom LPK-verdi i blod målt før stamcellehøsting og innhold av CD34-positive celler i det høstede afereseprodukt. Ved hver aferese (stamcellehøsting) er det høstet stamceller fra 2,5 – 3 ganger pasientens blodvolum
Stamcellemobilisering
De forskjellige pasientgruppene var ulike med henblikk på hvor mye beinmargstoksisk behandling de hadde fått. Pasienter med myelomatose og brystkreft var lite forbehandlet (tab 1). Lymfompasientene hadde oftere residiv og hadde derfor mottatt mer kjemoterapi.
Tabell 1 Pasientkarakteristika før stamcellehøsting og planlagt høydosebehandling
|
Diagnose
|
Antall pasienter
|
|
Tidligere behandling
|
|
|
|
|
Hodgkins sykdom (n = 2) og Non-Hodgkins lymfom (n = 20)
|
22
|
35(14 – 56)
|
10(5 – 14)
|
6(27)
|
|
Myelomatose
|
15
|
55(46 – 62)
|
3(3 – 9)
|
3(20)
|
|
Sarkom
|
4
|
22(17 – 38)
|
8(4 – 12)
|
0
|
|
Testikkelkreft (ikke-seminom)
|
4
|
20(15 – 33)
|
6(3 – 8)
|
0
|
|
Brystkreft
|
2
|
54(52 – 54)
|
3(3 – 3)
|
0
|
|
Akutt lymfatisk leukemi
|
1
|
24
|
6
|
0
|
|
Amyloidose
|
1
|
54
|
3
|
0
|
Det var likevel ikke store forskjeller mellom gruppen av pasienter med maligne lymfomer og myelomatosepasientene med henblikk på evnen til å mobilisere stamceller fra beinmarg til blod (tab 3). Imidlertid forelå det en enorm variasjon mellom pasientene innen hver enkelt pasientgruppe. Blant lymfompasientene har de pasientene som har mobilisert dårlig, stort sett vært hardt forbehandlet.
Tabell 3 Stamcellemobilisering og høsting fra perifert blod, alle pasienter
|
Diagnose
|
Antall pasienter stamcelle-høstet
|
Antall stamcelle-høstinger per pasient
|
Antall sirkulerende CD34-positive celler × 103/ml blod) på dager med stamcellehøsting
|
Antall dager mellom oppstart av mobiliseringskur og høsting av stamceller
|
Antall liggedøgn i forbindelse med stamcelle-høsting per pasient
|
Antall CD34-positive celler × 106/kg høstet totalt per pasient
|
|
Hodgkins sykdom (n = 2) og non-Hodgkins lymfom (n = 20)
|
22
|
2 (1 – 7)
|
48 (3 – 174)
|
12 (10 – 14)
|
3 (2 – 25)
|
9 (2 – 30)
|
|
Myelomatose
|
15
|
2 (1 – 3)
|
50 (5 – 196)
|
11 (10 – 16)
|
3 (2 – 7)
|
7 (3 – 38)
|
|
Sarkom
|
4
|
3 (1 – 4)
|
22 (7 – 89)
|
15 (12 – 22)
|
6 (3 – 19)
|
5 (3 – 16)
|
|
Testikkelkreft (ikke-seminom)
|
4
|
2 (1 – 5)
|
22 (6 – 79)
|
14 (12 – 17)
|
5 (3 – 8)
|
8 (3 – 10)
|
|
Brystkreft
|
2
|
2 (2 – 2)
|
128 (68 – 181)
|
10 (10 – 10)
|
3 (3 – 3)
|
25 (21 – 28)
|
|
Akutt lymfatisk leukemi
|
1
|
2 –
|
14 (12 – 16)
|
12 –
|
7 –
|
3,4 –
|
|
Amyloidose
|
1
|
3 –
|
35 (10 – 57)
|
5 –
|
4 –
|
12 –
|
Tabell 3 viser at pasienter med sarkom og testikkelkreft har mobilsert lavere antall stamceller i perifert blod. I tillegg har de vært mer uforutsigbare med henblikk på hvilken dag de har nok stamceller i blodet for å bli høstet. Trenden har vært at disse pasientene ofte har brukt lengre tid enn de andre pasientgruppene på å mobilisere stamceller.
Høydosebehandling og reinfusjon av autologe stamceller
De forskjellige kondisjoneringsregimene som ble gitt til de forskjellige diagnosegruppene er vist i tabell 4. Kun e…n pasient med lymfoblastlymfom fikk helkroppsbestråling. Våre pasienter har ikke hatt alvorlige irreversible komplikasjoner til selve stamcellehøstingen eller høydosebehandlingen.
Alle pasientene, med unntak av e…n lymfompasient, viste tegn til full beinmargsregenerasjon etter høydosebehandling og reinfusjon. Denne lymfompasienten hadde utviklet beinmargsresidiv, som han døde av 78 dager etter høydosebehandlingen. For de onkologiske pasientene generelt var de største problemene i aplasiperioden knyttet til infeksjoner og mucosittproblemer i form av sår i munnslimhinne og diare…. Alle pasientene, så nær som en, fikk febril sykdom i aplasiperioden. Bare unntaksvis var det oppvekst i blodkultur. Førstelinjebehandling var kombinasjonen penicillin og netilmicin, med tillegg av metronidazol ved febril diare…. Ingen onkologiske pasienter utviklet livstruende infeksjoner som krevde respiratorbehandling eller kirurgisk behandling, men e…n pasient utviklet reversibel nyre- og hjertesvikt i den febrile fasen. Ingen lymfompasienter fikk G-CSF i aplasifasen, mens pasientene med brystkreft, testikkelkreft og sarkomer fikk G-CSF i denne perioden i henhold til protokollene de var inkludert i.
Hos flesteparten av myelomatosepasientene var det få problemer i aplasiperioden etter høydosebehandling. Noen fikk feber og ble behandlet med antibiotika på vanlig måte, med penicillin/aminoglykosid som førstevalg av preparat. En pasient hadde lang liggetid etter høydosebehandling pga. langsom beinmargsregenerasjon. Denne pasienten hadde også problemer med å mobilisere nok stamceller til blodbanen i forbindelse med stamcellehøsting.
Myelomatosepasientene hadde et noe lavere forbruk av blodprodukter i aplasiperioden enn de andre pasientgruppene (tab 4). Det var ikke store forskjeller vedrørende lengde av aplasiperioden mellom de forskjellige pasientgruppene. Dog forelå det en betydelig interindividuell variasjon innenfor den enkelte diagnosegruppe.
Tabell 4 Høydosebehandling, alle pasienter
|
Diagnose
|
Antall pasienter
|
Antall høy-doser
|
Reinfundert stamcelleprodukt
|
Beinmargsrekonstitusjon
|
|
CD34-positive celler × 10 6 /kg
|
CFU × 10 4 /kg
|
Dager før trombocytter > 20 × 10 9 /l
|
Dager før nøytrofile granulocytter > 0,5 × 10 9 /l
|
Antall erytrocytt-konsentrat transfundert
|
Antall trombocytt-konsentrat transfundert
|
Liggedøgn etter reinfusjon
|
|
Hodgkins sykdom (n = 2) og non-Hodgkins lymfom (n = 19)
|
21
|
21
|
5,4(2,0 – 14,4)
|
33 (8 – 76)
|
11(9 – 28)
|
12(9 – 31)
|
4(3 – 17)
|
4(3 – 17)
|
16(12 – 78)
|
|
Myelomatose
|
15
|
15
|
5,3(2,7 – 18,3)
|
70 (8 – 272)
|
11(8 – 32)
|
10(9 – 11)
|
2(0 – 12)
|
1(0 – 6)
|
14(12 – 32)
|
|
Sarkom
|
4
|
7
|
3,7(2,7 – 4,6)
|
51(38 – 128)
|
12(10 – 13)
|
9(6 – 18)
|
5(0 – 8)
|
5(2 – 10)
|
15(13 – 24)
|
|
Testikkelkreft
|
2
|
3
|
5,5(3,9 – 6,3)
|
39(30 – 48)
|
11(11 – 11)
|
10(9 – 10)
|
4(4 – 7)
|
7(7 – 8)
|
17(17 – 19)
|
|
Brystkreft
|
2
|
2
|
4,5(4,4 – 4,9)
|
83(77 – 88)
|
9 (8 – 10)
|
9(9 – 9)
|
4(4 – 4)
|
3(2 – 5)
|
15(14 – 16)
|
|
Akutt lymfatisk leukemi
|
1
|
1
|
2,9
|
36
|
11
|
8
|
11
|
5
|
33
|
|
Amyloidose
|
1
|
1
|
2,2
|
13
|
12
|
9
|
0
|
1
|
13
|
Hvordan går det med våre høydosebehandlede pasienter?
Vi har kort observasjonstid og relativt få pasienter, derfor kan det ikke trekkes bastante konklusjoner om nytten av denne behandlingen. Tabell 5 indikerer likevel at omtrent halvparten av den samlede pasientgruppen er i komplett remisjon 4 – 38 md. etter avsluttet behandling.
Vel halvparten av våre lymfompasienter er i komplett remisjon. Blant dem som utviklet residiv innenfor lymfomgruppen, har det vært overrepresentasjon av pasienter som har hatt usikker respons på induksjonskjemoterapi før høydosebehandling, usikker histologisk diagnose eller residiv i sentralnervesystemet.
Kun e…n av 15 myelomatosepasienter er død på det nåværende tidspunkt. Imidlertid er det relativt få av disse pasientene som lever uten sykdom.
To av de fire pasientene med sarkom er døde pga. residiv, en har nylig utviklet residiv sju måneder etter høydosebehandling, og e…n pasient er i komplett remisjon seks måneder etter avsluttet høydosebehandling.
Diskusjon
Vår erfaring tilsier at høydosebehandling med perifer stamcellestøtte kan gjennomføres på regionalt nivå, og at ansvar for stamcellehøsting og prosessering trygt kan legges til blodbanken. Dette er i overensstemmelse med en tidligere publisert konklusjon fra Tromsø (4). Denne behandlingen krever et godt tverrfaglig samarbeid mellom klinisk avdeling, blodbank, immunologisk laboratorium, klinisk-kjemisk laboratorium, røntgenavdeling og anestesiavdeling. Vår erfaring er at dette samarbeidet har gått bedre etter at en sykepleier ble ansatt i deltidsstilling som koordinator.
Ut fra våre erfaringer kan måling av sirkulerende leukocytter ikke brukes til å forutsi noe om forventet utbytte av stamceller ved stamcellehøsting. Derimot kan LPK-verdien brukes som en indikator for å forutsi når pasienten bør begynne å måle stamceller i perifert blod og sannsynligvis snart vil være klar for stamcellehøsting (dersom han/hun har evne til å mobiliserer stamceller). Ved vårt sykehus praktiserer vi nå at pasienten kan vente med å måle stamceller i perifert blod (en teknikk som krever spesialfarging og væskestrømscytometriske undersøkelse) inntil leucocyttallet er> 1,5 × 109/l. Denne grensen er satt til 2,0 × 109/l i helger. Dette tilsier at en pasient ikke trenger være innlagt i regionsykehuset før leukocyttverdien nærmer seg denne grensen.
Den påviste signifikante relasjon mellom stamcellemengde i blod og i høsteprodukt (fig 2) medfører at vi ved å gjøre daglige CD34-målinger i blod kan ta stilling til når det vil være optimalt å høste. Vi kan også forutsi hvor stort utbytte vi kan forvente av hver stamcellehøsting. Siden pasienter med testikkelkreft og pasienter med sarkom har vist seg å bruke lengre tid på å mobilisere stamceller ut i blodbanen, er det viktig ikke å høste disse pasientene for tidlig.

Figur 2 Relasjon mellom CD34-positive celler i blod målt før stamcellehøsting og innhold av CD34-positive celler i det høstede afereseprodukt. Ved hver aferese (stamcellehøsting) er det høstet stamceller fra 2,5 – 3 ganger pasientens blodvolum
Sammenliknet med resultater som tidligere er fremlagt fra Tromsø (4), kan det virke som om våre onkologiske pasienter har hatt større problemer med å mobilisere stamceller ut i blodbanen, til tross for at mobiliseringsregimene har vært like. Våre resultater er imidlertid i overensstemmelse med rapporter fra større sykehus i utlandet, hvor man melder at 10 – 20 % av pasientene har problemer med å mobilisere nok stamceller (6, 7). Andre rapporter har vist en klar relasjon mellom mengde kjemoterapi og kombinasjonen av kjemoterapi og strålebehandling som pasientene har gjennomgått og dårlig mobiliseringsevne (8). Dette ble til dels bekreftet hos våre onkologiske pasienter. For å øke mobiliseringen av stamceller fra denne gruppen pasienter vil muligens bruk av nye hematopoetiske vekstfaktorer (9) eller ex vivo-ekspansjon av de høstede stamcellene (10) kunne gi et bedre resultat.
Det var noe overraskende at pasientgruppen med sarkom og pasientene med testikkelkreft, til tross for dårlig mobiliseringsevne som kan være forenlig med dårlig beinmargsfunksjon, ikke syntes å ha større problemer med beinmargsregenerasjon etter høydosebehandling. Vi tror at den viktigste grunnen til at beinmargsregenerasjonsevnen ikke varierte mer mellom de enkelte diagnosegruppene, er at ingen pasienter ble reinfundert med mindre enn 2 × 106 CD34-celler/kg. Likeledes var det ikke store forskjeller mellom reinfundert stamcellemengde blant de forskjellige pasientgruppene.
Grad av kjemosensitivitet kan i enkelte tilfeller være vanskelig å vurdere, for eksempel ved tumorer i mediastinum eller intraabdominalt. Blant våre lymfompasienter som har utviklet residiv innen seks måneder etter høydosebehandling, var det hos flere knyttet usikkerhet til histologisk diagnose og til grad av respons på induksjonsbehandling før høydosebehandling. Vi mener derfor at våre erfaringer støtter en praksis som tilsier at krav til kjemosensitivitet og utvelgelse av lymfompasienter som skal motta høydosebehandling, fortsatt bør være streng.
Våre sarkompasienter har vært svært ressurskrevende. De har i utgangspunktet fått mye kjemoterapi og har derfor hatt problemer med å mobilisere stamceller. Samtidig har de vært innlemmet i protokoller som anbefaler dobbel høydosebehandling, med behov for dobbel mengde stamceller. Disse pasientene har derfor ligget lenge i sykehus (tab 5). For slike pasienter kan det derfor være viktig å planlegge eventuell stamcellehøsting tidlig i behandlingsforløpet hvis man tror at pasienten kan bli kandidat for høydosebehandling. Tre av de fire sarkompasientene residiverte raskt etter høydosebehandlingen. Dette nedslående resultatet viser hvor viktig det er å behandle disse pasientene i protokoller som på sikt vil kunne gi mulighet for å evaluere nytten av denne behandlingen.
Tabell 5 Totalt antall liggedøgn i sykehus i forbindelse med mobiliseringskur, stamcellehøsting, høydosebehandling, aplasiperiode, og klinisk status 4 – 38 md. etter høydosebehandling med autolog stamcellestøtte
|
Diagnose
|
Antall pasienter høydosebehandlet
|
Liggedøgn
|
Klinisk status
|
|
i forbindelse meden eller flere høydoser
|
Antall pasienteri live
|
Antall pasienter i live og komplett remisjon
|
|
Hodgkins sykdom (n = 2) og non-Hodgkins lymfom (n = 19)
|
21
|
32(27 – 95)
|
15 (71 %)
|
10 (52 %)
|
|
Myelomatose
|
15
|
30(26 – 53)
|
14 (93 %)
|
5 (33 %)
|
|
Sarkom
|
4
|
75(33 – 85)
|
2 (50 %)
|
1 (25 %)
|
|
Testikkelkreft
|
2
|
55(37 – 72)
|
2
|
2
|
|
Brystkreft
|
2
|
32(31 – 33)
|
2
|
2
|
|
Akutt lymfatisk leukemi
|
1
|
50
|
1
|
0
|
|
Amyloidose
|
1
|
27
|
1
|
0
|
I løpet av disse tre årene har vi lært mye om stamcellehøsting og høydosebehandling. Likevel viser det seg at spesielle problemer, særlig når det gjelder inklusjon av pasienter, kan være vanskelig. Vi beklager derfor at den nasjonale faggruppen for høydosebehandling med autolog stamcellestøtte ikke lenger er i funksjon i Norge. Vi tror det er behov for et forum som har ansvar for felles nasjonale retningslinjer for innlemming av pasienter til denne ressurskrevende behandlingen, og som kan være åpen for diskusjon av ”problempasienter”.
Denne faggruppen kunne også ta stilling til spørsmålet om sentralisering, et tema som stadig kommer opp til diskusjon, spesielt med tanke på de små pasientgruppene. Vår erfaring fra Haukeland Sykehus viser at problemene knyttet til høydosebehandling med stamcellestøtte er mer generelt relatert til komplikasjoner i aplasifasen enn til grunnsykdommen. Dette kan være et argument mot sentraliseringstanken. I tillegg vil sentralisering i perioder kunne medføre et uakseptabelt lavt behandlingsvolum i regionsykehus med lavt befolkningsgrunnlag. Man kan likevel tenke seg at enkelte grupper med høy behandlingsrelatert mortalitetsrisiko, for eksempel pasienter med kompliserende hjerte- eller nyresykdom eller pasienter med Hodgkins sykdom som har gjennomgått kappefeltbestråling, bør sentraliseres. Det samme kunne være aktuelt for sjeldne pasientgrupper som behandles etter en spesiell eksperimentell protokoll som kun tilbys ved ett bestemt sykehus.
Det kommer stadig ny kunnskap om nye utviklingsmetoder når det gjelder manipulering av stamcelleproduktet, slik som positiv/negativ seleksjon og ex vivo-ekspansjon. Vi tror det kan være verdifullt at også disse nye metodene og annen ny kunnskap relatert til stamcellehøsting og høydosebehandling blir diskutert i en nasjonal fag- eller interessegruppe. I Norge er fagmiljøet som er involvert i høydosebehandling med stamcellestøtte lite og oversiktlig, og det nasjonale samarbeidet har vært svært godt. Alt ligger derfor vel til rette for at man også i fremtiden vil være lojal overfor de nasjonale retningslinjer (1) og eventuelle anbefalinger basert på vitenskapelig dokumentasjon som måtte komme fra en nasjonal faggruppe.
Konklusjon
Våre funn bekrefter at regionalisering av høydosebehandling med autolog stamcellestøtte er fullt ut forsvarlig, og at behandlingskriteriene fortsatt bør være strenge. Selv om det var store forskjeller i hvor godt forskjellige pasienter mobiliserte CD34-positive celler ut i perifert blod, var kliniske tegn til beinmargsregenerasjon etter høydosebehandling med stamcellestøtte tilfredsstillende for alle pasientene. Vi anbefaler at det på nytt etableres en nasjonal faggruppe som kan gi retningslinjer og råd om høydosebehandling med autolog stamcellestøtte.