Immunterapi
Enkelte kliniske observasjoner (sen metastasering, lang levetid til tross for fjernmetastaser, spontanremisjon av metastaser) har ført til at man i mange år har mistenkt at immunsystemet har betydning for forløpet av denne tilstanden. Etter at immunmodulerende terapi er blitt en behandlingsmulighet, har man prøvd å innvirke på forløpet av metastaserende nyrekreft på denne måten. De mest aktuelle immunmodulerende medikamenter i behandling av metastaserende nyrekreft er interferoner og interleukiner (6), enten gitt som monoterapi eller i kombinasjon eller sammen med kjemoterapi. Andre cytokiner som tumornekrosefaktor er blitt utprøvd, men har ikke vist seg effektive.
Interferoner. Mest anvendt er alfainterferon (interferon- α ) (7 – 9). Stoffet er i Norge registrert for behandling av metastaserende nyrekreft. Den kliniske effekten av interferon- β i behandling av metastaserende nyrekreft er omtrent den samme som for interferon- α , men interferon- β er ikke kommersielt tilgjengelig i samme grad som interferon- α . Interferon- γ gir ingen terapeutisk gevinst sammenliknet med placebo og anbefales ikke i behandlingen av metastaserende nyrekreft (10).
Interferon- α fører til forandring av immunresponsen hos pasienter med metastaserende nyrekreft (6). I tillegg har stoffet en angiogenesehemmende virkning. Eksperimentelle data tyder også på at interferon- α er direkte cytotoksisk for cellelinjer. Enkelte pasienter lager antistoffer mot interferon- α under behandlingen, uten at man har kunnet vise at dette reduserer effekten på tumor (17). Ved persisterende enkelmetastaser til tross for interferon- α -terapi bør kirurgisk ekstirpasjon vurderes.
Toksisitet. Feber og muskelsmerter opptrer hos nesten alle pasienter og utvikles allerede etter den første injeksjonen. En sjelden gang sees akutt forvirring i oppstartingsfasen, med hjernemetastaser som den viktigste differensialdiagnosen. Under pågående interferon- α -terapi avtar den subjektive toksisiteten med tiden, men over lang tid utvikler de fleste pasienter anoreksi, depresjon og en generell matthetsfølelse. Alle bivirkninger forsvinner raskt etter seponering av interferon- α .
Den akutte toksisiteten reduseres ved å gi paracetamol 500 mg ⋅ 2 – 3 per os daglig. Ved vedvarende intoleranse kan reduksjon av dagsdosen med 30 – 50 % bli aktuelt. Det foreligger imidlertid en viss dose-respons-relasjon, slik at den daglige interferon- α -dosen ikke bør være for lav. Hvis bivirkningene blir for plagsomme, slik at tidlig avslutning av behandlingen vurderes, kan oral medikasjon med små doser steroider (prednison 5 mg ⋅ 2 – 3) øke tolerabiliteten.
Erfaringsmessig avslutter 10 – 15 % av pasientene behandlingen med interferon- α før to måneder er gått på grunn av toksisiteten, særlig hvis pasienten initialt har redusert allmenntilstand.
Respons. Rapporterte respons- og overlevelsesrater er sterkt relatert til seleksjonen av pasientene. De høyeste responsrater er oppnådd hos pasienter som bare har lunge- eller lymfeknutemetastaser, har en senkning< 40 – 50 mm, intet vekttap og er i god allmenntilstand. Hos pasienter med lite tumorvolum er sjansen for å oppnå objektiv respons som regel bedre enn hos pasienter med utbredte metastaser. Et metastasefritt intervall på mer en ett eller to år etter nefrektomi er også relatert til gunstig respons på interferon- α . De fleste onkologer ekskluderer pasienter uten nefrektomi fra interferon- α -behandling, selv om grunnlaget for en slik eksklusjon ikke er helt klarlagt. Avhengig av utvalg av pasientene som tilbys interferon- α -terapi er de objektive responsratene rapportert til mellom 8 % og 44 %. I gjennomsnitt kan man regne med en responsrate på 10 – 15 %. Varige komplette remisjoner er sjeldne, men forekommer (6 – 9).
Overlevelse. I de fleste serier med flere enn 100 interferon- α -behandlede pasienter rapporteres en toårsoverlevelse på omkring 20 %. Hvorvidt dette er en effekt av interferon- α eller gjenspeiler sykdommens naturlige forløp hos positivt selekterte pasienter, er et åpent spørsmål som bare kan besvares ved randomiserte studier med placebo (eller placeboliknende medikasjon) i kontrollarmen. To nylig publiserte studier har vist at interferon- α -monoterapi eller kombinasjonsbehandling med interferon- α og vinblastin øker overlevelsen med 4 – 6 måneder i forhold til pasienter som ikke har fått interferon- α -basert immunterapi (8, 9). I en tredje studie var interferon- α kombinert med vinblastin ikke mer effektivt enn interferon- α -monoterapi (7). Hvis man kombinerer resultatene av disse tre studiene antar vi at interferon- α -monoterapi gir en beskjeden, men statistisk signifikant overlevelsesgevinst hos selekterte pasienter med metastaserende nyrekreft, med en liten mulighet for varig helbredelse hos noen få pasienter.
Erfaringer ved Det Norske Radiumhospital med interferon-a. De ovennevnte seleksjonskriterier gjør at bare 20 – 30 % av pasientene som er blitt henvist til Radiumhospitalet i tiden1982 – 91, ble ansett som kandidater for interferon- α -behandling (tab 2). All interferon- α -terapi ble gitt i forbindelse med fase II- eller fase III-studier. Hos de 158 pasientene med metastaserende nyrekreft som har fått interferon- α som mono- eller kombinasjonsterapi (uten interleukiner) observerte man en toårsoverlevelse på 27 % (fig 3, tab 2). Seks pasienter levde i mer enn ti år, fem av dem er tumorfrie. En nærmere analyse bekrefter de ovennevnte seleksjonskriteriene for gunstig respons og forlenget overlevelse: God allmenntilstand, SR< 40 mm og fravær av vekttap i de siste seks måneder disponerte for gunstig overlevelse. Ut fra disse resultater kunne man definere to risikogrupper (fig 4). Minst to av følgende tre kriterier er oppfylt:
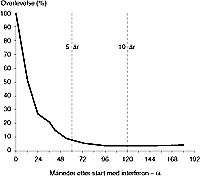
Figur 3 Overlevelse hos 158 pasienter med metastaserende nyrekreft etter start av interferon- α -basert immunterapi (uten interleukiner). Det Norske Radiumhospital 1982 – 91.
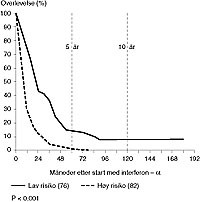
Figur 4 Overlevelse av pasienter med metastaserende nyrekreft og prognostiske grupper (samme pasienter som i fig 3)
|
Tabell 2 Interferfon- α -basert systemisk behandling (uten interleukiner) av metastaserende nyrekreft ved Det Norske Radiumhospital, 1982 – 91
|
|
Prognosegruppe 1
|
|
God
|
Dårlig
|
Total
|
|
Antall pasienter
|
76
|
82
|
158
|
|
Funksjonstilstand
|
|
|
|
|
0
|
55
|
24
|
79
|
|
1
|
20
|
42
|
62
|
|
2
|
1
|
16
|
17
|
|
Metastasefritt intervall (md.)
|
16 (1 – 240) 2
|
8 (1 – 201)
|
9 (1 – 240)
|
|
Antall pasienter med seponering av IFN- α innen 2 md
|
4
|
23
|
|
|
Objektiv respons
|
|
|
|
|
Remisjon (partiell eller komplett)
|
18 (24 %)
|
11 (13 %)
|
29 (18 %)
|
|
I live (1.7. 1998)
|
6 3
|
–
|
6
|
|
Død
|
70
|
82
|
152
|
|
|
Lav risiko (gunstig prognose)
Hos pasienter i denne gruppen er responsraten til interferon- α behandlingen> 20 %, samtidig med at terapiseponering innen to måneder bare forekommer unntaksvis (tab 2)
Høy risiko (ugunstig prognose)
Interleukiner. Interleukiner er cytokiner med varierende virkningsmekanismer, hvor stimulasjon av cytotoksiske T-celler og produksjon av andre cytokiner er de viktigste i anticancerbehandling. Ved behandling av metastaserende nyrekreft er interleukin-2 (IL-2) mest brukt. Stoffet kan gis intravenøst, men da med betydelige bivirkninger (blodtrykksfall, høy feber, kardio- og nefrotoksisitet) (11, 12). Gitt subkutant er bivirkningene atskillig mindre, uten at behandlingen er mindre effektiv ved riktig dosering. Responsraten for IL-2-monoterapi er 15 – 20 % hos pasienter med metastaserende nyrekreft. IL-2-behandling forutsetter regelmessige kontroller og hyppige dosereguleringer ved onkologiske spesialenheter. Interleukin-2 er ikke registrert i Norge for behandling av metastaserende nyrekreft.
Kombinert immunterapi. Interferon- α øker muligens anticancereffekten av interleukin-2, en hypotese som nylig er bekreftet i en trearmet randomisert fransk multisenterstudie (11). Man sammenliknet interferon- α -monoterapi (subkutant) med IL-2-monoterapi (intravenøst) og kombinasjonen av interleukin-2 (intravenøst) og interferon- α (subkutant). Responsraten for kombinasjonsbehandling var signifikant bedre enn for monoterapiarmene. På grunn av økt antall toksiske dødsfall i kombinasjonsarmen var det imidlertid ingen forbedring av totaloverlevelsen ved interleukin-2-interferon- α -terapi. Denne studien har igjen understreket de tidligere erfaringer:
– Immunbehandling av metastaserende nyrekreft er lite virksomt hos pasienter med nedsatt allmenntilstand, kort metastasefritt intervall, levermetastaser eller metastaser til flere organsystemer
– Pasienter som får immunbehandling for metastaserende nyrekreft, må akseptere et relativt høyt nivå av subjektiv og delvis objektiv toksisitet
– Immunbehandling av metastaserende nyrekreft krever hyppige legekontroller og dosejusteringer, spesielt hvis interleukin-2 inngår i terapien
Subkutan interleukin-2-interferon- α -behandling er i fase II-studier blitt kombinert med intravenøse injeksjoner av 5-fluorouracil, med responsrater på 20 – 40 % og median overlevelse på mellom 12 og 40 måneder, avhengig av pasientseleksjonen (13). Ved denne trippelbehandlingen (interleukin-2, interferon- α , 5-fluorouracil) må pasienten være forberedt på betydelig subjektiv toksisitet i form av feber, anoreksi, slapphet og muskelsmerter. Ved tilstrekkelig onkologisk ekspertise, hyppige kontroller og adekvate dosejusteringer kan behandlingen imidlertid hovedsakelig gjennomføres poliklinisk hos en samarbeidende og motivert pasient.
Annen eksperimentell immunbehandling. I in vitro-forsøk har man funnet en synergistisk effekt av interferon- α og vitamin A-derivater mot cellelinjer av nyrekreft (14). Fase II-studier har bekreftet økt effektivitet av denne kombinasjonen i forhold til interferon- α -monoterapi (15). En nylig avsluttet fase III-studie har på den andre siden ikke vist noen bedre responsrate eller forlenget overlevelse ved denne kombinasjonen, sammenliknet med behandling med interferon- α alene (16). Det er imidlertid behov for et bekreftende eller avkreftende klinisk eksperiment. Kombinasjonen interferon- α og et vitamin A-derivat testes derfor for tiden i en europeisk multisenterstudie der Radiumhospitalet deltar.
Applikasjon og gjennomføring. Interferon- α gis intramuskulært eller subkutant. Ved metastaserende nyrekreft gis interferon- α enten som 9 ⋅ 106 internasjonale enheter (IE) daglig eller som 18 ⋅ 106 IE tre ganger i uken. Disse dagsdoser bør oppnås ved en gradvis økning av enkeltdosene over en 1 – 2 ukers periode. Den daglige dosen må balanseres mot toksisiteten, som igjen øker med stigende enkeldoser. Man har inntrykk av at daglige doser av interferon- α tolereres bedre enn interferon- α -injeksjoner gitt på alternative dager. Ved aksepterbar toksisitet bør interferon- α -behandlingen gis i minst to måneder før respons vurderes. Det har vært vanlig å fortsette behandlingen i ett år hos pasienter der man har sett gunstig effekt. Interferon- α bør seponeres ved enhver progrediering av sykdommen. På grunn av relativt sterke bivirkninger under de 1 – 3 første injeksjoner bør interferon- α -behandling startes mens pasienten er innlagt i sykehus. Deretter kan behandlingen gjennomføres poliklinisk. Injeksjonene gis av privatlege eller hjemmesykepleier eller ved at pasienten utfører selvinjeksjon. For å vurdere tolerabiliteten bør pasienten tilsees av ansvarlig klinikker med interesse for og kunnskap om immunbehandling to ganger i måneden i løpet av de f&osl
ash;rste åtte ukene, senere med en måneds mellomrom.