Felles for statinene er at de reduserer syntesen av kolesterol ved å hemme enzymet 3-hydroksy-3-metylglutaryl-koenzym A-reduktase (HMG-CoA-reduktase). De enkelte statiner er innbyrdes forskjellige med hensyn til fysikalske og kjemiske egenskaper og farmakokinetikk (1 – 5). Simvastatin, lovastatin, atorvastatin, cerivastatin og fluvastatin regnes som lipofile, mens pravastatin er et mer hydrofilt statin (1). De fleste statiner metaboliseres via cytokrom P450-systemet (CYP). Simvastatin, lovastatin, atorvastatin og cerivastatin er substrater for enzymet CYP 3A4. Fluvastatin metaboliseres hovedsakelig via CYP 2C9. Pravastatin metaboliseres i liten grad via CYP, og ca. 50 % av legemidlet i serum utskilles uforandret i urinen (1 – 5). Det er antatt at i løpet av en 5 – 6-årsperiode vil 50 % av pasientene som behandles med statiner, også bruke andre legemidler som metaboliseres via CYP-systemet (2).
Interaksjoner og disponerende tilstander
De fleste tilfeller av alvorlige muskelbivirkninger ved behandling med statiner skyldes legemiddelinteraksjoner, gjerne der det er disponerende tilstander. Statiner har lav biotilgjengelighet, og kombinasjoner med legemidler eller næringsstoffer som signifikant øker biotilgjengeligheten eller hemmer eliminasjonen kan gi økt risiko (tab 1). Substanser som er hemmere av CYP 3A4 i tarm og lever eller P-glykoprotein (Pgp) i tarm, kan gi økt biotilgjengelighet av statiner (1, 3, 5). Hemming av ulike transportmekanismer, inkludert Pgp i lever og nyre, kan gi nedsatt eliminasjon via galle og urin (1, 3). Alvorlige muskelbivirkninger ved bruk av statiner kan også skyldes farmakodynamiske eller toksiske interaksjoner ved bruk sammen med andre typer lipidsenkende legemidler (tab 1) (1, 4). Kombinasjoner av flere mekanismer er foreslått for bl.a. fibrater, som kan påvirke lever- og nyrefunksjon i tillegg til at de selv kan være myotoksiske, og for soppmidler av azoltypen, som hemmer CYP 3A4 og i tillegg hemmer trinn i kolesterolbiosyntesen. Nedsatt lever- og nyrefunksjon, transplantasjoner, hypotyreose, høy alder og alvorlige infeksjoner er eksempler på disponerende tilstander (1, 3, 6). Utvikling av myopati er vanligvis en kompleks interaksjon mellom statin, sykdom og andre legemidler, og dette gjør at det er vanskelig å forutsi hvilke pasienter som vil utvikle alvorlige muskelbivirkninger.
|
Tabell 1 Eksempler på legemidler og næringsmidler som kan gi økt risiko for alvorlige muskelbivirkninger i kombinasjon med statiner, foreslåtte hovedmekanismer for interaksjonene og eksempler på statiner med potensial for interaksjonene
|
|
Legemiddelgrupper eller næringsmidler
|
Mekanisme 1
|
Statiner
|
|
Immunsuppressiver (ciklosporin)
|
1
|
Alle
|
|
Antibiotika (erytromycin, klaritromycin)
|
1
|
Lovastatin, simvastatin, atorvastatin, cerivastatin
|
|
Soppmidler (ketokonazol, itrakonazol)
|
1
|
Lovastatin, simvastatin, atorvastatin, cerivastatin
|
|
Kalsiumantagonister (diltiazem, verapamil)
|
1
|
Lovastatin, simvastatin, atorvastatin, cerivastatin
|
|
Næringsmidler (grapefruktjuice)
|
1
|
Lovastatin, simvastatin, atorvastatin, cerivastatin
|
|
Fibrater (gemfibrozil, klofibrat, bezafibrat)
|
2
|
Alle
|
|
Nikotinsyrederivater (nikotinsyre, niceritrol)
|
2
|
Alle
|
|
1 1 = økt serumkonsentrasjon av statinet via en farmakokinetisk interaksjon, 2 = farmakodynamisk eller toksisk interaksjon
|
Mekanisme(r) for alvorlige muskelbivirkninger
Hvordan statiner gir muskelcelleskade, er ikke endelig klarlagt. Hemming av HMG-CoA-reduktase i lever og perifert vev kan redusere produksjonen av ubiquinon (Koenzym Q10). Ubiquinon er et lipidløselig stoff knyttet til elektrontransportkjeden i mitokondriene. Det er rapportert en reduksjon på omkring 30 % av ubiquinon i serum etter fire ukers behandling med simvastatin (20 mg/dag), og denne reduksjonen var parallell med reduksjonen i total- og LDL-kolesterolnivå (7). Nedsatt syntese og tilførsel av ubiquinon til elektrontransportkjeden i muskelceller kan tenkes å gi redusert produksjon av høyenergifosfater (ATP), med påfølgende celleskade. Det er også rapportert at ubiquinon har antioksidative egenskaper i cellemembraner og lipoproteinpartikler. I en studie hvor 19 pasienter med hyperkolesterolemi ble behandlet med simvastatin (20 mg/dag) i seks måneder, fant man imidlertid ingen reduksjon i konsentrasjonen av ubiquinon og høyenergifosfater i skjelettmuskulatur, og liten reduksjon av antioksidanter i lipoproteiner (8). Redusert mengde kolesterol og kolesterolderivater er en annen foreslått mekanisme – ved at de gjør cellemembraner mer ustabile. Endelig kan en direkte toksisk effekt av statiner ikke utelukkes.
CK, myopati og rabdomyolyse
Statiner kan gi lettere, forbigående bivirkninger i form av muskelsmerter (myalgier), uten økning av CK-verdi. I sjeldne tilfeller kan de imidlertid gi alvorlige muskelbivirkninger som myopati og rabdomyolyse. Ved alvorlig myopati har pasienten smerter, ømhet og svakhet i muskulaturen og gjerne en markert økning av CK-verdi (CK> 10 ganger øvre normalverdi). En slik tilstand kan utvikle seg når som helst i forløpet av behandlingen, noe som ikke er uventet når legemiddelinteraksjoner og disponerende tilstander er viktige for alvorlige muskelbivirkninger. Ved rabdomyolyse finner man gjerne akutte muskelsmerter, kramper, oppkast og mørk urin. Myoglobin, som frigjøres fra ødelagte muskelceller, er nefrotoksisk, og nyresvikt med alvorlige elektrolyttforstyrrelser kan kreve behandling med dialyse (6, 9). En rekke forhold kan imidlertid gi økt totalaktivitet av CK i serum eller symptomer fra muskel- og skjelettsystemet, som myalgi, uavhengig av behandling med statiner. En asymptomatisk forhøyning av CK til mer enn tre ganger øvre normalverdi er observert hos 3 – 5% av pasienter som bruker statiner, uten at den er av klinisk betydning og uten at seponering er nødvendig.
Praktiske forholdsregler
Ved et isolert funn av moderat økt totalaktivitet av CK i serum kan sykehistorien gi holdepunkter for mer trivielle årsaker som fysisk aktivitet, mindre traumer og intramuskulær injeksjon. Dosereduksjon eller seponering av statiner bør derfor baseres på en klinisk vurdering av muskelaffeksjon kombinert med måling av CK (fig 1) (10). Rutinemessig måling av CK-nivået før og under behandling med statiner kan være nyttig, men alvorlig myopati kan oppstå relativt akutt uten forutgående langvarig forhøyet verdi (6). Måling av CK isoenzymer kombinert med andre biokjemiske markører kan gi tilleggsinformasjon om hvilken type muskelvev som er affisert. Pasienter bør instrueres om å kontakte lege ved smerter eller svakhet i muskulatur, alvorlig sykdomsfølelse og influensaliknende symptomer. Finner man i tillegg markert økning av CK-verdien, bør statinet seponeres. Når tilstanden oppdages raskt, er myopatien reversibel og risikoen for nyresvikt liten. Når pasienten er symptomfri og CK-nivået er normalisert, kan det bli aktuelt å prøve et annet statin i lav dose og samtidig monitorere pasienten. Hvis det er indikasjon for kombinasjoner av legemidler som kan gi økt risiko for alvorlige muskelbivirkninger, anbefales det å innlede behandlingen med lave doser.
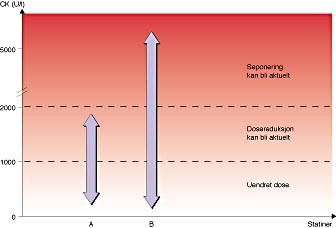
Figur 1 kjematisk fremstilling av relasjonen mellom kreatinkinase (CK) i serum og behandling med statiner. A og B refererer til en liten studie (10) og viser områder for CK-verdier hos en gruppe på sju pasienter med nevromuskulære sykdommer før (A) og under (B) behandling med statiner (ev. kombinert med fibrater). Seks av pasientene hadde ingen bivirkninger. En pasient klaget over økt muskelsvakhet, men ingen av pasientene utviklet rabdomyolyse. De høyeste CK-verdiene sammenfalt med økt fysisk aktivitet. Resultatene viser at dosereduksjon eller seponering av statiner alltid bør baseres på en klinisk vurdering av muskelbivirkninger kombinert med måling av CK, og ikke på måling av CK alene
Spalten er redigert av Olav Spigset i samarbeid med Avdeling for legemidler ved Regionsykehuset i Trondheim og de øvrige klinisk farmakologiske miljøene i Norge
fakta
Biotilgjengelighet og eliminasjon av statiner er knyttet til legemiddelmetaboliserende enzymer som CYP 3A4 og transportører som P-glykoprotein (Pgp). Hemmere av disse strukturene kan gi økt serumkonsentrasjon av statiner og dermed økt risiko for alvorlige muskelbivirkninger
CYP 3A4
CYP 3A4 er det dominerende cytokrom P450-isoenzym, ikke bare i lever, men også i tarm. Enzymene er identiske i de to vev, men reguleres forskjellig. Aktiviteten kan derfor være høy i ett vev og lav i et annet. Enzymet er induserbart, og viser betydelige intra- og interindividuelle variasjoner i aktivitet. Alle xenobiotika som metaboliseres via CYP 3A4 kan i prinsippet fungere som hemmere av enzymet. Særlig effektive hemmere er soppmidler av azoltypen, makrolidantibiotika og grapefruktjuice. Fordi CYP 3A4 er strategisk plassert i tarm og lever, vil mange substrater, inkludert statiner, ha en lav biotilgjengelighet etter peroral dosering
P-glykoprotein (Pgp)
Pgp er medlem av superfamilien av ATP-bindende transportører, og er strukturelt beslektet med andre energikrevende transportsystemer. Det ble opprinnelig knyttet til multiresistens mot kjemoterapeutika i tumorceller, hvor det kunne transportere cytostatika ut av cellene via en energikrevende prosess. Pgp finnes imidlertid naturlig i kroppen, særlig i tarm, nyre, binyrer, lever, blod-hjerne-barrieren og i uterus. Vevsdistribusjonen antyder at transportøren har som funksjon å transportere xenobiotika ut i galle, urin og tarm samt forhindre at de akkumuleres i hjernen. Ciklosporin og verapamil er eksempler på hemmere av transportøren, og lovastatin og pravastatin er eksempel på substrater
Spalten er redigert av Olav Spigset i samarbeid med Avdeling for legemidler ved Regionsykehuset i Trondheim og de øvrige klinisk farmakologiske miljøene i Norge