Hvem av oss tenkte at den innfløkte fostersirkulasjonen vi lærte i preklinikken, skulle bli en del av praktisk klinisk diagnostikk og terapi? Men slik er det blitt. Det har skjedd ved hjelp av moderne ultralydteknologi. I dag er vi i full gang med å utfordre gamle forestillinger og etablere diagnostikk og behandling som hviler på dokumentert viten av det humane fosterets fysiologi. I det følgende påpekes særdrag i fostersirkulasjonen og ny informasjon om de tre føtale shuntene ductus venosus, foramen ovale og ductus arteriosus, for å forstå noe av grunnlaget for en raskt voksende diagnostikk.
En annerledes sirkulasjon
Morkaken har mange vitale funksjoner for fosterutviklingen. Det er derfor naturlig at fostersirkulasjon er spesielt organisert og i stor grad retter seg etter morkaken, som får ca. 40 % av det føtale kombinerte hjerteminuttvolum (summen av venstre og høyre hjertehalvdels ytelse) (1). Fordi morkaken utgjør et stort ekstra reservoar av blod (ved 20 uker 50 % og ved 40 uker 25 % av det totale blodvolum) (2), har fosteret også et betraktelig høyere sirkulerende blodvolum (dn 11 – 12 % av fostervekten) (3) enn det det nyfødte barnet har. Da intrauterine transfusjoner ble innført, ble også en annen side av denne sirkulasjonen tydelig, den anselige compliance placenta representerer (4). Godt hjulpet av fosterleveren og en høy diffusjonskapasitet tåler fosteret transfusjoner som overstiger 30 % av det totale blodvolum. Den raske diffusjonen av plasma ut fra det vaskulære rommet fører imidlertid til at blodvolumet bare øker med halvdelen av transfusjonsmengden (5).
Fosterets utvikling og vekst er avhengig av en god placentasirkulasjon, noe som til en viss grad avspeiles i dopplerregistreringer i umbilikalarterien. Med slike diagnostiske nyvinninger kan vi påvise alvorlig svikt i fosterets placentasirkulasjon. En redusert karseng, økt motstand og redusert compliance fører til økt pulsamplitude i umbilikalarterien og i verste fall til bortfall eller reversert diastolisk blodstrøm (6) (fig 1). Slike alvorlige endringer er forbundet med 36 % perinatal mortalitet (7). Tar man hensyn til doppler-undersøkelsen i den obstetriske vurderingen, fører det til lavere perinatal morbiditet (7).

Figur 1 Blodstrømshastigheten målt i umbilikalarterien hos to fostre i 27. svangerskapsuke. Det normale mønsteret har rikelig diastolisk blodstrøm (øverst). Alvorlig sirkulatorisk placentasvikt viser seg særlig ved bortfall eller reversert diastolisk blodstrøm, som er forbundet med 36 % perinatal mortalitet (nederst)
Svangerskapsvarigheten er viktig i denne sammenhengen, fordi den ikke bare avspeiler utvikling av fostervekst, men også grad av fysiologisk modenhet. Ved 20 uker er det arterielle blodtrykket 15 mm Hg (8), og endokrine og nevrale reguleringsmekanismer står ennå foran en vesentlig del av sin modning og tilpasning (9). Klinisk viser dette seg ved at svært premature fostre raskere får bradykardi og endret pumpefunksjon (målt med dopplerteknikk) ved hypoksemi enn fostre nær terminen. I siste trimester vil en mer raffinert omfordeling av blodstrømmen til prioriterte organer prege responsen (10). Slike prioriterte organer er binyrer, hjerne, hjerte og morkake.
Navleveneblodet, som flyter fra placenta tilbake til fosteret, har vanligvis p O 2 20 – 75 mm Hg, lavest ved terminen (11). Typisk er oksygenmetningen 85 %, men selv oksygenmetning på 50 – 55 % er vanligvis ikke forbundet med acidose (12). Det skyldes i stor grad at fostervevene har evnen til å ekstrahere de nødvendige 30 % selv ved meget lav p O 2 . Slik sikres fosteret mot akutt hypoksisk skade og gir det tid til en metabolsk tilpasning dersom de endrede betingelsene blir permanente.
Oksygen – ikke oksygen, via sinistra og dextra
De gamle anatomer og fysiologer lærte oss om via dextra, som transporterer blod med lav oksygenmetning til morkaken (2). Vena cava inferior og superior (og koronarsinus) fører det oksygenfattige blodet gjennom høyre atrium, høyre ventrikkel og gjennom truncus pulmonalis forbi lungekretsløpet til ductus arteriosus og aorta descendens, og dermed til arteria umbilicalis (fig 2) (13).

Figur 2 Den sentrale fostersirkulasjonen med via sinistra (rødt) og via dextra (blått) hos mennesket. Via sinistra fører oksygenrikt blod fra umbilikalvenen (UV) gjennom ductus venosus (DV) og venstre del av leveren, venstre del av øvre vena cava inferior (VCI), foramen ovale (FO), venstre forkammer (VA), venstre ventrikkel (VV) og aorta (AO). Via dextra leder lavt oksygenert blod fra VCI og vena cava superior (VCS) gjennom høyre forkammer (HA), høyre ventrikkel (HV), pulmonalarterien (PA) og ductus arteriosus (DA) til aorta like nedenfor isthmus aortae. FOK, foramen ovale-klaffen; PV, pulmonalvene; P, portvenen. Gjengitt med tillatelse etter Kiserud og medarbeidere (13)
En tilsvarende via sinistra ble beskrevet for oksygenmettet blod fra morkaken: navlevene, ductus venosus, vena cava inferior, foramen ovale, venstre atrium, venstre ventrikkel til aorta, hvor de to viae møtes nedenfor isthmus aortae (fig 2). Oksygenmetningen i den oppadstigende aorta hos dyr er 10 – 12 % høyere enn i pulmonalarterien og tilgodeser dermed hjertet og hjernen med høyere oksygenkonsentrasjon enn kroppen ellers (14). Fordelingsmønsteret hos mennesket kjenner vi ikke ennå.
Ductus venosus
Denne lille ”portokavale” shunten, som leder oksygenert blod forbi leveren direkte til hjertet, har tidligere vært vanskelig å studere, men er i dag tilgjengelig for ultralyddiagnostikk og er på vei til å bli en viktig del av den hemodynamiske utredningen av syke fostre (15). Eksperimentelle studier har tidligere vist at ca. 50 % av navleveneblodet løper denne veien (16, 17). Nyere studier hos mennesket under fysiologiske forhold viser at det er kun 20 – 30 % av navleveneblodet som normalt shuntes gjennom ductus venosus (13, 18) (tab 1). Den føtale leveren er dermed høyere prioritert (70 – 80 % av navleveneblodet) enn det vi har vært vant til å tenke oss.
|
Tabell 1 Shunting gjennom den føtale ductus venosus i en normalpopulasjon angitt i prosent av blodstrømmen i navlevenen (13)
|
|
|
|
|
Svangerskapsuke
|
Median (%)
|
(10-; 90-percentil)
|
|
18 – 19
|
28
|
(14; 65)
|
|
20 – 24
|
25
|
(10; 44)
|
|
25 – 28
|
22
|
(10; 44)
|
|
29 – 32
|
19
|
(9; 46)
|
|
33 – 36
|
20
|
(10; 31)
|
|
37 – 41
|
23
|
(7; 38)
|
Fordelingen hviler på en følsom balanse mellom karmotstanden i leveren og ductus venosus. Et redusert navlevenetrykk (normalt trykk er 4 – 8 mm Hg) (19) eller økt viskositet (hematokrit) reduserer blodstrømmen gjennom leveren mer enn i ductus venosus og gir derfor relativt mer shunting (20). Slike mekanismer trer i kraft f.eks. ved fosterblødninger, tvilling-tvilling-transfusjonssyndrom og placentasykdom.
I tillegg kommer en aktiv regulering av diameteren i ductus venosus. Prostaglandinmekanismer sørger for at ductus venosus holdes åpen (på samme måte som i ductus arteriosus), men i motsetning til i ductus arteriosus synes ikke oksygen å spille noen rolle ved postnatal lukking (21 – 23). Som i andre kar formidler nitrogenoksid (NO) distensjon også i ductus venosus (24). Det interessante er at hypoksemi utløser en betydelig ductus venosus-distensjon (24) og øker dermed den direkte overføring av navleveneblod til hjertet.
Det oksygenrike navleveneblodet som strømmer gjennom ductus venosus, styres mot foramen ovale. Dette er vist eksperimentelt på dyr (16, 25) og mennesker (26, 27), men kan i dag enkelt studeres i svangerskapet ved hjelp av ultralyd (28, 29). En viktig del av denne mekanismen er akselerasjonen i ductus venosus som gir blodet en tilstrekkelig høy kinetisk energi til å nå foramen ovale, åpne klaffen og fylle venstre forkammer (fig 3). Siden den høye hastigheten i ductus venosus er drevet av den umbilikokavale (dvs. portokavale) trykkgradienten, vil dopplermålinger i ductus venosus avspeile endringer i dette trykket ved hypoksemi, leversykdommer, anemi og en rekke kardiovaskulære fostersykdommer helt ned til 12. svangerskapsuke (30 – 37).

Figur 3 Sagittalt snitt viser hvordan blodstrømmen fra ductus venosus (DV) når venstre atrium (VA) uten først å gå gjennom høyre atrium (HA). Oksygenrikt blod (rødt) fra umbilikalvenen (UV) akselereres i DV og rettes steilt bakover mot foramen ovale og VA. Den høye kinetiske energien er med på å skyve til side foramen ovale-klaffen (FOK) og fylle trakten dannet av FOK og atrieseptum som en spinnaker. Lavt oksygenert blod (blått) fra vena cava inferior (VCI) rettes forover mot HA. AO, aorta; HV, hepatisk vene; P, portvenen; PA, pulmonalarterien
Alvorlig placentasvikt med hemming av fostervekst tvinger fosteret til å prioritere mer blod gjennom ductus venosus (38). En samtidig endring i perifer motstand og oksygenkonsentrasjon i hjertemuskelen avspeiles også i en økt pulsasjon i ductus venosus-blodstrømmen (fig 4). Ved fremskreden hjertesvikt forplanter pulsasjonen seg videre nedover til navlevenen (30, 32) og utgjør et prognostisk alvorlig tegn (39). Ductus venosus med sin uanselige størrelse viser seg dermed å bli av anselig klinisk betydning, også i de få ukene den er åpen i nyfødtperioden (40). Det er vist at denne shunten holder seg åpen lenger hos premature barn (41), og at en økt pulsatilitet, ofte med reversert hastighet i atriekontraksjonsfasen, kan indikere neonatal persisterende pulmonal hypertensjon (42).
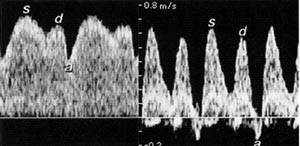
Figur 4 Normal blodstrøm i ductus venosus (til venstre) har høy hastighet og gjenspeiler systolen (s), passiv diastolisk fylning (d) og atriekontraksjonen (a) i hjertesyklus. Tilsvarende måling ved alvorlig placentasvikt (til høyre) røper sviktende hjertefunksjon med reversert blodstrøm pga. en forsert atriekontraksjon (a). Lave hastigheter mellom s og d tyder på hypoksisk myokard og redusert compliance. Begge målinger er gjort i 27. svangerskapsuke
Foramen ovale
Shunter mellom venstre og høyre hjertehalvdel er velkjente problemer i barne- og voksenkardiologien. Tanken om en horisontal retning på blodstrømmen gjennom det føtale foramen ovale er derfor nærliggende, noe som gjenspeiles i feilaktige skisser i mange lærebøker og atlas. Imidlertid stiger blodet i vena cava inferior nesten vertikalt og treffer atrieseptum (crista dividens, senere kalt limbus av foramen ovale), som deler strømmen i en venstre og en høyre gren (26, 43). Dermed går blodet direkte fra vena cava inferior til venstre atrium, uten først å gå innom høyre atrium (fig 3). Mekanismen blir effektiv fordi atrieseptum er plassert mer mot høyre i fosterlivet enn postnatalt (43). Dermed dreies foramen ovale-ostiet ned mot vena cava inferior og tar imot blod først og fremst fra ductus venosus og venstre levervene direkte. Preferansen beror også på at blodstrømmen fra disse karene er rettet mot en venstresidig utvidelse av vena cava inferior, like under foramen ovale (29), og at denne blodstrømmen har høyere kinetisk energi (15).
Men siden venstre forkammer også får blod fra pulmonalvenene, vil den føtale lungeblodstrømmen påvirke foramen ovales funksjon og utvikling i fosterlivet. Det er vist at normale humane fostre har en større blodstrøm gjennom lungene (13 – 25 % av det kombinerte hjerteminuttvolum) (44, 45) enn det dyreeksperimenter har vist, 8 – 12 % (1, 10), og dermed tilsvarende mindre foramen ovale-shunting, som når et lavmål ved 30 ukers svangerskap (tab 2) (44). Denne utviklingen sammenfaller med endokrine modningsprosesser. Det er håp om at den pågående forskningen i denne delen av den føtale sirkulasjonen vil øke vår evne til å bedømme lungemodning og forutsi perinatale problemer med lungesirkulasjonen.
|
Tabell 2 Blodstrøm gjennom fosterlungene, foramen ovale og ductus arteriosus angitt i prosent (middelverdi) av det kombinerte hjerteminuttvolum (44)
|
|
Prosent av kombinert hjerteminuttvolum
|
|
Svangerskapsuke
|
Fosterlunger
|
Foramen ovale
|
Ductus arteriosus
|
|
20
|
13
|
34
|
40
|
|
30
|
25
|
18
|
32
|
|
38
|
21
|
19
|
39
|
Ductus arteriosus – isthmus aortae
Ductus arteriosus leder i stor grad lavere oksygenert blod fra høyre ventrikkel forbi lungekretsløpet til nedadstigende aorta. Hos mennesket går 20 – 35 % av det kombinerte minuttvolumet gjennom ductus arteriosus (44, 45) (tab 2), mens det er 57 % hos sauefostre (1).
I USA har prostaglandinhemmere, som indometacin, vært i utstrakt bruk som rihemmer. Det har lært oss at slike stoffer kan indusere en betydelig konstriksjon i ductus arteriosus, spesielt etter 32. svangerskapsuke (46, 47).
Sonesson, i samarbeid med Fourons gruppe, rettet oppmerksomheten mot relasjonen mellom ductus arteriosus og isthmus aortae (48, 49). De viste at isthmus aortae fungerer som et vannskille. Ved økende karmotstand i aorta eller umbilikalsirkulasjonen og samtidig vasodilatasjon i hjernen reduseres blodstrømmen over isthmus aortae, først og frems i diastolen (fig 5). Ved ytterligere forverring blir blodstrømmen reversert i diastolen. Under ekstreme forhold løper blod fra ductus arteriosus opp gjennom isthmus til arcus aortae gjennom hele hjertesyklus, et mønster som også sees ved obstruktive tilstander i venstre hjertehalvdel. Ved slike hjertefeil er påvisningen av reversert blodstrøm gjennom isthmus med fargedoppler og målinger med pulset doppler blitt et viktig diagnostisk hjelpemiddel. Karavsnittet representerer også interessante nye muligheter for diagnostikk ved placentasvikt.

Figur 5 Det meste av blodet i fosterets pulmonalarterie (PA) ledes gjennom ductus arteriosus (DA) til nedadstigende aorta, som i tillegg får blod gjennom isthmus aortae (IAO) (a). IAO representerer et vannskille mellom arcus aortae og DA. Økning av perifer motstand leder til redusert eller opphevet diastolisk blodstrøm i IAO (b). Ved ytterligere økning av motstanden reverseres diastolisk blodstrøm i IAO (c), og i ekstreme tilfeller etterfylles arcus både fra DA og nedadstigende aorta (d). Obstruktive tilstander som rammer venstre hjertehalvdel kompenseres gjerne av retrograd fylling av arcus aortae gjennom hele hjertesyklus. AO, aorta; CCA, carotis communis
Alt i alt har de siste års utvikling med forfinet ultralydteknologi vist at fostersirkulasjonen er et tilpasningsdyktig system med vide variasjonsmuligheter. Teknologiens utvikling har løftet fagfeltet fra det dyreksperimentelle stadiet til studier av menneskets egen fostersirkulasjon og har satt fart i utviklingen av en differensiert diagnostikk – en diagnostikk særlig fostre med redusert vekst, hjertelidelser, anemi og hydrops, leverlidelser eller tvilling-tvilling-transfusjonssyndrom vil dra nytte av.