En tverrfaglig ekspertgruppe nedsatt av Senter for medisinsk metodevurdering (SMM) har nylig utarbeidet en rapport om status og fremtidige muligheter for genterapi innen klinisk medisin (1). Denne artikkelen er den første i en temaserie om genterapi, som alle tar utgangspunkt i denne rapporten. Rapporten er en ”tidlig identifikasjon og vurdering av nye metoder” og beskriver status for somatisk genterapi basert på systematisk kartlegging av kliniske protokoller og publiserte resultater. I tillegg identifiseres viktige utviklingstrender innen preklinisk forskning. På bakgrunn av den fremkomne dokumentasjonen vurderes fremtidig klinisk anvendelse av genterapi, og sykdomsgrupper hvor denne type intervensjon er mest aktuelt identifiseres. I tillegg presenteres ekspertgruppens anbefalinger og vurderinger vedrørende nasjonal oppbygging av genterapi, norsk lovgivning, samt sikkerhet og etikk. Senter for medisinsk metodevurdering har en overordnede målsetting om å gi en riktig oppsummering av tilgjengelig kunnskap om medisinske metoder og presiserer at anbefalingene står for ekspertgruppens regning, men anmoder mottakerapparatet til å vurdere anbefalingene. Artikkelen gir videre en kort oversikt over medisinsk metodevurdering som fremgangsmåte for systematisk å innhente og kritisk vurdere tilgjengelig vitenskapelig dokumentasjon om nye medisinske metoder.
Medisinsk metodevurdering
Medisinsk metodevurdering innebærer en vurdering av effekter, bivirkninger, omkostninger og andre virkninger av prosedyrer som benyttes eller er foreslått benyttet i helsevesenet for å forebygge, diagnostisere og/eller behandle sykdom. Det viktigste i en metodevurdering er en systematisk og kritisk gjennomgang av den foreliggende vitenskapelige dokumentasjon. For å minimalisere alle former for systematiske feil (bias) i vurderingen er det utviklet en fremgangsmåte der dokumentasjonen vurderes etter på forhånd bestemte kvalitetskriterier. En slik vurdering av tilgjengelig dokumentasjon kalles ofte synteseforskning eller sekundærforskning.
Medisinsk metodevurdering setter søkelys på effekter av tiltak, men tar i tillegg hensyn til økonomiske, etiske, organisatoriske og juridiske forhold som påvirker beslutninger i helsevesenet. På denne måten vurderes den vitenskapelige dokumentasjonen ut fra hvert lands rammebetingelser. Hensikten er å gi best mulig faglig grunnlag for beslutningstakerne på alle nivåer i helsevesenet.
Identifikasjon og vurdering av nye metoder
Nye medisinske metoder presenteres stadig i dagens samfunn. Det offentlige helsevesen har følgelig et behov for å skille nye, kostnadseffektive metoder, som kan representere store fremskritt for individ så vel som samfunn, fra de ineffektive. I tillegg er det behov for tidlig identifikasjon av nye metoder med stort potensial, men som krever store/nye ressurser for videre utvikling.
Vurdering av behandlingseffekt krever resultater fra kontrollerte, helst randomiserte kliniske studier. Overgangen fra eksperimentell til etablert behandling representerer således det best egnede tidspunktet for systematisk metodevurdering av en medisinsk prosedyre. Tidlig identifikasjon og vurdering av nye metoder vil imidlertid ofte omfatte behandlingsstrategier der det ennå ikke foreligger publiserte, konklusive randomiserte kontrollerte studier, eller hvor det kliniske dokumentasjonsgrunnlaget domineres av kliniske studier i tidlig fase. Denne kategorien kliniske studier representerer utprøvende (eksperimentell) behandling og skiller seg fra behandling som allerede er introdusert/etablert i helsevesenet. Slike ”tidlige” vurderinger har også en metodologisk tilnærming, men egne kvalitetskriterier. Vurderingene har til hensikt å spre kunnskap om metoden, spesielt i form av rådgivning overfor helsemyndigheter.
Bakgrunn og mandat
Den første pasienten ble behandlet med genterapi i en offentlig godkjent protokoll for om lag ti år siden (2), men teknisk og biologisk kompliserte metoder gjør at genterapi fremdeles ansees som fremtidig medisinsk behandling. Store forhåpninger, men også betydelig uvisshet, er knyttet til klinisk anvendelse av genterapi. Internasjonalt eksisterer det i dag ingen konsensus om hvilken rolle genterapi kan få for fremtidig behandling av sykdommer. I flere oversiktsartikler, rapporter og bøker har man forsøkt å oppsummere fagfeltet (3–6). Publikasjonene gir god bakgrunnsinformasjon, men ingen har benyttet en eksplisitt og systematisk måte for å trekke sammen tilgjengelig kunnskap på. Senter for medisinsk metodevurdering fant det derfor viktig å utrede kunnskapsgrunnlaget for denne terapiformen gjennom systematisk innhenting og kritisk vurdering av klinisk dokumentasjon, for deretter å vurdere dokumentasjonen i forhold til norsk helsevesen og medisinsk forskning. Den tverrfaglig ekspertgruppen fikk følgende mandat:
-
– Ekspertgruppen skal kartlegge og beskrive status for avsluttede og pågående kliniske protokoller innen genterapi
-
– Ekspertgruppen skal, med utgangspunkt i ovennevnte, vurdere muligheter for klinisk anvendelse av genterapi og hvilke sykdomsgrupper som er mest aktuelle
-
– Ekspertgruppen skal diskutere genterapi i forhold til konsekvenser for norsk helsevesen
-
– For bedre å kunne forutsi fremtidige muligheter for genterapi innen klinisk medisin skal ekspertgruppen identifisere viktige utviklingstrender ved også å inkludere prekliniske forskningsdata i vurderingen
Genterapi – en følge av den biomedisinske revolusjon
De siste tiårene har vært preget av store fremskritt i vår forståelse av hvordan celler fungerer på molekylært nivå. Denne kunnskapseksplosjonen innen molekylær cellebiologi, som ofte betegnes ”den biomedisinske revolusjon”, begynner nå å bære frukter. Praktisk anvendelse av molekylær medisin vil kunne omfatte prosedyrer/strategier innen behandling, diagnostikk og forebygging. Molekylærbiologiske prinsipper benyttes i dag i stort omfang innen klinisk diagnostikk. Flere behandlingsformer som baseres på molekylærbiologisk viten og teknikk er under forskning og utvikling, hvorav genterapi er én mulighet. Fremtidens medisin antas å dreie søkelyset fra individrettet behandling til forebygging av sykdommer hos risikogrupper.
DNA er den kjemiske substansen i kromosomer, som utgjør arvematerialet/arvestoffet. Et gen er et arveanlegg, dvs. en del av DNA som koder for et protein. Det er trolig mellom 50 000 og 100 000 humane gener. Humant genom-prosjektet (HGP), et verdensomspennende prosjekt med offentlig finansiering, og et privat selskap (Celera Genomics) har begge arbeidet med å sekvensere og kartlegge det menneskelige arvematerialet (genomet). I en felles meddelelse kunne begge parter i juni år 2000 kunngjøre at det første målet var nådd og at et foreløpig utkast til DNA-sekvensen for det humane genom var utarbeidet (7, 8). En fullstendig ferdigstilt sekvens vil ventelig foreligge i løpet av 2003. Ferdigstillelse av sekvensen for det humane genom betyr at et stort og viktig grunnarbeid er utført. Mye forskning gjenstår imidlertid før man kjenner alle gener, forstår deres funksjon og hvordan genene uttrykkes og samspiller. Identifikasjon av sykdomsrelaterte gener krever i tillegg kunnskap om variasjon mellom individer, særlig innenfor familier som er rammet av spesielle sykdommer. Den ferdige genomsekvensen definerer således mer ”slutten på begynnelsen” enn ”begynnelse på slutten” i utvikling av genterapi som etablert behandlingsform.
Definisjoner
DNA finnes i cellekjernen som en del av kromosomene (DNA i mitokondriene står i en særstilling og omtales ikke her). Moderne molekylærbiologi har gjort det mulig å identifisere, formere og renfremstille gener eller biter av gener ved hjelp av gensløyd, der man benytter enzymer som kutter og limer DNA. DNA passerer ineffektivt gjennom cellemembranen. For å overføre genetisk materiale til celler (gentransfeksjon) kan man benytte ulike metoder. I genterapisammenheng er den vanligste metoden å benytte en transportvogn (vektor) for å få DNA inn i cellene. Oftest benyttes en viral vektor. Virus har utviklet egenskaper for å bindes til celler, tas inn i cellene og der frigjøre sitt genetiske materiale. I genterapisammenheng benyttes modifiserte, defekte virus som ikke kan dele seg, men som har beholdt evnen til å invadere celler (fig 1). Ulike andre vektorer kan også benyttes, og i spesielle tilfeller ”nakent” DNA. En mer utførlig omtale gis i en egen artikkel i temaserien om genterapi.
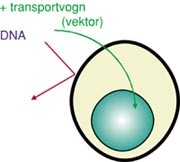
Figur 1 Genoverføring til celler. For at genetisk materiale (DNA) skal overføres til celler, må det passere cellemembranen og transporteres inn til cellekjernen. Nukleinsyrer (DNA, RNA) passerer ineffektivt gjennom intakt cellemembran. For å øke effektiviteten av genoverføring til celler benyttes ofte vektorer (transportvogner). Slike vektorer kan f.eks. være fettpartikler (liposomer) eller modifiserte virus. Virale vektorer er defekte virus som har bevart evnen til å infisere bestemte celler og å transportere arvemateriale til kjernen, men som ikke har bevart evnen til å formere seg selv. En del av bivirkningene knyttet til genterapi skyldes immunologiske effekter forårsaket av virale vektorer
Konseptet genterapi har utviklet seg fra bare å omhandle behandling av monogene, arvelige sykdommer gjennom tilførsel av et nytt, uskadet gen til å omfatte all nukleinsyrebasert behandling. Definisjonen av genterapi har således endret seg over tid, og i dag finnes det ingen god helhetlig definisjon av begrepet.
Ekspertgruppen nedsatt av Senter for medisinsk metodevurdering valgte å definere genterapi som ”overføring av DNA/RNA til målceller i behandlingsøyemed” og inkluderte således all nukleinsyrebasert behandling. Gruppen innskrenket definisjonen til bare å gjelde genterapi på kroppsceller (somatisk genterapi) for behandling av alvorlig sykdom. Genetisk endring etter genoverføring ved somatisk genterapi føres ikke videre til neste generasjon og skiller seg klart etisk og lovmessig fra kimbanebasert genterapi, hvor genoverføringen skjer til kjønnsceller eller befruktede eggceller. Både terapeutiske og forebyggende strategier kan i bred forstand omfattes av definisjonen genterapi, men ekspertgruppen inkluderte bare behandlingsforsøk. Gruppens definisjon av genterapi inkluderte antisense- og ribozymmolekyler samt terapeutiske DNA-vaksiner (injeksjon av gener/genfragmenter der hensikten er å fremkalle en immunrespons rettet mot tilført genmateriale), men ekskluderte markørstudier (studier der celler merkes ved genmodifisering uten at terapeutisk effekt oppnås), ”smarte virus” (onkolytiske virus konstruert for kun å infisere og drepe kreftceller) og profylaktiske DNA-vaksiner. Celleterapi og transplantasjoner er bare definert som genterapi dersom cellene eller vevet er genmodifisert før det gis til pasientene. Metoder bygd på kjernetransplantasjon gir muligheter for korreksjon av genfeil, men tilhører ikke begrepet genterapi.
Den valgte definisjon er i overensstemmelse med Helsetilsynets definisjon og med de fleste internasjonale konvensjoner, bortsett fra at mange land inkluderer genmarkørstudier i genterapibegrepet. I de fleste tilfeller forutsetter genterapi at det aktuelle genet er identifisert og sekvensert, og at genets funksjon og regulering er kjent. Gode genterapeutiske strategier kan imidlertid først utarbeides når sykdommens patofysiologi er kjent.
Status
Den systematiske kartleggingen av alle tilgjengelige protokoller verden over identifiserte forsøksprotokoller fra totalt 401 avsluttede og pågående genterapiforsøk. Av disse representerer kun tre protokoller fase III-studier (fig 2). Det kliniske dokumentasjonsgrunnlaget er således dominert av studier i fase I og II. Mellom 3 000 og 4 000 pasienter er blitt behandlet med genterapi. Kartleggingen av protokollene viser at klart de fleste genterapistudiene er utført i USA, men at det de siste årene også har vært en betydelig oppbygging av genterapi i Europa. Til nå er to kliniske genterapistudier godkjent i Norge. Begge utføres ved Det Norske Radiumhospital, som ledd i internasjonale multisenterstudier. Den ene studien benytter antisense-oligonukleotider mot proteinkinase C-alfa ved melanom og lungekreft, mens i den andre overføres tumorsuppressor-genet TP53 i en adenoviral vektor til bukhulen ved ovarialkreft. Per i dag har seks pasienter i Norge gjennomgått genterapi ved Det Norske Radiumhospital.
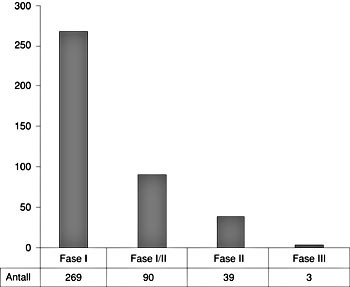
Figur 2 Totalt 401 avsluttede og pågående kliniske studier innen genterapi ble identifisert ved systematisk kartlegging av tilgjengelige protokoller verden over. Figuren viser fordelingen av studier med hensyn til klinisk fase (fase I, I/II, II og III)
De identifiserte protokollene er fordelt mellom fem hovedkategorier av sykdomsgrupper (fig 3). Protokoller på kreft er klart dominerende, men det finnes også en del protokoller på monogene sykdommer og på infeksjonssykdommer, deretter følger hjerte- og karsykdom og til slutt samlegruppen ”andre”, som så langt inkluderer enkelte autoimmune og nevrologiske sykdommer. Genterapi prøves således ut både ved sykdommer der det foreligger feil i arvematerialet, slik som monogene sykdommer, som skyldes endringer i ett enkelt gen, og ved sykdommer der endringer i flere gener kan være involvert i sykdomsutviklingen, slik som blant annet kreft. I tillegg testes genterapi ut ved ikke-arvelige sykdommer, eksempelvis ved alvorlige infeksjoner, slik som HIV-infeksjon. Felles for de eksisterende studiene er at de alle gjøres på pasienter med alvorlig sykdom hvor tilfredsstillende alternativ behandling ikke finnes.
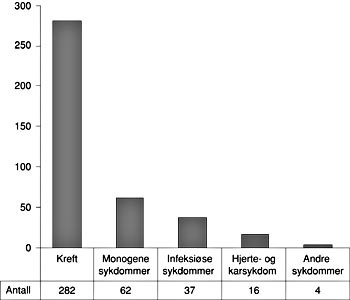
Figur 3 De identifiserte genterapiprotokollene (401 stykker) kan grupperes i fem hovedkategorier av sykdomsgrupper. Figuren viser fordelingen av kliniske studier med hensyn til disse sykdomsgruppene
Den systematiske kartleggingen av resultater av genterapiforsøk viste at det bare for 80 av de identifiserte protokollene (20 %) foreligger publiserte resultater. Det lave antall rapporterte resultater kan skyldes manglende publisering eller det faktum at flere godkjente, registrerte protokoller aldri er blitt iverksatt. Forsinkelser på grunn av pågående patentering kan også være en forklaring. Fordelingen mellom de ulike sykdomsgrupper viser igjen at kreft dominerer protokoller der resultatene er publisert (fig 4). Langt de fleste protokoller innen monogene sykdommer omhandler cystisk fibrose og adenosindeaminasemangel. Protokollene innen infeksjonssykdommer er alle på behandling av HIV-infeksjon. Den ene protokollen i grupperingen ”andre” omhandler terapi av den nevrologiske sykdommen amyotrofisk lateral sklerose. Det er ennå ikke publisert resultater fra fase III-studier.
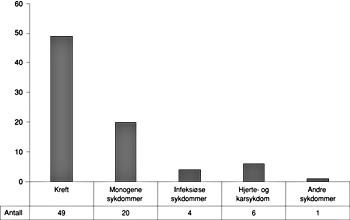
Figur 4 Det foreligger publiserte resultater for 80 av de 401 identifiserte protokollene. Figuren viser fordelingen av publiserte resultater fra kliniske studier med hensyn til sykdomsgruppe
Et enkelt litteratursøk i Medline på søkeordet ”gene therapy” identifiserer flere tusen genterapirelaterte artikler (fig 5). Det beskjedne antall artikler som representerer publiserte resultater fra kliniske genterapistudier indikerer at hovedtyngden av forskningen skjer på prekliniske problemstillinger.
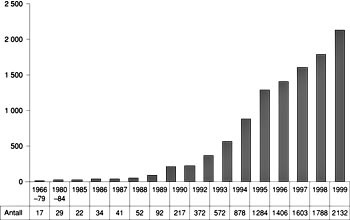
Figur 5 Et litteratursøk i Medline på søkeordet ”gene therapy” illustrerer at genterapi er et stort satsingsområde innen medisinsk forskning. Figuren viser antall treff (artikler per år) som benytter begrepet genterapi i tittel, sammendrag og/eller som indekseringsord. Blant flere tusen genterapirelaterte artikler er det imidlertid et beskjedent antall artikler (80 stykker) som representerer publiserte resultater
Resultater fra de kliniske studiene i tidlig fase har vist en begrenset klinisk effekt, og ennå er ingen pasient blitt helbredet ved genterapi. Eneste indikasjon hvor genterapi er et tilbud er øyeinfeksjon med cytomegalovirus hos pasienter med AIDS. Behandlingen består av løselige antisense-oligonukleotider mot cytomegalovirus og likner mye på konvensjonell legemiddelbehandling. Lovende resultater er observert i tidlige kliniske forsøk ved kreft og nylig også ved visse former for hjerte- og karsykdommer og alvorlig medfødt immunsvikt. Ved kreft baserer de mest lovende strategiene seg på tilførsel av normalt TP53 (tumorsuppressorgen, mutert i om lag 50 % av alle krefttyper) og på immungenterapi (eksponering av immunceller med gener slik at immunapparatet stimuleres til å ta knekken på muterte kreftceller), hvor resultater viser delvis og i sjeldne tilfeller komplett tilbakegang av kreftsvulster (9 – 14). For sykdommer i det kardiovaskulære system er det behandling av sekundære fortetninger (restenose) som synes mest lovende, men i tillegg er det rapportert flere andre gode prekliniske resultater for sykdomsgruppen (15 – 17). Nylig er det også publisert lovende resultater ved en form for arvelig alvorlig immunsvikt, der et normalt gen er overført til hematopoetiske stamceller og de genmodifiserte cellene ble gitt tilbake til pasientene. To av fem barn som ble behandlet, har fått delvis normaliserte blodverdier og har kunnet klare seg utenfor sykehus uten annen behandling i mange måneder (18).
Selv om genterapi har vært utprøvd lengst for sykdomsgruppen monogene sykdommer, gjenstår det å vise sikker klinisk effekt av slik behandling ved andre monogene sykdommer, slik som cystisk fibrose. Ved adenosindeaminasemangel er genmodifiserte målceller påvist i flere år etter behandling, men behandlingen erstatter ikke tilførsel av konvensjonelt enzym. Ved HIV-infeksjon foreligger det heller ingen entydige kliniske behandlingsresultater. Innen samlegruppen ”andre sykdomsgrupper” viser resultater fra amyotrofisk lateral sklerose-protokollen heller ingen klinisk effekt på sykdomsprogredieringen. En vurdering av prekliniske forskningsdata for å identifisere viktige utviklingstrender viser at for flere nevrologiske og autoimmune sykdommer, slik som Parkinsons sykdom, Alzheimers sykdom, Crohns sykdom og ulcerøs kolitt, er klinisk utprøvning nær forestående. Utførlig statusrapport for de ulike sykdomsgruppene presenteres i de påfølgende artiklene i temaserien om genterapi.
I de publisert resultatene som foreligger fra de ulike kliniske studiene er forbausende få, oftest lokale, bivirkninger rapportert, og genterapi var lenge ansett for å være en relativt sikker metode. Et dødsfall som kunne settes direkte i forbindelse med selve genterapibehandlingen ble imidlertid nylig rapportert. Men her ble inklusjonskriteriene for protokollen brutt på flere punkter, og den avdøde pasienten burde ikke ha deltatt i utprøvningen (19). Dødsfallet har ført til en ny gjennomgang av alle offentlig godkjente genterapiforsøk. Denne revisjonen viste en klar underrapportering av til dels alvorlige bivirkninger og har medført at kravene til sikkerhet og rapportering ved utprøvende genterapi vil bli skjerpet.
Nasjonal oppbygging av genterapikompetanse
Med unntak av cytomegalovirus antisense-terapi er genterapi ikke etablert behandling for sykdom i dag. Resultater fra fase III-studier foreligger ennå ikke i publisert form. Det vil ventelig gå minimum tre år før man får svar fra uavhengige fase III-studier innen samme sykdomskategori. Dette medfører at genterapi trolig fortsatt vil være klinisk forskning i den nærmeste 3 – 5-årsperioden. Dette vil si at ingen pasienter i Norge i dag bør tilbys behandling med genterapi utenom kliniske forsøksprotokoller (med unntak av cytomegalovirus antisense-terapi). Utprøvningen av genterapi er imidlertid kommet så langt at det synes viktig at Norge deltar i systematisk utprøvning av enkelte genterapeutiske strategier, samtidig som man bygger opp bedre kompetanse for å ta i bruk og utvikle genterapi som et fremtidig behandlingsprinsipp.
Genterapirelatert forskning (molekylærbiologisk og preklinisk forskning) foregår i dag ved regionsykehusene, Rikshospitalet og ved Det Norske Radiumhospital. Ekspertgruppen mener det nå er viktig å satse nasjonalt for en oppbygging av genterapikompetanse. I et femårsperspektiv foreslås det to satsingsområder. For det første anbefales det en oppbygging av infrastruktur ved utvalgte miljøer. For det andre anbefales det et nasjonalt program for kompetanseoppbygging innen genterapi som bør omfatte både preklinisk og klinisk forskning. Genterapi er et høyteknologifag som krever tverrfaglig kompetanse og spesielle fasiliteter for prekliniske eksperimenter, håndtering av vektorer og behandling av pasienter. Fordi genterapi er ressurskrevende, vil det være fornuftig å bygge opp et lite antall sentre som innehar tilstrekkelig kompetanse til å kunne utvikle fagfeltet. Valg av miljøer for infrastrukturoppbygging bør prinsipielt baseres på faglig kompetanse fremfor sykdomsgrupper. Ut fra dagens dokumentasjonsgrunnlag vil det spesielt være viktig å bygge opp kompetanse innen kreft, men også hjerte- og karsykdommer peker seg ut som et viktig satsingsområde. I tillegg bør et nasjonalt nettverk innen genterapi, som bidrar til informasjonsflyt mellom kompetansesentrene, bygges opp.
Når genterapi eventuelt blir etablert behandling, vil det være nødvendig med en regional løsning der genterapi bør kunne tilbys på alle regionsykehus samt Rikshospitalet og Det Norske Radiumhospital. Et overordnet nasjonalt program for kompetanseoppbygging innen genterapi bør kvalitetsvurdere aktivitetene og fordele midler etter søknad. Det er ønskelig at Norge i fremtiden også bidrar med egenutvikling innen genterapi i tillegg til at utenlandsk kompetanse implementeres. Ekspertgruppen anser det derfor som viktig at både klinisk og grunnleggende forskning støttes i et nasjonalt program. I tillegg vil en styrking av overgangen mellom basalforskning og klinikk (translasjonsforskning) motvirke unødig press for å ta i bruk genterapeutiske strategier på sviktende effektgrunnlag. Det foreslås at Sosial- og helsedepartementet oppretter en faglig styringsgruppe som kan være rådgivende i bruk av midler, eventuelt etter vurdering fra en internasjonal faggruppe.
Juridiske vurderinger
Ekspertgruppen har følgende anbefalinger for norsk lovregulering av genterapiutprøvning:
– Saksgangen i forbindelse med godkjenning av genterapistudier bør bli enklere og raskere enn i dag, samtidig som samfunnets behov for kontroll og etiske vurderinger må ivaretas. Det bør være tilstrekkelig med godkjenning av laboratorier samt vanlig prosedyre, som ved annen klinisk utprøvning (skal godkjennes av protokollutvalg, regional etisk komite… samt Statens legemiddelkontroll). Det anbefales at Statens legemiddelkontroll suppleres med et eget rådgivningsorgan på dette fagfeltet for å ivareta samfunnets spesielle behov for kontroll og innsyn.
– De ulike prosedyrene innefor genterapi bør reguleres med ulike sikkerhetskrav. Spesielt bør behandling med ribozymer/antisense-molekyler i løselig form, som mest minner om konvensjonell legemiddelbehandling, ha enklere sikkerhetskrav enn øvrig genterapi. Det foreslås også at ”smarte virus”, som formelt ikke hører inn under genterapibegrepet, bør reguleres som genterapi, ikke minst pga. faren for spredning av replikasjonskompetente virus. Likeledes bør genmarkørstudier omfattes av samme regelverk.
Etiske vurderinger
Ekspertgruppen har vurdert etiske sider ved somatisk genterapi og konkluderer som følger:
-
– Somatisk genterapi er etisk forsvarlig og representerer forskningsetisk sett ikke noe nytt prinsipp, med unntak av at det er en teoretisk, om enn meget liten, risiko for overføring til kimbaneceller.
-
– Genterapi bør foreløpig reserveres for behandling av alvorlig sykdom.
-
– Barn og voksne må i prinsippet betraktes som likestilte. Genterapi vil i enkelte tilfeller være mest aktuelt hos barn og genterapeutisk utprøvning på barn bør tillates dersom studiene kvalitetsmessig holder mål.
-
– Det bør ikke tillates genterapi på fostre før mer kunnskap foreligger, ikke minst på grunn av små anatomiske forhold og risiko for utilsiktet genoverføring til umodne stamceller eller kimbaneceller i fostret.
-
– Kimbanebasert genterapi og genetiske forsøk på kimbanenivå er forbudt, og det er bred internasjonal enighet om at dette fortsatt ikke bør tillates.
-
– Kvalitetsforbedring ved genmanipulasjon er etisk uakseptabelt.
-
– Det er viktig med en kontinuerlig etisk diskusjon om nye genterapiprotokoller.
-
– Forskning på de etiske sidene av genterapi bør også støttes.
-
– Det er nødvendig med en kontinuerlig og informert offentlig debatt om etiske spørsmål og om de formelle lover og godkjenningsordninger som regulerer genterapeutisk aktivitet.
-
– Etikk er nær knyttet opp til sikkerhets- og bivirkningsaspektet, som fortsatt krever nøye vurdering og overvåking.
Konklusjon
Nåværende status for genterapi kan oppsummeres ved at fagfeltet bærer preg av rask preklinisk utvikling og omfattende klinisk forskning i tidlig fase. Sykdomsgrupper med lovende strategier inkluderer kreft, visse former for kardiovaskulær sykdom samt enkelte former for alvorlig medfødt immunsvikt. For alle sykdomsgrupper har forskningen bidratt med verdifull innsikt i patogenese og danner grunnlag for videre utvikling av genterapeutiske strategier. Det antas at genterapi vil finne sin plass i behandlingen ved flere sykdommer i fremtiden, enten som alternativ, som supplement eller i kombinasjon med annen behandling. Genterapi antas å ha et stort potensial fordi behandlingen gir mulighet for kurasjon etter én behandlingsrunde (”onetime cure”) ved visse sykdommer og for målrettet medisin tilpasset enkeltindividet (”designer drugs”). I tillegg åpner genterapi muligheter for behandling av pasienter som til nå ikke har noen tilfredsstillende tilbud.
Den tverrfaglige ekspertgruppen nedsatt av Senter for medisinsk metodevurdering konkluderer med at utprøvningen av genterapi har kommet så langt at det nå er viktig å satse nasjonalt for en oppbygging av genterapikompetanse. Viktige elementer i gruppens anbefalinger, sett i et femårsperspektiv, er infrastrukturoppbygging ved utvalgte miljøer og et overordnet nasjonalt program som både inkluderer preklinisk og klinisk forskning.
Tverrfaglig ekspertgruppe ved Senter for medisinsk metodevurdering har bestått av følgende medlemmer: professor Erlend B. Smeland (faglig leder), dr.scient, cand.pharm. Anita Lyngstadaas (prosjektkoordinator), professor Hans Prydz, overlege Karen Helene Ørstavik, professor Stig Frøland, avdelingsoverlege Steinar Aamdal, professor Ola Myklebost, professor Jaran Apold, professor Anne-Lise Børresen-Dale, professor Erling Seeberg, forsker Eivind Hovig, professor Hans Krokan, professor Jan Helge Solbakk.