Transmisjonselektronmikroskopisk undersøkelse har, ved siden av bred anvendelse innen biomedisinsk forskning, i en årrekke vært benyttet som en supplerende metode innen patologisk-anatomisk diagnostikk. I Norge mottas årlig ca. 2 000 prøver til slik undersøkelse, og det er seksjoner for elektronmikroskopi tilknyttet avdeling for patologi ved alle regionsykehusene og ved Det Norske Radiumhospital.
Denne artikkelen tar sikte på å belyse den praktiske anvendelsen av transmisjonselektronmikroskopisk undersøkelse som diagnostisk hjelpemiddel.
Aktuelle indikasjoner
Elektronmikroskopisk undersøkelse av nyrebiopsier
Nyrebiopsi er indisert bl.a. ved tilfeller av akutt eller kronisk nyresvikt og ved nefrotisk syndrom (1). Elektronmikroskopisk undersøkelse har lenge vært et nødvendig addendum til den lysmikroskopiske og immunpatologiske undersøkelse (2, 3). I biopsier fra den transplanterte nyre er ultrastrukturell undersøkelse av vesentlig verdi ved problemstillingen kronisk rejeksjon versus glomerulonefritt eller annen glomerulopati (3, 4).
Den høye oppløsningen i elektronmikroskopet gir en langt større detaljskarphet enn det andre metoder kan tilby. Forekomst av elektrontette nedslag, som tilsvarer immunkomplekser påvist ved immunpatologisk undersøkelse, kan derfor påvises og lokaliseres med større presisjon (fig 1). Avflatning eller ”fusjon” av epitelcellenes fotprosesser i glomeruli er et korrelat til klinisk påvist proteinuri ev. nefrotisk syndrom, og kan kun påvises ultrastrukturelt. Diagnosen ”minimal change”-nefropati kan således ikke entydig stilles uten elektronmikroskopisk undersøkelse. For påvisning av amyloidavleiring er ultrastrukturell undersøkelse en verdifull supplerende teknikk og har en høyere sensitivitet (forutsatt representativ prøve) enn klassiske histopatologiske farger. Fortykkelse av lamina densa i den glomerulære basalmembran er et karakteristisk tidlig tegn på diabetisk nefropati. Dertil kommer flere tilstander som er definert helt ut eller hovedsakelig ultrastrukturelt, slik som type II-membranoproliferativ (mesangiokapillær) glomerulonefritt, immunotaktoid/fibrillær glomerulopati, tynne glomerulære basalmembraner, basalmembranforandringer ved Alports syndrom og myelinlegemer ved Fabrys sykdom (3).
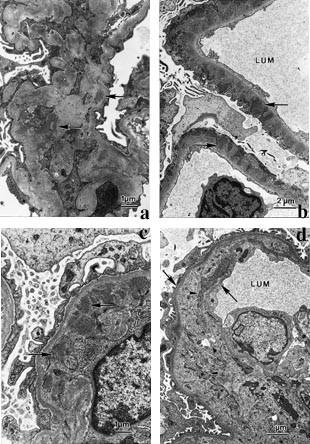
Figur 1 Biopsier fra transplanterte nyrer. a) Residiv av IgA-nefritt; biopsi tre år etter transplantasjon. 49 år gammel mann. Opprinnelig forstørrelse ⋅ 6 000. Piler: elektrontette nedslag i mesangiet (immunfluorescensundersøkelse viste nedslag av IgA). b) ”De novo”-immunkompleksglomerulonefritt; biopsi seks år etter transplantasjon. 47 år gammel mann, grunnlidelse kronisk pyelonefritt. Opprinnelig forstørrelse ⋅ 4 000. Piler: elektrontette nedslag i glomerulære basalmembraner, subepitelialt. LUM: Kapillærlumen. c) ”De novo”-immunkompleksglomerulonefritt (membranoproliferativ type); biopsi ni år etter transplantasjon. 40 år gammel kvinne, 2. gangs nyretransplantert. Påvist hepatitt C som sannsynlig årsak til nefritt. Piler: elektrontette nedslag subendotelialt/paramesangialt. Opprinnelig forstørrelse ⋅ 10 000 (andre områder viste forandringer typisk for kronisk glomerulær rejeksjon). d) Kronisk transplantatglomerulopati (kronisk glomerulær rejeksjon); biopsi 16 år etter transplantasjon. 28 år gammel kvinne, grunnlidelse mesangioproliferativ glomerulonefritt. Sterkt fortykket kapillærvegg med duplikasjon av lamina densa (piler) og interposisjon av utløpere fra mesangiale celler (pilspisser) gir karakteristisk lysmikroskopisk ”dobbelkonturering av basalmembraner”. Merk fravær av elektrontette nedslag. LUM: Kapillærlumen. Opprinnelig forstørrelse ⋅ 4 000
Kombinasjoner av ulike glomerulære sykdommer kan være svært vanskelig å påvise uten elektronmikroskopisk undersøkelse. Ikke sjelden er de lysmikroskopiske og immunpatologiske funn vanskelig tolkbare eller tvetydige, og den ultrastrukturelle undersøkelsen kan i slike tilfeller være avgjørende for den endelige diagnosen.
I den transplanterte nyre kan kroniske forandringer i glomeruli som følge av kronisk rejeksjon (kronisk transplantatglomerulopati) være vanskelig å skille fra andre glomerulære forandringer, særlig residiverende eller ”de novo”-glomerulonefritt. Disse tilstander kan også forekomme kombinert, og elektronmikroskopisk undersøkelse er etter vår erfaring og andres (4) uvurderlig for denne type vurderinger (fig 1).
Begrensningen i ultrastrukturell undersøkelse av nyrebiopsi er i første rekke mengden av vev som kan undersøkes. Fokale forandringer vil følgelig kunne oversees. Man har derfor stor nytte av ”trippeldiagnostikken”, som kombinerer elektronmikroskopisk undersøkelse med lysmikroskopisk og immunhistokjemisk teknikk. Den vanlige svarrutine er at vi først avgir et preliminært svar basert på lysmikroskopisk og immunpatologisk undersøkelse. Den preliminære vurdering suppleres så av den ultrastrukturelle undersøkelse. I spesielle tilfeller vil denne kunne gjøres innen en uke fra biopsidato, men i praksis vil svartiden som regel være minimum 2 – 3 uker. Denne kombinasjonen av teknikker tillater også en målrettet søking etter relevante ultrastrukturelle forandringer.
Elektronmikroskopisk diagnostikk ved nevromuskulære sykdommer
Innen diagnostikk av flere primære muskelsykdommer har elektronmikroskopisk undersøkelse vist seg å være avgjørende for den endelige diagnosen. Spesielt gjelder dette gruppene kongenitte og metabolske myopatier. Elektronmikroskopisk undersøkelse er også aktuelt som tilleggsmetode ved undersøkelse av hjertemuskulatur. Rutinemessig undersøkelse av myokardbiopsier er vanlig ved mistanke om kardiomyopati, som ledd i utredningen med henblikk på hjertetransplantasjon.
Kongenitte myopatier er en fellesbetegnelse på en rekke muskelsykdommer som angriper alle kroppens muskler (5). Denne gruppen må skilles fra de tradisjonelle muskeldystrofiene som også er arvelige. De kongenitte myopatiene varierer mye i både sykdomsdebut og forløp, alt etter hvilken undergruppe det er tale om. Noen av undergruppene viser seg tydelig fra fødselen av eller i tidlig spedbarnsalder, mens andre først viser seg klinisk i tenårene eller i voksen alder. Ut fra dette er det ofte tale om muskelsykdommer med et godartet forløp. Kongenitt myopati er, i motsetning til de fleste andre muskelsykdommene, beskrevet som ikke-progredierende. Det er en sjelden sykdomsgruppe med kun 2 – 3 nye tilfeller i året i Norge. Ved denne gruppen muskelsykdommer er det normale enzymverdier i blodprøver. Først og fremst sees normale verdier av kreatinkinase, noe som er tegn på at muskelvevet ikke er dramatisk skadet av sykdommen. Elektromyografisk undersøkelse er enten normal eller viser uspesifikke forandringer. I svært mange tilfeller er det de elektronmikroskopiske forandringene i muskelvevet som gir den endelige diagnosen. Også navnene på de ulike typene av kongenitte myopatier er ofte gitt etter de elektronmikroskopiske funn. De fem vanligste typene er (5):
– ”Central core”-sykdom
– Nemalinlegememyopati
– Disproposjon av fibertype
– Centronukleær myopati/myotubulær myopati
– Myopati med tubulære aggregater
Som det fremgår av navnene, henspiller alle disse betegnelsene på spesifikke forandringer i muskelvevet.
Både ”central core”-myopati og nemalinlegememyopati ble oppdaget i begynnelsen av 1960-årene, mye på grunn av de karakteristiske og spesifikke ultrastrukturelle forandringene i muskelvevet, henholdsvis med sentrale oppklaringer i muskelcellene eller opphopning av krystaller eller trådliknende legemer i muskelcellene (fig 2a).
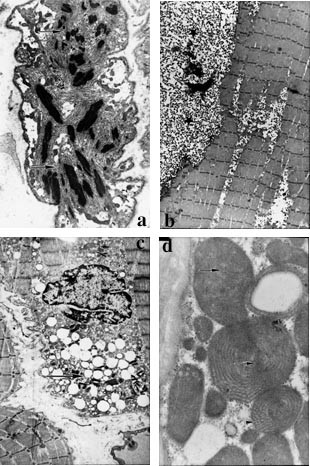
Figur 2 Biopsier fra skjelettmuskulatur. a) Nemalinlegememyopati. Elektronmikroskopisk bilde av muskelcelle med ansamlinger av elektrontette krystalliknende legemer (piler) i muskelcellen. Opprinnelig forstørrelse ⋅ 5 000. b) Glykogenose. Lengdesnitt av muskel med ansamlinger av glykogengranula. Disse ligger som sjøer subsarkolemmalt i muskelcellene (stjerner). Opprinnelig forstørrelse ⋅ 6 000. c) Lipidavleiring i muskel. Økt mengde elektronlyse vakuoler i muskelcellene (pil). Dette gir mistanke om defekt i lipidstoffskiftet. Opprinnelig forstørrelse ⋅ 6 000. d) Mitokondriesykdom. Økt mengde abnorme mitokondrier i muskelcellen. Det sees konsentriske cristae, elektronlyse områder i cristae (piler) og parakrystallinske legemer i mitokondriene nederst i bildet (pilspiss). Opprinnelig forstørrelse ⋅ 10 000.
Metabolske myopatier (avleiringssykdommer)
Ved ulike typer metabolske myopatier og avleiringssykdommer har også elektronmikroskopisk undersøkelse ofte vært svært avgjørende for den endelige diagnosen. De vanligste av disse sykdommene er (6 – 8):
I tillegg finnes flere sjeldne metabolske sykdommer som gir mer eller mindre spesifikke ultrastrukturelle forandringer i muskelvevet. Glykogenosene gir ultrastrukturelle funn som viser opphopning av fingranulert materiale i muskelvevet i form av glykogengranula (fig 2b). Det finnes minst 14 typer kjente glykogenoser, som alle har sitt spesifikke kliniske bilde og fører til mer eller mindre glykogenopphopning også i andre organer. Det samme gjelder ved defekter i lipidmetabolismen, hvor man finner opphopning av fettvakuoler i muskelvevet (fig 2c).
Ved mistanke om defekt i den mitokondrielle funksjon, ved primære eller sekundære mitokondrielle sykdommer, har elektronmikroskopisk undersøkelse av mitokondriene vist seg å være svært nyttig for den endelige diagnosen (8) (fig 2d).
Ved all elektronmikroskopisk undersøkelse av muskelvev er det helt nødvendig å sammenholde de lysmikroskopiske forandringene med immunhistokjemiske, enzymhistokjemiske og genteknologiske funn. Et godt tverrfaglig samarbeid mellom klinikere, laboratorier samt genetikere er en forutsetning for en korrekt endelig diagnose.
Tumorpatologi
Tradisjonelt har elektronmikroskopisk undersøkelse hatt en viktig plass i utredning av neoplasier. Enkelte subcellulære organeller og strukturer er karakteristisk for ulike celletyper, og kjennskap til ultrastruktur av tumorceller og deres innbyrdes forbindelser har vært av avgjørende betydning for morfologisk klassifikasjon av ulike svulsttyper (9). Således kan påvisning av desmosomer være av betydning for å kunne skille mellom karsinomer og maligne lymfomer. Karakteristiske elektrontette granula er typisk for nevroendokrine svulster, og funn av melanosomer kan være avgjørende for diagnosen malignt melanom. Særlig har elektronmikroskopisk undersøkelse vært en viktig metode i utredning av lavt differensierte maligne svulster, så som småcellede og spolcellede tumorer.
Optimal preservasjon av vevet er viktig også ved ultrastrukturell undersøkelse av tumor (se nedenfor). Det er likevel mulig i visse tilfeller å oppnå tilfredsstillende resultat ved undersøkelse av vev primært innstøpt i parafinblokk (10) dersom restmateriale fra tumor ikke er tilgjengelig.
Utviklingen i de senere år har likevel medført at immunhistokjemiske metoder i økende grad har overtatt elektronmikroskopets plass i tumordiagnostikken. Immunhistokjemisk undersøkelse kan nå i stor utstrekning anvendes også på rutinebehandlet vevsmateriale (formalinfiksert og parafininnstøpt vev), og man kan undersøke mye større deler av tumor enn det som er praktisk mulig ved den elektronmikroskopiske undersøkelse. Automatiserte systemer for immunhistokjemisk farging er tatt i bruk ved de fleste patologilaboratorier, hvilket innebærer en ytterligere rasjonalisering på personellsiden.
Den praktiske betydning av den elektronmikroskopiske undersøkelse i tumordiagnostikken er derfor mange steder mindre enn før. Metoden kan imidlertid stadig være aktuell ved spesielle problemstillinger, og særlig ved vanskelig klassifiserbare svulster når andre metoder gir usikre eller tvetydige resultater. I hvilken utstrekning elektronmikroskopisk undersøkelse anvendes vil også være avhengig av faktorer som prøvetall og kompetanse ved det aktuelle laboratorium (11).
Andre indikasjoner for elektronmikroskopisk undersøkelse
Elektronmikroskopisk undersøkelse kan i tillegg anvendes på en rekke ulike indikasjoner. Eksempelvis kan det påvises strukturelle defekter i epitelcellenes cilier i respirasjonstractus ved primær ciliær dyskinesi (12). I spesielle tilfeller av infeksjonssykdommer kan elektronmikroskopisk undersøkelse være en supplerende metode for identifikasjon av den aktuelle mikrobe (13, 14).
Mer generelt har elektronmikroskopisk undersøkelse en plass i utredningen av metabolske sykdommer, inklusive avleiringstilstander (se også avsnittet om skjelettmuskulatur). Ikke minst innen pediatrisk medisin kan dette være en aktuell problemstilling. Ved leverbiopsier hos barn bør man vurdere å ta av materiale til ultrastrukturell undersøkelse. Har man sikret seg adekvat fiksert materiale, kan den videre utredning avgjøre om elektronmikroskopisk undersøkelse er nødvendig. I tillegg til biopsier kan iblant også undersøkelse av autopsimateriale gi en diagnose basert på ultrastrukturell morfologi (15). Oftere vil elektronmikroskopisk undersøkelse i slik ”syndromutredning” være bare en av mange mulige metoder, og kan være mindre avgjørende enn biokjemiske eller genteknologiske analyser for kartlegging av den aktuelle stoffskiftedefekt. I slike tilfeller er det avgjørende at kliniker og patolog er orientert om hvilke typer forandringer som er beskrevet ved de aktuelle tilstander, og at undersøkelsen utføres målrettet i henhold til dette (type forandringer, hvilke organer affisert).
Øvrige ultrastrukturelle metoder
Blant andre ultrastrukturelle teknikker skal nevnes immun-elektronmikroskopi. Selv om denne metoden prinsipielt kan brukes diagnostisk for eksempel ved undersøkelse av nyrebiopsier (16, 17) eller endokrine svulster (18), vil den de fleste steder først og fremst være et forskningsredskap (19). Immunelektronmikroskopisk undersøkelse er en unik metode når det dreier seg om nøyaktig intracellulær lokalisering av ulike biokjemiske prosesser, for eksempel om bestemte typer reaksjoner finner sted knyttet til spesielle intracellulære organeller eller er lokalisert i cellens cytosol (20).
Avsluttende kommentar
Transmisjonselektronmikroskopisk undersøkelse er for lengst etablert som et nødvendig addendum til den øvrige patologisk-anatomiske diagnostikk, og vi antar den vil fortsette å være det også i fremtiden. Vi finner imidlertid grunn til å understreke at dette er en metodikk som kun bør brukes på spesielle indikasjoner. Den diagnostiske nytteverdi er begrenset til noen relativt få definerte områder. Arbeidet med hver enkelt prøve er kostbart og ressurskrevende, ikke minst på personellsiden. Diagnostikken er også personavhengig i den forstand at det kreves betydelig erfaring med metoden og med den aktuelle problemstilling. Dersom man overveier å rekvirere elektronmikroskopisk undersøkelse av en vevsprøve, er det en god regel at man på forhånd tar direkte kontakt med det aktuelle laboratorium. Særlig gjelder dette før man sender prøve med en uvanlig problemstilling. Det kan være at det diagnostiske problem lettere kan utredes med andre metoder, eller at lysmikroskopisk og immunpatologisk undersøkelse er tilstrekkelig og overflødiggjør elektronmikroskopisk undersøkelse.
De ultrastrukturelle funn kan ofte ikke stå alene, men må sammenholdes med, og integreres i, den lysmikroskopiske/immunpatologiske evaluering. Ikke sjelden vil resultatet av den elektronmikroskopiske undersøkelse derfor bli diskutert mellom de involverte patologer i avdelingen. Dette er også en grunn til at vi vektlegger direkte kommunikasjon med den kliniker som rekvirerer undersøkelsen. Laboratoriet bistår gjerne også med informasjon om fiksering og prøveforsendelse, og vil som regel kunne forsyne rekvirenten med adekvat fikseringsvæske.
Addendum
Bakgrunn. Ved elektronmikroskopi benyttes elektroner i stedet for synlig lys for å avbilde objektet. Elektronstrømmens bølgelengde er mye mindre enn den som karakteriserer synlig lys (ved de spenninger som genereres i elektronmikroskopet i størrelsesorden 1/100 000 av denne). Da et mikroskops oppløsningsevne er tilnærmet omvendt proporsjonal med bølgelengden i strålingen fra lyskilden, kan man ved hjelp av elektronmikroskopet oppnå en langt større oppløsning enn i lysmikroskopet.
Elektronstråler kan avbøyes i elektromagnetiske felter. Etter at de første elektronlinser ble konstruert, omkring 1930, ble det første elektronmikroskopet bygd i løpet av 1930-årene i Tyskland (21).
Oppbyggingen av elektronmikroskopet er skjematisk angitt i figur 3. De negativt ladede elektronene avgis ved oppvarming av en elektronkilde, oftest et wolframfilament, og akselereres mot en positivt ladet anodeplate. Elektronstrålen fortsetter deretter nedover i lumen av en metallsøyle som kontinuerlig evakueres for luft for å opprettholde høygradig vakuum. Strålen passerer en serie med elektromagnetiske linser, hvorav den første er kondensorlinsen, som sørger for at preparatet bestråles. Fordi elektroner bremses eller avbøyes når strålen når molekylært tette deler av preparatet, dannes en avbildning av preparatet, som i sin tur fokuseres og forstørres ved passasjen gjennom de påfølgende sett av linser. Elektronstrålen når til slutt en fluorescerende skjerm, hvor lyspartikler, fotoner, emitteres slik at man får en visuell fremstilling av preparatet. Ved å vippe opp den fluorescerende skjermen oppnår man at elektronstrålen treffer en fotografisk plate. På denne fremkommer et negativt bilde av objektet, en positiv kopi fremstilles deretter på vanlig fotografisk papir (22, 23). Det er nå tilgjengelig systemer for digital fotografering og lagring av elektronmikroskopiske bilder, som forventes å bli en standardmetode i fremtiden.
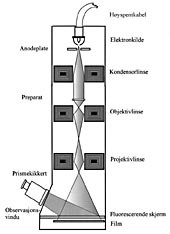
Figur 3 Elektronmikroskopets oppbygning, skjematisk (Tegning: Aileen Murdoch Larsen)
Preparering av vev. For at en vevsbestanddel skal kunne undersøkes i elektronmikroskopet, må den forbehandles slik at den kan skjæres i ultratynne snitt samtidig som vevets morfologi er tilfredsstillende bevart. Det første trinn i denne prosessen er fikseringen av vevet. Et velegnet primærfiksativ er glutaraldehyd i 2 % løsning i natrium cacodylatbuffer med pH 7,3 – 7,4. Glutaraldehyd reagerer svært raskt med proteiner og stabiliserer strukturmolekyler ved hjelp av kryssbindinger. Penetrasjonshastigheten er på den annen side mindre enn f.eks. for formalin, hvilket innebærer at vevsbitene må være meget små, dvs. ideelt ikke mer enn 1 – 4 mm 3 . Nålebiopsier er meget velegnede. Noen benytter et fikseringsmiddel bestående av 4 % formaldehyd og 1 % glutaraldehyd (McDowells væske).
Da glutaraldehyd ikke i tilstrekkelig grad stabiliserer umettet fett eller fosfolipider, anvendes i tillegg osmiumtetroksid som et sekundært fiksativ. Dette fikserer lipidene og reduserer dermed risikoen for senere ekstraksjon av disse vevskomponentene. I tillegg gir osmiumtetroksid en høy grad av kontrast til enkelte, såkalte osmiofile strukturer i cellen eller vevet (24).
Som innstøpningsmedium anvendes oftest en epoksyresin, som muliggjør skjæring av ultratynne snitt. Før innstøpningen gjennomgår vevet dehydrering ved hjelp av etanol eller aceton i stigende konsentrasjoner. Deretter infiltreres vevet med aceton tilblandet økende konsentrasjoner av innstøpningsmediet frem til et siste infiltrasjonstrinn i ren epoksyresin. Etter tilsetting av herder polymeriseres epoksyresinet over natten ved 60 ˚C i en herdingsovn. Semitynne snitt (ca. 1 µ m) skjæres med en glasskniv på en spesiell type mikrotom, en såkalt pyramitom. Disse snittene farges med toluidinblått (kalles ofte blåsnitt) og studeres i et lysmikroskop for at man skal kunne identifisere de områder som er best egnet for videre skjæring av ultratynne snitt. Disse skjæres ved hjelp av en såkalt ultrotom og er 60 – 100 nanometer tykke. Snittene plukkes opp på et tynt kobbernett (engelsk ”grid”), som har en diameter tilpasset elektronmikroskopets preparatholder (25, 26).
Kontrastdanning i vevet er en forutsetning for at elektronstrålene skal kunne gi en avbildning av vevsstrukturene. Denne kontrasten fremkommer ved at ulike komponenter i vevet har ulik evne til spredning/absorpsjon av elektronstrålen. Spredningen skyldes en gjensidig påvirkning mellom elektronstrålen og atomkjernene og/eller elektronene i preparatets atomer. Biologiske prøver består hovedsakelig av atomer med lav masse, slik som karbon, nitrogen, oksygen og hydrogen, og har relativt dårlig spredningsevne. For å øke spredningen og dermed kontrasten må vevet tilføres salter av tungmetaller som osmium, uran og bly. Cellemembraner tar f.eks. opp osmium, og fremstilles ved høy kontrastvirkning som sorte, veldefinerte strukturer på de fotografiske bildene (24).
Anvendt forstørrelse ved den elektronmikroskopiske undersøkelse vil være avhengig av den aktuelle problemstilling. Selv om den maksimale forstørrelse eller oppløsningsevne er betydelig høyere for de mest avanserte elektronmikroskoper, vil et vanlig arbeidsområde ved den patologisk-anatomiske diagnostikk være fra 2 000 til 4 000 ganger og opp til 40 000 – 50 000 ganger. Til sammenlikning gir lysmikroskopet opp til 400 – 600 ganger forstørrelse med ”tørrlinser” og 1 000 ganger ved bruk av immersjonsolje.