Melatonin er en interessant substans, som siden oppdagelsen i 1958 har vært gjenstand for en rekke mindre studier på svært varierende indikasjoner. Disse studiene er i hovedsak gjort i perioden fra 1980 og frem til i dag. I de senere år er det også blitt publisert en rekke oversiktsartikler om melatonin og dets potensielle egenskaper i terapeutisk bruk. Denne artikkelen oppsummerer hva som er studert og hvor godt dokumentert melatonin er som legemiddel.
ßMelatonin syntetiseres hos mennesker i corpus pineale og i retina. Estimert endogen melatoninproduksjon er 28 – 30 µg per døgn. Forløperen er den essensielle aminosyren L-tryptofan som omdannes via serotonin til N-acetylserotonin av det hastighetsbestemmende enzymet arylalkylamin N-acetyltransferase og videre til melatonin (1 – 3). Endogen melatoninproduksjon starter 9 – 12 uker etter fødselen, er på sitt høyeste fra 3 – 5 års alder og frem til voksen alder. Senere avtar produksjonen gradvis i alderdommen. Endogen produksjon hemmes kraftig av lys, og melatonin er derfor blitt beskrevet som ”a pulse of darkness” og ”the dark hormone” (4 – 6). Melatoninproduksjonen har en omtrentlig 24-timers syklus og styres av lysforholdene. Upåvirket av lys vil syklus være 24,2 – 25 timer (2, 7). Melatoninets effekter er motsatt av lysets effekter på døgnrytmen, og lysterapi omtrent 12 timer forskjøvet fra doseringstidspunkt for melatonin vil typisk gi samme effekt på denne.
Melatonin virker på egne reseptorer, ML1 og ML2 – med subtyper. Reseptorene finnes blant annet i hjernen og, spesielt viktig for døgnrytmereguleringen, på fremre del av hypothalamus (2). Melatoninreseptorer i blodkar bidrar til å senke kroppstemperaturen, noe som kan spille en rolle for døgnrytmen og føre til økt søvnbehov (4, 6). Melatoninreseptorer finnes også flere steder i det reproduktive system og i magesekken, men effekten her er ikke grundig studert (4). Den best studerte mekanismen er melatoninets regulatoriske effekt på døgnrytmen hos mennesker.
Melatonin er tidligere omtalt i en artikkel i Tidsskriftet (8).
Farmakodynamikk og -kinetikk
Ved oral administrering er absorpsjonen av melatonin rask, med maksimal plasmakonsentrasjon etter 30 minutter til to timer (1, 3). Biotilgjengeligheten fra oral administrasjon varierer fra 3 % til 76 %, og melatonin har en hepatisk førstepassasjemetabolisme på opp mot 60 %. Absorpsjonen er relativt upåvirket av samtidig inntak av mat (1). Halveringstiden er 30 – 60 minutter (1, 3 – 5, 9). Melatonin metaboliseres i lever til de inaktive metabolittene 6-sulfatoksymelatonin og 6-hydroksymelatoninglukuronid, som utskilles i urin (2 – 4).
Foreslått terapeutisk bruk
Melatonin har vært forsøkt ved søvnforstyrrelser (herunder forsinket og for tidlig søvnfasesyndrom, insomni, jet lag og skiftarbeid), depresjon, schizofreni, autoimmune sykdommer, som tilleggsterapi ved ulike kreftformer, migrene, clusterhodepine, øresus, som antikonsepsjonsmiddel og for å beskytte huden mot ultrafiolett stråling. Melatonin har også vært foreslått som antioksidant mot oksidativt stress i nervesystemet ved Alzheimers sykdom og Parkinsons sykdom og som ”foryngelseshormon” (3, 4, 10). De fleste av de foreslåtte bruksområdene bygger i hovedsak på spekulasjoner med svakt empirisk grunnlag. Best undersøkt er melatoninets effekter på ulike søvnforstyrrelser (3). Likevel er dokumentasjonen heller ikke her god nok til at melatonin kan anbefales ved insomni (11).
Melatonin er ikke patentert og selges som et kosttilskudd blant annet i USA. Det er dermed ikke spesielt økonomisk interessant for legemiddelprodusenter (3, 5), noe som har medført at de studier som er gjort med melatonin, ofte har hatt små populasjoner og varierende endepunkter. Dermed er det også ofte vanskelig å sammenlikne studiene og utlede klinisk viktige funn av resultatene (3). Den utbredte bruken i USA har ikke ført til vitenskaplige rapporter da dette er definert som et kosttilskudd av Food and Drug Administration (FDA), noe som ikke medfører dokumentasjonsplikt verken på effekt eller faktisk innhold i preparater.
Lewy og medarbeidere (12) har skissert et diagram som beskriver doseringstidspunktet for ønsket effekt i forhold til melatoninets effekt på faseforskyvning av søvnforstyrrelser (fig 1).Det er stor individuell variasjon i endogen melatoninproduksjon og døgnrytme (6). For å finne optimalt doseringstidspunkt bør den enkelte pasients melatoninsyklus bestemmes og kurven justeres etter denne (5, 6). Lysbehandling 12 timer forskjøvet er trolig minst like effektivt som melatoninbehandling (5).
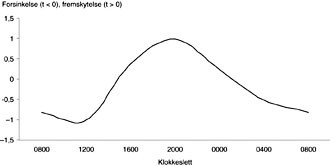
Figur 1 Omtrentlig faseforskyvning av melatonin for en gitt syklus. Hos denne personen vil melatonin dosert kl 20 gi en fremskutt døgnrytme på en time. Dosering kl 14 eller kl 2 ville ha liten eller ingen innflytelse på døgnrytmen, mens dosering kl 12 vil gi en forsinkelse av døgnrytmen på en time. Kurvens utseende vil variere fra person til person og må bestemmes individuelt
Melatonin er blant annet forsøkt med flere doseringsregimer ved jet lag, men konklusjonene varierer (3). Melatonin har best effekt på døgnrytmen ved en fasefremskytelse (6), og følgelig best effekt på reiser østover. I en randomisert dobbeltblind studie med 257 norske leger som reiste fra New York til Oslo og ble behandlet med henholdsvis 5 mg melatonin, 0,5 mg melatonin (i to ulike regimer) eller placebo, var det imidlertid ingen signifikant forskjell mellom noen av gruppene for noen av de jet lag-assosierte symptomene (13).
Dosering
Oralt inntak av doser på 0,1 mg – 2 g melatonin per døgn er rapportert (6), og så lave doser som 0,1 – 0,3 mg per døgn gir lik eller høyere serumkonsentrasjon enn endogen produksjon (3, 4). Typisk har lave doser (0,1 – 10 mg per døgn) vært forsøkt ved ulike søvnforstyrrelser (1, 3 – 5, 7, 10), og høye doser (10 – 50 mg per døgn) som tilleggsterapi ved ulike kreftformer (1, 3, 4). Enda høyere doser (300 mg/75 mg + 0,3 – 0,75 mg progestin per døgn) har vært benyttet til antikonsepsjon (4). Alle doseringer er en gang i døgnet, men doseringstidspunktet er vist å være svært viktig i forhold til ønsket effekt ved søvnforstyrrelser (fig 1). Kun de aller laveste doseringene gir fysiologiske serumkonsentrasjoner. Den store variasjonen i dosering viser at man ikke har noen kunnskap om hva som er optimal dosering ved de ulike foreslåtte indikasjonene.
Bivirkninger
Bruk av melatonin i de doser som er studert, har ikke resultert i rapporter om alvorlige bivirkninger eller toksisitet. Bivirkninger som er assosiert med melatonin er sedasjon, døsighet, tretthet, svimmelhet, forvirring, kvalme, hodepine, hypotermi, forverring av kollagenindusert artritt, hemming av ovulasjonen, magesmerter, endret søvnmønster, dysfori, kløe og irritabilitet (1 – 6). Melatoninets effekter på reproduksjonssystem og på pubertetsutvikling er ikke klarlagt, og det finnes ikke data om langtidseffekter. Depresjoner kan forverres av melatonin (1, 4, 5). Melatonin passerer over placenta og over i morsmelk. Eventuell teratogenitet er ikke undersøkt (1, 6, 9, 10).
Interaksjoner
Det er ikke gjort systematiske studier på melatoninets potensielle interaksjoner med legemidler, men det er blant annet notert at betablokkere reduserer melatoninsekresjonen. Antidepressiver som fluvoksamin, desipramin og monoaminoksidasehemmere øker melatoninproduksjonen (2, 4, 5). Ikke-steroide antiinflammatoriske legemidler, nalokson, kalsiumantagonister, benzodiazepiner, steroider, alkohol, tobakk og koffein kan redusere melatoninnivåene (3 – 5). Klorpromazin forsinker melatoninclearance (1). Den kliniske betydningen av disse interaksjonene er ukjent.
Konklusjon
Melatonin er en interessant substans for flere tilstander, men er per dags dato, etter 20 års studier, ikke godt nok dokumentert for noen indikasjon til at det kan anbefales som terapi. Det er heller ikke klarlagt hva som er optimal dosering, og verken langtidseffekter, bivirknings- eller interaksjonsprofil er undersøkt systematisk eller kvantitativt. Det er et stort behov for flere og større studier med henblikk på melatoninets effekter og dosering før midlet eventuelt kan anbefales som terapi for noen av de foreslåtte indikasjoner.
Spalten er redigert av Olav Spigset i samarbeid med Avdeling for legemidler ved Regionsykehuset i Trondheim og de øvrige klinisk farmakologiske miljøene i Norge