En skade i karveggen er den initiale stimulus som setter i gang tromboseprosessen. Sirkulerende blodplater rekrutteres til skadestedet ved at de adhererer til eksponerte glykoproteiner. Deretter vil ulike agonister, som trombin, kollagen, tromboksan A₂, serotonin, adrenalin og adenosindifosfat (ADP), bindes til spesifikke reseptorer på blodplatenes overflate og dermed initiere en aktiveringsprosess (1). En følge av dette er at nøkkelreseptoren på blodplatenes overflate, glykoprotein IIb/IIIa-reseptoren, som ellers er i hviletilstand, blir aktivert.
Selv om mange agonister kan aktivere blodplatene og de innledende prosessene er ulike, ender de alle med aktivering av glykoprotein IIb/IIIa-reseptoren. Denne finnes i rikelig mengde på blodplatenes overflate (40 000 – 80 000 per blodplate). Den aktiverte glykoprotein IIb/IIIa-reseptoren binder fibrinogen, men også von Willebrands faktor. Dermed kryssbindes blodplatene, og danning av en plateplugg er i gang (fig 1) (2). Virkningssted for glykoprotein IIb/IIIa-hemmere og andre hemmere av tromboseprosessen er skissert i figur 2.
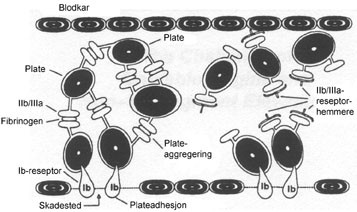
Figur 1 Interaksjon mellom blodplater og fibrinogen. Til venstre uten at glykoprotein IIb/IIIa-hemmer er til stede, til høyre med slik hemmer til stede. Ib: reseptor som adhererer blodplater til karvegg, IIb/IIIa: fibrinogenreseptor
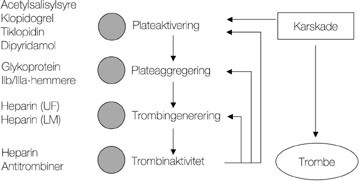
Figur 2 Virkning av medikamenter på tromboseprosessen (2). Fire ulike trinn kan påvirkes av medikamenter. UF: ufraksjonert; LM: lavmolekylært. Antitrombiner (hirudin og hirudinanaloger) er ikke registrert i Norge
Medikamenter
På det norske marked finnes tre medikamenter av typen glykoprotein IIb/IIIa-hemmere. De kan klassifiseres i to grupper: ikke-kompetitive (monoklonale antistoffer) og kompetitive (peptider og peptidetterlikninger).
Til den førstnevnte kategori hører abciximab (ReoPro), som var det første som ble utviklet. Dette er Fab-fragmentet av et kimærisk monoklonalt antistoff, det vil si et antistoff bestående av menneske- og museantistoff som er føyd sammen genteknologisk. Prinsippet bak dette medikamentet ble beskrevet i 1980-årene (3). Medikamentet binder seg fast til glykoprotein IIb/IIIa-reseptoren på blodplatene og får dermed lang virketid.
Det neste medikamentet som ble registrert i Norge, var tirofiban (Aggrastat), som er en peptidetterlikning (nonpeptid), mens det sist registrerte er peptidet eptifibatid (Integrilin). Disse medikamentene utøver sin platehemming ved at de konkurrerer med fibrinogen om gykoprotein IIb/IIIa-reseptoren. Mens abciximab har langvarig effekt, har de to øvrige medikamentene kortere virketid (tab 1) (4).
|
Tabell 1 Farmakologiske egenskaper ved glykoprotein Ilb-Illa-hemmere
|
|
Abciximab(ReoPro)
|
Tirofiban (Aggrastat)
|
Eptifibatid(Integrilin)
|
|
Farmakologi
|
Fab-fragment
|
Syntetisk nonpeptid
|
Syntetisk heptapetid
|
|
Halveringstid
|
30 min
|
2,5 t
|
2 t
|
|
Eliminasjon
|
Enzymatisk
|
Renal, enzymatisk
|
Renal
|
|
Dosering
|
Intravenøs bolus og infusjon i opptil12 timer
|
Intravenøs bolus og infusjon i opptil72 timer
|
Intravenøs bolus og infusjon i opptil72 timer
|
|
Dosejustering
|
Basert på vekt
|
Basert på vekt og nyrefunksjon
|
Basert på vekt og nyrefunksjon
|
|
Reseptoraffinitet
|
Høy
|
Moderat
|
Moderat
|
|
Varighet av effekt på blodplate
|
Opptil15 dager
|
4 – 6 t
|
4 – 8 t
|
|
Antigenisitet
|
Ja
|
Nei
|
Nei
|
|
Potensiell trombocytopeni
|
Ja
|
Ja
|
Ja
|
Glykoprotein IIb/IIIa-hemmere finnes bare til intravenøs bruk, og behandlingen er i praksis bare aktuell ved sykehus.
Kombinasjonsbehandling
Glykoprotein IIb/IIIa-hemmerne ble ikke introdusert for å erstatte andre medikamenter. De er aktuelle som tilleggsmedikasjon til annen etablert rutinebehandling, det vil i det vesentlige si i tillegg til acetylsalisylsyre og heparin. Acetylsalisylsyre er fortsatt et viktig basismedikament, men har begrensninger som manglende spesifisitet og relativt lav potens. Ut fra teoretiske betraktninger vil det kunne være aktuelt å kombinere acetylsalisylsyre og GP IIb/IIIa-hemmere ved tilstander hvor kraftig platehemming er ønskelig. Kliniske studier og klinisk praksis har vist at kombinasjonen fungerer og gir forsterket antitrombotisk effekt (2, 4)
Indikasjoner
Akutte koronarsyndromer
Ved akutte koronarsyndromer, definert som ustabil angina pectoris og hjerteinfarkt uten ST-heving i EKG, har kliniske studier vist at pasienter som gjennomgår koronar revaskularisering har nytte av behandlingen (2, 4). Dette har resultert i at disse medikamentene har fått en plass i behandlingsanbefalinger. I retningslinjene fra European Society of Cardiology er det anbefalt at den innledende behandling for akutte koronarsyndromer skal være acetylsalisylsyre, heparin og betablokkere (5). I den påfølgende observasjonsperioden over 8 – 12 timer skal man forsøke å identifisere høyrisikopasienter etter et nærmere beskrevet opplegg. Hos slike pasienter anbefales det å sette inn glykoprotein IIb/IIIa-hemmere, som må gis intravenøst, og så gå videre med utredning med henblikk på å gjennomføre invasive prosedyrer.
Tilleggsbehandling ved perkutan koronar intervensjon
Både ved perkutan koronar intervensjon i forbindelse med akutte koronarsyndromer og ved elektiv perkutan koronar intervensjon ved stabil angina pectoris er det i en del situasjoner aktuelt å sette inn en glykoprotein IIb/IIIa-hemmer i kombinasjon med heparin og acetylsalisylsyre, og i noen tilfeller også i tillegg til en kombinasjon av heparin, acetylsalisylsyre og en annen platehemmer, ADP-hemmeren klopidogrel (6, 7). Abciximab er den glykoprotein IIb/IIIa-hemmeren som er best dokumentert ved disse tilstandene.
Noen ganger, særlig ved akutte koronarsyndromer, kan den langvarige effekten være en ulempe, og det kan være hensiktsmessig å bruke en annen glykoprotein IIb/IIIa-hemmer. Behandlingen er aktuell i opptil et par døgn. Peroral behandling med klopidogrel eller tiklopidin brukes alltid etter innsetting av stent, vanligvis i 30 dager, og acetylsalisylsyre gis som permanent behandling.
Akutt hjerteinfarkt
Ved hjerteinfarkt med ST-elevasjon i EKG er rekanalisering av det okkluderte koronarkar det primære og umiddelbare mål. Med fibrinolytisk behandling kan det oppnås adekvat reperfusjon hos i beste fall 60 – 70 % av pasientene. Det har derfor vært et siktemål å forbedre den medikamentelle behandlingen slik at reperfusjon kan oppnås hos flere, og forhåpentligvis gi resultater som kunne nærme seg dem som er dokumentert for perkutan koronar intervensjon.
Det har vært knyttet forhåpninger til kombinasjon av et fibrinolytikum (i redusert dose) og glykoprotein IIb/IIIa-hemmere. De første studiene som hadde som mål å undersøke i hvilken grad reperfusjon ble oppnådd, var lovende (6). Resultatene fra de første kliniske studiene med harde endepunkter er blitt presentert (ennå ikke publisert), men disse har ikke gitt overbevisende støtte for kombinasjonsbehandlingen.
Potensielle komplikasjoner
Pasienter som behandles med glykoprotein IIb/IIIa-hemmere, må nøye overvåkes med henblikk på blødning, ikke minst fordi medikasjonen kommer i tillegg til heparin og acetylsalisylsyre og eventuelt en ADP-hemmer. Behandlingen kan representere en vanskelig balansegang.
For hvert av medikamentene som inngår i kombinasjonen, kreves et nøyaktig og veldefinert doseringsregime. Blødningsrisikoen har dog vært innen akseptable grenser i kliniske studier. Eksempelvis viste en metaanalyse av pasienter som hadde akutt koronarsyndrom, men som det ikke var planlagt tidlig invasiv behandling for, at 2,4 % av dem som ble behandlet med glykoprotein IIb/IIIa-hemmere fikk større blødninger, mens tilsvarende andel i placebogruppen var 1,4 % (8). Frekvensen av intrakranial blødning var ikke signifikant økt (0,9 % mot 0,6 %).
Alle medikamentene kan indusere trombocytopeni, men insidensen av denne bivirkningen er lav, og det har vært oppnådd full remisjon etter seponering.
Antistoffrespons har bare vært observert for abciximab, gjennomgående hos om lag 6 % av pasientene, men hypersensitivitet eller allergiske reaksjoner har sjelden vært sett etter bruk av medikamentet.
Problemstillinger i kommende år
Glykoprotein IIb/IIIa-hemmere har fått en viktig plass som medikasjon ved perkutan koronar intervensjon, et inngrep som i sterk grad aktiverer tromboseprosesser. I hvilken utstrekning de skal brukes ved akutte tilstander, inklusive hjerteinfarkt med ST-elevasjon i EKG, når perkutan koronar intervensjon ikke er aktuelt, er ennå ikke avklart. Den uavklarte situasjonen skyldes også det forhold at andre medikamenter er i ferd med å finne sin plass som effektive antitrombotika.
Lavmolekylært heparin er etter grundig testing i kliniske studier blitt tatt i bruk i mange rutineopplegg. Fordi glykoprotein IIb/IIIa-hemmere i det vesentlige har vært utprøvd sammen med ufraksjonert heparin, finnes det begrenset erfaring fra kliniske studier med kombinasjonen lavmolekylært heparin og glykoprotein IIb/IIIa-hemmere. Resultatene peker i retning av at dette er en lovende medikamentkombinasjon.
Platehemmere av type ADP-antagonister (klopidogrel, tiklopidin) har også vist seg å være effektive ved akutte koronarsyndromer og er blitt rutinebehandling ved perkutan koronar intervensjon hvor det settes inn stent. Kombinasjon av tre platehemmere (acetylsalisylsyre, glykoprotein IIb/IIIa-hemmer og ADP-hemmer) er teoretisk mulig, men effekt og sikkerhet for slike behandlingsregimer må avklares i kliniske studier før de kan være aktuelle for klinisk praksis. Ved denne type kombinasjon antas blødningsrisikoen å øke markant.
Glykoprotein IIb/IIIa-hemmere kunne potensielt være aktuelle ved perifer karsykdom og cerebrovaskulær sykdom, men så langt har de ikke vært utprøvd ved disse tilstandene.
Det har vært drevet utstrakt forskning for å utvikle glykoprotein IIb/IIIa-hemmere som kan administreres per os. Slike medikamenter vil kunne brukes over lengre tid og få videre indikasjoner enn den intravenøse medikasjon. Perorale medikamenter innen denne klassen har nådd frem til klinisk utprøvning, men det har vært vanskelig å oppnå stabil og riktig blodkonsentrasjon for slike medikamenter. Resultatene fra kliniske studier har vært skuffende. Introduksjon av perorale medikamenter i klinisk praksis synes derfor ikke å være nær forestående.
Spalten er redigert av Olav Spigset i samarbeid med Avdeling for legemidler ved St. Olavs Hospital og de øvrige klinisk farmakologiske miljøene i Norge
Se også kunnskapsprøve på www.tidsskriftet.no/quiz