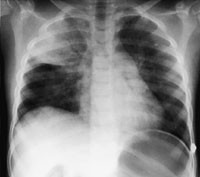
Figur 1 Bildet tatt to timer etter ekstubasjon med pasienten liggende på rygg viser en solid fortetning med tydelig luftbronkogram i høyre overlapp. Videre ser man diffuse fortetninger som kan tolkes som et interstitielt ødem
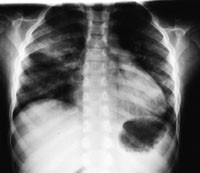
Figur 2 Bilde ni timer etter ekstubasjon viser oppklaring apikalt i begge overlapper, men med bestående svake diffuse fortetninger i de basale deler av lungene
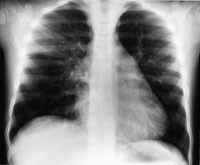
Figur 3 Bilde 48 timer etter ekstubasjon viser en normalisering av venstre lunge, men med bibeholdt volumreduksjon av høyre overlapp og dertil svarende høy lappespalte
Allerede i 1927 viste Moore (1) at hunder som ble påført økt luftveismotstand utviklet lungeødem under forsert inspirasjon. Selv om Oswalt og medarbeidere (2) i 1977 påberopte seg å være de første som beskrev lungeødem som komplikasjon til akutt luftveisobstruksjon, hadde allerede Capitano & Kirkpatrick i 1973 beskrevet røntgenfunn forenlig med lungeødem hos en hjertefrisk gutt som aspirerte en ferskenbit (3). De norske anestesiologene Smith-Erichsen og Bø publiserte i 1979 en eksperimentell studie med isolerte kaninlunger hvor de viste hvordan det negative intrapleurale trykk ved luftveiskollaps blir transformert direkte til det interstitielle rom i lungene, og videre hvordan dette negative intrapleurale trykket genererer (interstitielt) lungeødem (4). Lungeødemet utvikles altså ved forsert inspirasjon og i størst grad like etter at luftveisblokaden slippes.
Larynxspasmer og luftveisødem er de hyppigste årsaker til luftveisobstruksjon etter ekstubasjon. Spasmene oppstår akutt i eksitasjonsfasen av oppvåkningen. Luftveisødem oppstår imidlertid med et fritt intervall etter ekstubasjon på inntil tre timer og er en følge av den mekaniske traumatisering som den endotrakeale tube utøver på slimhinnen.
En rekke tilstander som for kortere eller lengre tid har gitt pasienten subklinisk lumenreduksjon av luftveiene eller lett luftveisobstruksjon i forkant av anestesi, kan gi betydelig obstruksjon eller luftveisblokade når pasienten er frarøvet sine bekyttelsesmekanismer for frie luftveier, noe som skjer under anestesi. Dette kan være laryngitt, laryngotrakeobronkitt, epiglotitt, adenoide vegetasjoner, tonsillhypertrofi, mikrognati, struma og andre tumorer, paralyse av n. recurrens laryngis, hemangiomer, bulbære syndromer ved nevrologiske sykdommer, operasjoner i bakre skallegrop og laryngomalasi. Enhver luftveisobstruksjon eller blokade kan kompliseres med lungeødem, og ettersom dette kan debutere med flere timers latens samt varierende alvorlighetsgrad, er tilstanden sannsynligvis hyppig oversett.
Pasienten. En fire år gammel gutt på 22 kg ble innlagt for elektiv adenotomi og paracentese. For øvrig var han frisk. Narkosen ble innledet med tiopental 175 mg for søvn, alfentanyl 200 + 200 g som smertestillende, atropin 0,1 mg for refleksbeskyttelse og hemning av spyttsekresjon og til sist vecuronium 1,5 mg for nevromuskulær blokade. Søvnen ble vedlikeholdt med 4 % sevofluran gjennom en preformert tube med en indre diameter på 5,5 mm uten luftmansjett. (Opplysninger om luftlekkasje foreligger ikke.) Kirurgi startet ti minutter etter narkoseinnledning og varte i 15 minutter. Pasienten ble ekstubert 20 minutter etter siste alfentanyldose og ti minutter etter seponering av sevofluran og lystgass. Han ble vurdert til å være i et «våkent» stadium ved ekstubasjon.
Straks etter ekstubasjonen oppstod det inspiratorisk stridor. Vi observerte redusert thoraxbevegelighet, subkostale inndragninger, rekruttering av hjelpepustemuskler og pulsoksymetri i området 75 – 80 %, med ekstremverdier 60 – 94 %. Denne første fasen varte i 30 minutter, og ble så etterfulgt av en fase med mindre grad av pustestress, om enn med påskyndet pustefrekvens fallende fra 68 til 40 over de neste to timer. Det var aldri bradykardi.
Pasienten ble i 30 minutter overtrykksventilert på maske synkront til egenrespirasjon med oksygen alene. I sekvens ble følgende medikamenter gitt over en periode på 40 minutter: glykopyrron (Robinul-Neostigmin) 0,45 ml intravenøst, nalokson 20 g intravenøst, suksametonium 2 mg intravenøst, aminofyllin 120 mg intravenøst, adrenalin 0,2 mg subkutant, flumazenil (Anexate) 0,05 mg intravenøst, kortikosteroid 100 mg intravenøst og salbutamol (Ventoline) 1,0 mg som inhalasjon. Man så en klinisk bedring etter 30 minutter og en normalisering etter 90 – 120 minutter. Man fant ingen grunn til reintubasjon. I perioden etter overtrykksventileringen spontanpustet pasienten med et inhalasjonstillegg av racemisk adrenalin, nebuliserte vannpartikler og salbutamol. Deretter fikk han fysioterapi og pustet innimellom i CPAP-maske.
Røntgen thorax i serie med første bilde tatt to timer (fig 1) etter ekstubasjon viste fortetninger forenlig med interstitielt ødem og overlappsatelektase. Ødemet nærmest normaliserte seg i løpet av ni timer (fig 2) og fullstendig i løpet av 48 timer (fig 3), men med bestående atelektase. Pasienten var på dette tidspunkt helt ubesværet. Siste kontrollbilde tatt etter 14 dager var helt normalt.
Diskusjon
Ødem dannes ved lekkasje av celle- og proteinfri væske (transudat) fra det intravaskulære til det interstitielle rom, og bestemmes av tautrekkingen mellom intravaskulære og interstitielle krefter av hydrostatisk og osmotisk karakter (Starlings hypotese, fig 4). Det er de hydrostatiske krefter som dominerer, og disse antas å være enerådende tidlig i ødemdanningen. Nettoeffekten er økt transudasjon til det interstitielle rom. Ut i forløpet tror man at ødemet forsterkes ved permeabilitetsforandringer i lungekapillarene, slik at celler og proteiner (eksudat) lekker ut i interstitiet.
Økt transudasjon
Økt transudasjon oppstår via to mekanismer; en økning av undertrykket i interstitiet og en økning av det intravaskulære hydrostatiske trykk (fig 4). Det interstitielle undertrykk transformeres i sin helhet ved luftveisblokade fra det intrapleurale trykk (4). Ved forsert inspirasjon mot lukket glottis (Mullers manøver) kan det intrapleurale undertrykk øke til 70 – 80 cm vann. Nettoeffekt av et slikt kraftig undertrykk i interstitiet kan, i henhold til Starlings hypotese (fig 4), bli ødem.
Det intravaskulære hydrostatiske trykk , med andre ord trykket i pulmonalkretsløpet, øker via en kombinasjonen av netto økt blodstrøm til lungene kombinert med økt motstand i lungekretsløpet. En forutsetning for at ødem dannes som følge av dette er at motstanden i lungekretsløpet sitter post- og ikke prekapillært. Gjennomstrømning i pulmonalkretsløpet økes via to mekanismer: For det første økt venøs retur til thorax (jf. det negative intrapleurale trykk), og for det annet skjer dette pga. en alfaadrenerg mediert perifer vasokonstriksjon som bevirker en redistribusjon av det sirkulerende volum fra det systemiske høymotstandssystem til lavtrykkssystemet i det lille kretsløp. Dette medieres av katekolaminer frisatt ved den sympatikusutladning som hypoksi og stresstimulering forårsaker (fig 5). Dette antas også å være en mekanisme ved nevrogent lungeødem (5).
Motstanden i lungekretsløpet kan øke enten som følge av den pulmonale vasokonstriksjonsrefleksen som utløses ved hypoksi eller sekundært til en reduksjon av slagvolumet i venstre ventrikkel (fig 5). Peters og medarbeidere (6, 7) har i forsøk med hund vist at et økt undertrykk i pleura vil øke arterietrykket (afterload) for venstre ventrikkel med redusert slagvolum i venstre ventrikkel og påfølgende økning i så vel endediastolisk som endesystolisk volum. Liknende funn er også vist for mennesket (7, 8). Volum er imidlertid ikke synonymt med endring i trykk.
Ettersom begge ventriklene opererer innenfor det samme lukkede rom avgrenset av perikard, og venøs retur til høyre hjertehalvdel som vist over er økt ved forsert inspirasjon, utvider denne seg på bekostning av venstre side, og ved samtidig volumøkning på venstre side avstedkommer dette en trykkøkning i pulmonalkretsløpet. Dette forplanter seg så bakover i pulmonalkretsløpet som økt trykk, og vi får ytterligere blodansamling i lungekretsløpet (fig 5). Pulmonal vaskulær komplianse (DV/DP) i pulmonalkretsløpet er kun 10 % av tilsvarende perifert. (7, 9) Derfor vil en økning av lungens blodvolum raskt føre til en trykkøkning i lungekretsløpet, og trykk er den sentrale parameter hva angår transudasjon i henhold til Starlings likning (fig 4). Endelig kan venstre ventrikkels kontraktilitet være redusert pga. metabolsk acidose som en følge av hypoksi (fig 5).
Økt eksudasjon
En kapillarlekkasje av celle- og proteinholdig serum (eksudat) pga. endret kapillarpermeabilitet er også en medvirkende faktor, om enn noe senere i forløpet. Det er vist at permeabiliteten i lungekapillarer hos kanin øker ved hydrostatisk kapillartrykk som overstiger 40 mm Hg (10). Hos mennesket kan trykket i lungekapillarer selv ved fysisk anstrengelse stige til 30 mm Hg. Hypoksi og det negative intrapleurale trykket (jf. barotraume) kan i seg selv medføre økt kapillarpermeabilitet (11).
Auto-PEEP (positivt endeekspiratorisk trykk)
Så vel klinisk erfaring som forskning tyder på at lungeødemet oppstår, eller i hvert fall utvikler seg sterkere, etter at luftveisobstruksjon heves, likegyldig om obstruksjon har oppstått akutt eller kronisk. Det har vært spekulert i om et forsøk på ekspirasjon mot lukket glottis (Vasalva-manøver) gir en auto-PEEP som altså øker det intratorakale trykket slik at det reduserer undertykket som skapes i interstitiet ved Mullers manøver. Når lufveiene så frigjøres, manifesterer det negative interstitielle trykket seg maksimalt, og ødem dannes.

Figur 4 Starlings hypotese for kapillærfiltrasjon
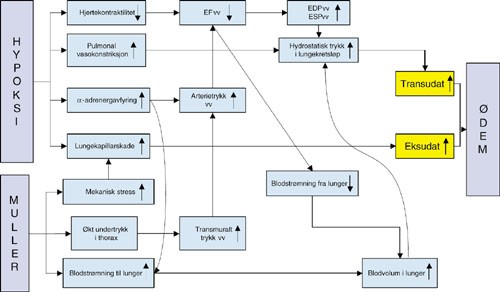
Figur 5 Hendelsesdiagram for utvikling av NPPE ( negative pressure pulmonary edema) som viser hvordan hypoksi og forsert inspirasjon mot adapterte stemmebånd (Mullers manøver) i en sum av transudasjon (tidlig effekt) og eksudasjon (sen effekt) danner interstielt lungeødem. VV = venstre ventrikkel. EF = ejeksjonsfraksjon. EDP= endediastolisk trykk. ESP = endesystolisk trykk
Lungeødem
Lungeødem som utvikles ved forsert inspirasjon har god prognose, men kan være assosiert med tilstander som i seg selv kan være livstruende. Det kliniske bildet varierer fra et fulminant lungeødem med blodtilblandet ekspektorat og klare røntgenfunn, til det mer vanlig forekommende moderate kliniske bildet med uklare røntgenfunn. Vår pasient hadde et moderat klinisk bilde, men røntgenbildene viste klare funn i form av en overlappsatelektase og interstitielt ødem (fig 1 – 3). All den tid pasienten var klinisk upåfallende før operasjonen og oksygeneringen var normal under operasjonen, tror vi lungeforandringene oppstod etter operasjonen. Overlappsatelektasen kan ha oppstått som en følge av det kraftige negative intrapleurale trykk under forsert inspirasjon, en trykkgradient som vil være maksimal mot lungetoppene hos en sittende eller stående pasient. Asymmetrien kan skyldes slimplugging. Derved er atelektasen et resultat av dynamisk lungekollaps som raskt reekspanderer spontant eller ved hjelp av CPAP-behandling. Tidlig bronchusavgang til høyre overlapp gjør denne sårbar for blokade av en tube som sitter like distalt for carina.
Tilstanden debuterte tidlig hos vår pasient, og det er vist (12) i en retrospektiv studie at hos 12 av 19 pasienter debuterte lungeødemet (verifisert ved røntgen) innen tre minutter etter ekstubasjon, men det er også referert til tilfeller med inntil seks timers latenstid før debut av lungeødem (13, 14). Prognosen er god og som behandling er det ofte tilstrekkelig med oksygenanrikning, diuretika og CPAP, i sjeldnere tilfeller overtrykksventilasjon (15). Man skal imidlertid ikke undervurdere tilstandens alvorlighetsgrad ettersom det i retrospektive litteraturstudier er vist en mortalitetsrate på 11 – 40 % (16, 17). Vi mener at intubasjon med overtrykksventilasjon bør gjøres på liberal indikasjon siden overtrykksventilasjon er effektiv antiødematøs terapi.
Vi antar at den utløsende faktor for inspiratorisk stridor hos vår pasient kan ha vært larynxspasme med et senere vedlikeholdende tillegg av luftveisødem. Ødemet kan ha oppstått som følge av det mekaniske trykk den endotrakeale tube utøvde på slimhinnene i øvre luftveier. Tendensen til ødemdanning antas å være økt hos barn generelt, men er spesielt økt ved pågående eller nylig gjennomgått luftveisinfeksjon. Trange luftveier hos barn vil raskere nå den kritiske nedre verdi for tverrsnitt av lumen som forårsaker overgang fra laminær til turbulent luftstrømning (jf. Reynolds tall for turbulensgrense og Poiseuilles lov for gasstrøm).
Den forserte inspirasjon var videre sterk nok til å fremkalle et lungeødem som forsterket hypoksien ytterligere. En ond sirkel med hypoksiutløst forsert inspirasjon som genererer lungeødem var derved sluttet. I henhold til litteraturen kan pasienten med sine adenoide vegetasjoner ha vært i en risikogruppe ettersom ekstirpasjon av disse fjerner en auto-PEEP-effekt, med økt risiko for utvikling av lungeødem under forsert inspirasjon. Gjenglemt tampong ved munn-nese-kirurgi kan også forårsake akutt luftveisblokade, men slike brukes ikke ved vår øre-nese-hals-avdeling.
Vi takker overlege Gunnar Stake ved Seksjon for barneradiologi, Rikshospitalet, for hjelp til tolking av røntgenbilder, og Fototeknisk avdeling samme sted for avfotografering av røntgenbilder.