Alle sulfonylureapreparatene har tilnærmet lik blodsukkersenkende effekt, og reduserer Hb A1c i gjennomsnitt med 1 – 1,5 prosentpoeng. Det gjelder også repaglinid (1). Nateglinid ser ut til å ha noe mindre effekt på Hb A1c og fastende blodsukker, og senker først og fremst postprandialt blodsukkernivå når medikamentet tas før måltidet (2).
I det siste har det vært satt søkelys på postprandial hyperglykemi som mulig selvstendig risikofaktor for diabetiske komplikasjoner, først og fremst hjerte- og karsykdommer. Det var bakgrunnen for en nylig publisert studie der man sammenliknet effekten av repaglinid, glipizid og glibenklamid på insulinutskilling og postprandialt blodsukkernivå etter et standardmåltid (3). Det viste seg at glipizid og repaglinid hadde den samme blodsukkersenkende effekten postprandialt, mens glibenklamid senket blodsukkernivået mindre.
Foreløpig er det bare epidemiologiske studier som har antydet en selvstendig rolle for postprandial hyperglykemi som risikofaktor for kardiovaskulær sykdom. Det finnes ikke god nok dokumentasjon til at man kan anbefale postprandial blodsukkerreduksjon som et hovedmål i diabetesbehandlingen.
Virkningsmekanisme
De insulinøkende midlene virker ved å stimulere insulinsekresjonen via binding til ATP-avhengige kaliumkanaler (K+-ATP-kanaler) i cellemembranen på betacellene i pancreas. Kanalene lukkes, cellemembranen depolariseres, Ca++ strømmer inn i cellen, og dette medfører frigjøring av insulin. To komponenter utgjør K+-ATP-kanalene: en regulatorisk del, sulfonylureareseptoren (SUR) hvor medikamentene primært bindes, og selve kanalproteinet (fig 1).
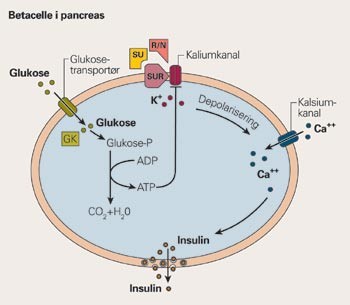
Forenklet skisse som beskriver mekanismene for insulinsekresjonen i betacellene og virkningen av de insulinøkende medikamentene. Glukose stimulerer insulinsekresjonen ved å transporteres inn i cellen via en glukosetransportør. Etter fosforylering ved hjelp av glukokinase (GK) til glukose-6-fosfat (Glukose-P), metaboliseres det til CO₂ og H₂O, og energien overføres til adenosindifosfat (ADP) som omdannes til adenosintrifosfat (ATP). Økning i ATP-ADP-ratio fører til lukking av kaliumkanaler, depolarisering av cellen og åpning av spenningsstyrte kalsiumkanaler. Kalsiumioner (Ca++) strømmer inn i cellen og fører til translokasjon av insulingranula til celleoverflaten og frigjøring av insulin. K+-ATP-kanalene kan også lukkes ved aktivering av sulfonylureareseptoren (SUR), når den binder et sulfonylureapreparat (SU), nateglinid (N) eller repaglinid (R)
Forskjellene mellom de ulike medikamentene skyldes i stor grad de farmakokinetiske egenskapene (tab 1) og ulik affinitet til K+-ATP-kanalene. Glibenklamid binder seg med høy affinitet til betacellenes K+-ATP-kanaler. Bindingen er tilnærmet irreversibel sannsynligvis fordi glibenklamid binder seg til to steder, sulfonylureabindingsstedet og et benzamidosete på SUR (4). Sistnevnte svarer til nateglinids bindingssted. Glimepirid binder seg 2,5 – 3 ganger raskere og dissosierer 8 – 9 ganger raskere fra bindingsstedet på betacellen (5). Det bidrar til en raskere innsettende effekt og kortere virketid. Nateglinid bindes og dissosierer så raskt at binding bare kan påvises indirekte ved fortrengning av glibenklamid. Virketiden av medikamentene påvirkes også av om det foreligger aktive metabolitter. Det ser ut til at dette kun har klinisk betydning for glibenklamid (6).
|
Tabell 1 Noen karakteristika ved ulike perorale antidiabetika
|
|
Salgsnavn
|
Dose- intervall mg/dag
|
Antall doser per dag
|
Halverings- tid (timer)
|
Virketid
|
Utskilling
|
Pris per dag1 ved maksimal dose, kr
|
|
Sulfonamider
|
|
|
|
|
|
|
|
|
Glibenklamid
|
Daonil
|
1,75 – 10,5
|
1 (–2)
|
10²
|
Lang
|
Urin 50 %, galle 50 %
|
4,50
|
|
Glipizid
|
Mindiab
|
2,5 – 15
|
1
|
2 – 4
|
Middels
|
Urin 65 %, galle 15 %
|
5,00
|
|
Apamid
|
|
|
|
|
|
5,00
|
|
Glipizid
|
|
|
|
|
|
5,00
|
|
Glimepirid
|
Amaryl
|
1 – 4(6)
|
1
|
5 – 8²
|
Middels
|
Urin 60 %, galle 40 %
|
9,00
|
|
|
|
|
|
|
|
|
|
Meglitinidderivat
|
|
|
|
|
|
|
|
|
Repaglinid
|
NovoNorm
|
1,5(2,0) – 12(16)
|
til hvert måltid
|
1
|
Kort
|
Hovedsakelig galle
|
38,50
|
|
|
|
|
|
|
|
|
|
D-fenylalaninderivat
|
|
|
|
|
|
|
|
|
Nateglinid³
|
Starlix
|
180 – 360 (540)
|
til 3 hovedmåltider
|
1,5²
|
Kort
|
Urin 85 %, galle 10 %
|
12,50
|
|
[i]
|
Medikamentene metaboliseres hovedsakelig i lever og metabolittene utskilles i urinen, med unntak av repaglinid, som hovedsakelig utskilles via gallen. Dette medfører at medikamentene er kontraindisert ved alvorlig lever- og nyresykdom, mens repaglinid kan benyttes ved redusert nyrefunksjon.
Uønskede effekter
Hypoglykemi
Den viktigste bivirkningen av de insulinøkende medikamentene er hypoglykemi. Sulfonylureaindusert hypoglykemi er tidligere omtalt i Tidsskriftet (7). Glibenklamid utgjør den største risikoen, men forekomsten varierer noe i de ulike studiene. I en større, prospektiv studie fra Tyskland angis en insidens av alvorlig hypoglykemi for glibenklamid til 5,6/1 000 pasientår og for glimepirid 0,86/1 000 pasientår (8). Det er antatt at skifte av behandling fra glibenklamid til glipizid eller glimepirid vil kunne halvere forekomsten av alvorlig hypoglykemi (9).
Også de nyere midlene repaglinid og nateglinid har lavere hypoglykemiforekomst enn glibenklamid. Det gjelder særlig hypoglykemi som skyldes at pasientene utsetter eller hopper over et måltid.Alvorlige hypoglykemitilfeller utløst av perorale antidiabetika krever sykehusinnleggelse og behandling med intravenøs glukosetilførsel i minst 24 timer. Mortaliteten er rapportert å være minst 10 %. Karakteristisk for pasientene som utvikler alvorlige hypoglykemi er nylig igangsatt behandling, høy alder, hjerte-, nyre- eller leversykdom eller alkoholinntak.
Vektøkning
Langtidsbehandling med insulinøkende midler medfører oftest vektøkning på 1 – 3 kg det første året. Dette er uheldig hos en gruppe pasienter som gjerne er overvektige fra før, men kan ofte motvirkes ved god informasjon om kost og fysisk aktivitet ved behandlingsstart. Råd om redusert matinntak er nødvendig da noe av vektøkningen kommer som en følge av en bedret metabolsk kontroll, med derav redusert glukosuri. Moderate hypoglykemier kan for mange også manifistere seg i form av sultfølelse og gjentatte tilfeller kan føre til en betydelig vektoppgang. Det ser ut til at alle preparatene i gruppen gir en slik vektøkning, men i en sammenliknende studie mellom repaglinid og glibenklamid, økte vekten noe mindre i repaglinidgruppen (10).
Kardiovaskulære effekter
Etter at UGDP-studien (University Group Diabetes Program) i 1970 hadde antydet økt kardiovaskulær mortalitet blant pasienter som ble behandlet med et tidlig sulfonylureapreparat (tolbutamid), ble det mye diskusjon om potensielt uheldige kardiale effekter av disse medikamentene (4). UGDP-studien er imidlertid sterkt kritisert. Ny kunnskap om preparatenes virkningsmekanisme har ført til nye studier. K+-ATP-kanaler finnes på de insulinproduserende cellene i pancreas (SUR 1), men også på kardiomyocytter (SUR 2A) og arterienes glatte muskelceller (SUR 2B), samt intracellulært lokalisert bl.a. til mitokondriene. Det ser ut til at de mitokondrielle K+-ATP-kanalene bidrar til å beskytte myokard mot iskemi ved iskemisk prekondisjonering (11). Kanalene åpnes ved truende iskemisk skade, men denne gunstige beskyttelsesmekanismen kan blokkeres ved at glibenklamid bindes til kanalen. Glipizid har muligens også den samme negative effekten (12), men det ser ikke ut til å gjelde for de andre medikamentene i gruppen. Glimepirid binder seg ikke til de mitokondrielle K+-ATP-kanalene. Repaglinid og nateglinid gjør det, men selektiviteten varierer og den korte halveringstiden vil minimere en eventuell effekt på iskemisk prekondisjonering (13). Disse dataene stammer fra in vitro-studier og dyreforsøk, og den kliniske betydning ved behandling av pasienter med diabetes er usikker.
Flere kliniske studier har ikke kunnet vise økt mortalitet ved hjerteinfarkt hos pasienter som bruker sulfonylureapreparater sammenliknet med pasienter som behandles med andre antidiabetika. Den viktigste av disse undersøkelsene er UKPDS (United Kingdom Prospective Diabetes Study) (14).
Konklusjon og anbefalinger
Alle de insulinøkende medikamentene reduserer Hb A1c omtrent like mye. De avgjørende faktorer i valget mellom dem er derfor risikoen for bivirkninger, dosering i forhold til pasientetterlevelse (compliance) og pris. Medikamentene forutsetter at betacellene er i stand til å skille ut insulin, og virker derfor best tidlig i diabetessykdommens utvikling. Bruken av glibenklamid bør sannsynligvis reduseres til fordel for glipizid og glimepirid på grunn av mindre fare for alvorlig hypoglykemi. Repaglinid og nateglinid kan ha en fordel ved at de virker direkte til det måltidet de inntas sammen med, og man kan utsette eller hoppe over både tablettinntaket og måltidet dersom det er ønskelig. Høy pris, manglende refusjon på blåresept og kort erfaring med bruken tilsier imidlertid at medikamentene foreløpig har en beskjeden plass ved behandling av type 2-diabetes.