Jonas Frisén fikk en gedigen aha-opplevelse i 1993, en dag hanmikroskoperte skadet ryggmarg i rotter. Den ferske doktorandenved Karolinska Institutet i Stockholm la merke til en mengde celler som så ut til å reparere nervevevet. Tanken slo ned i ham: Kunne dette være nevrale stamceller? Det tok ham seks år å finne svaret.

Jonas Frisén har funnet stamceller i hjernen som kan manipuleres til å danne ulike typer av spesialiserte celler. Han tror at adulte stamceller i fremtiden kan bli en kilde for nydanning av nerveceller som kan erstatte nervevev som er skadet eller har gått tapt på grunn av sykdom. Foto T. Sundar
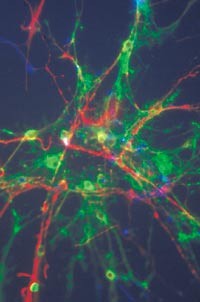
Stamceller i menneskehjernen: nerveceller fremstår som røde, astrocytter som blå og oligodendrocytter som grønne. Foto Neuro Nova
Det var stamceller han hadde sett. Nerveskaden hadde igangsatt en prosess som stimulerte celledeling og cellenydanning i ryggmargen. I 1999 kunne Frisén legge frem oppsiktsvekkende bevis fra dyreforsøk på at sentralnervesystemet inneholder stamceller som finnes blant ependymcellene som kler innsiden av ventrikkelsystemet, hjernens indre kompleks av hulrom og ganger (1). Året før hadde en annen svensk gruppe ledet av Peter Eriksson i Göteborg, vist at det faktisk foregår en nydanning av nerveceller i menneskehjernen (2).
I den medisinske verden var dette uortodokse tanker, ettersom ependymcellene ble betraktet som spesialiserte støtteceller, såkalte gliaceller, hvis viktigste kjente funksjon var å danne byggesteinene i cellebarrieren mellom cerebrospinalvæske og hjernevev.
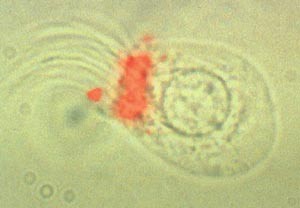
En enkelt ependymalcelle fra en av hjernens ventrikler. Denne celletypen er sentralnervesystemets egen stamcelle. Foto Neuro Nova
Myter for fall
– Det er en myte at det ikke dannes nye nerveceller etter fosterlivet og at det bare foregår en suksessiv reduksjon av dem. Nå vet vi at nevroner lages i visse deler av hjernen gjennom hele livet, sier Jonas Frisén, stamcelleforskeren som har bidratt til å endre vårt bilde av nervesystemet radikalt (3). I 2001 ble han hentet inn til Sveriges første professorat i stamcellebiologi ved Karolinska Institutet, hvor han siden 1997, da han vendte tilbake til Sverige etter flere års forskning i USA, har bygd opp et team på 20 medarbeidere.
I fjor kom han med på Newsweeks prestisjetunge liste over 12 personer som forventes å sette et sterkt preg på utviklingen innen ulike områder fra politikk til medisin. Friséns navn knyttes til forventninger om et forestående gjennombrudd for stamcelleteknologi som et terapeutisk våpen i kampen mot sykdommer som det i dag ikke finnes helbredende behandling for. I første rekke er det snakk om nevrodegenerative tilstander som Parkinsons sykdom og amyotrofisk lateralsklerose (ALS), men også diabetes og hjerte- og karlidelser.
I 36-åringens velutstyrte molekylærbiologiske laboratorium overdøves summingen fra analyse- og cellesorteringsmaskinene av smektende hip-hop-rytmer fra et veggmontert musikkanlegg. De tidsriktige tonene og en lav gjennomsnittsalder i staben, vitner om at stamceller er et ungt og ambisiøst forskningstema ved Nordens kanskje mest tradisjonsrike medisinske lærested.
Stillingen hans er et donasjonsprofessorat bekostet av Tobias Stiftelsen, et forskningsfond opprettet av finansmannen Marcus Storch og oppkalt etter sønnen Tobias som døde av leukemi. Stiftelsen, som gir tilskudd til forskning på beinmargstransplantasjoner og bloddannende stamceller, har lovet å finansiere stamcelleprofessoratet i minst 15 år. Stamcelleforskning er imidlertid ingen nyhet ved Karolinska Institutet. Her har man i tre tiår studert beinmargsceller, som i dag anvendes i behandlingen av leukemi. Arbeidet med stamceller i nervesystemet bygger således på en etablert forskningstradisjon, og ble et satsingsområde i begynnelsen av 1990-årene da Urban Lendahl oppdaget at pro-teinet nestin er en sentral markør for nevrale stamceller. Lendahl er nå en av Friséns viktigste samarbeidspartnere.
I diskusjonen rundt Sveriges nye giv for stamceller, blir det fremholdt at landets lovverk åpner for forskning på embryonale stamceller på samme liberale måte som i Storbritannia og Singapore. I USA, derimot, har det siden 2001 vært strenge restriksjoner for bruken av slike celler. Den amerikanske utviklingen er ingen ulempe for svenskene, som ifølge EU-kilder sitter på 10 % av verdens embryonale stamcellelinjer.
Men det er ikke embryonale stamceller som opptar Karolinskas unge forskergarde mest. For øyeblikket retter de oppmerksomheten mot adulte stamceller, kroppens egne, multipotente celler. Slike finnes i hjerne, blod, lever og muskulatur, og har som oppgave å fornye og reparere ulike vev.
– Utfordringen vi står overfor, er å få metoder for å identifisere og kontrollere disse cellene. Det er krevende fordi stamcellene finnes bare i små antall og mangler spesifikke markører som de fleste spesialiserte celler har, sier Jonas Frisén.
Fremtidig erstatningsterapi?
Ved Karolinska pågår det en rekke prosjekter innrettet både mot stamcellenes vekst- og utviklingsmønster og mot å påvirke dem farmakologisk. Forskerne her har gjort flere nøkkeloppdagelser, blant annet at musestamceller gjennom selvfornyende deling kan bli til nerveceller, astrocytter og oligodendrocytter (4), at det i menneskets hjerne finnes stamceller både i ventrikkelsystemet og hippocampus, et viktig hukommelsessenter (5), og at nevrale stamceller injisert i kylling- og museembryoer kan utvikle seg til hjerte-, lever-, hud- og tarmceller (6).
– Her snakker vi om ekstreme eksperimentelle betingelser, men like fullt er dette bevis for stamcellenes enorme plastisitet. Nevrale stamceller, for eksempel, kan bli til både gliaceller og nerveceller, avhengig av hvilke miljøfaktorer de utsettes for, sier Frisén.
Han er likevel snar til å dempe forventningene når samtaletemaet dreier over på mulige erstatningsterapier for lidelser i sentralnervesystemet som ALS, Parkinsons eller Alzheimers sykdom.
– Fortsatt vet vi ikke hva som gjør at stamceller gir opphav til én celletype fremfor en annen. At de lar seg påvirke in vitro, betyr ikke nødvendigvis at de oppfører seg på samme måte in vivo. Vi vet heller ikke om ependymale stamceller i hjernen utgjør én eller flere subpopulasjoner. Et annet uavklart spørsmål er risikoen for tumorutvikling dersom replikasjonsfeil forekommer og det oppstår dysfunksjonelle celler.
Jonas Frisén ser likevel for seg to konseptuelle strategier for erstatningsterapi: transplantasjon og farmakologisk påvirkning (7). Transplantasjon innebærer å høste stamceller fra pasienten, ekspandere og påvirke celleproduksjonen in vitro for å frembringe celler av ønsket type, og så tilbakeføre disse til pasienten. Dette er en tenkelig terapi ved Parkinsons sykdom, for å erstatte tap av dopaminproduserende celler.
Han heller imidlertid mer til den farmakologiske strategien: å få pasientens egne stamceller til å danne nerveceller, uten at det må skje gjennom invasive prosedyrer. Frisén tenker seg i stedet at pasienten på enkelt vis kan få tilført cellestimulerende farmaka.
– Vi arbeider intenst med å finne et slags nevropoietin som påvirker og styrer nevrale stamceller, på samme måte som erytropoietin stimulerer hematopoetiske stamceller.
– Hvor mange år vil det ta?
– Vi er på sporet av slike substanser hos mus, og vil snart publisere våre funn. Mer enn det kan jeg ikke si nå, smiler han hemmelighetsfullt.
Huddinge satser på celleterapier
Noen mil sør for Stockholm ligger et av Nord-Europas største sykehus, Huddinge Universitetssjukhus, som har 30 års erfaring med transplantasjonsmedisin. I 1991 ble verdens første xenotransplantasjon av insulinproduserende pancreasvev fra gris til mennesker utført her. Ingen av de transplanterte diabetespasientene ble insulinfrie, men transplantatene overlevde i flere uker. De siste årene har sykehuset vært ledende i arbeidet med å utvikle metoder for human transplantasjon av langerhansøyer, hvilket nå er etablert som et behandlingsalternativ ved type 1-diabetes. Huddinge samarbeider med flere nordiske sentre, deriblant Rikshospitalet i Oslo, om å ta i bruk teknologien.
Sammen med Karolinska Institutet har Huddinge Universitetssjukhus ervervet spisskompetanse innen mikrobiologi, immunologi og transplantasjonsmedisin. Dette gir gode forutsetninger for å gå videre med fremtidsrettet forskning på celleterapi, en behandlingsform som forventes å eks-pandere i de nærmeste årene.
– Mangel på organ- og vevsdonorer gjør at det ikke lenger er mulig å imøtekomme transplantasjonsbehovet innen flere kliniske områder. Videre er det en stor belastning for transplanterte pasienter å bruke immunsupprimerende medisiner. For diabetespasienter, er det helt klart at transplantasjon av bukspyttkjertler og langerhansøyer aldri kan bli noe behandlingstilbud i stor skala. Derfor leter vi etter stamceller som en kilde til kompetent vev, sier professor Jan Holgersson ved avdeling for klinisk immunologi. Han tilhører én av ca. 15 forskergrupper ved Huddinge Universitetssjukhus som arbeider eksperimentelt eller klinisk med celleterapi innen ulike områder som diabetes, blodsykdommer, kreft, kroniske virusinfeksjoner og hjerte- og karsykdommer.
Forskerne har lenge vært opptatt av de terapeutiske mulighetene knyttet til embryonale stamceller, og selv om det svenske universitetssykehuset er i besittelse av slike cellelinjer, står både etiske og praktiske hindringer i veien for å utnytte dette alternativet.
Tror på gjennombrudd
I stedet har man festet blikket på adulte stamceller. Jan Holgersson viser til de siste forskningsresultatene på fronten, som viser at både kjertelceller i pancreas og lever og stamceller i beinmargen har potensial til å danne insulinproduserende celler (8).
– Ved å kombinere kunnskaper om stamcelleteknologi og transplantasjonsmedisin, tror vi at det i fremtiden blir mulig å frembringe kompetente betaceller fra kroppens egne stamceller. Blir dette en realitet, vil tusener av insulinavhengige diabetikere få et nytt liv, sier den svenske immunologen.
Han peker på to tilnærminger for å nå målet: Den ene er å anvende genmodifiserte celler, mens den andre er å identifisere og isolere adulte stamceller fra bukspyttkjertel eller beinmarg. Forsøk på å modifisere og dirigere celler ved hjelp av genteknologi har imidlertid så langt vært skuffende. Bruk av stamceller, derimot, synes å være lovende: – Vi har sett at kjertelceller i pancreas er i stand til å produsere insulin under eksperimentelle betingelser. Det store spørsmålet er hvordan disse cellene, som i utgangspunktet er eksokrine og innrettet på å produsere pancreasenzymer, kan påvirkes til å bli endokrine celler som lager insulin.
Jan Holgersson forsker på å finne frem til vekst- og stimuleringsfaktorer som virker på stamcellene in vitro. Til nå er det bare oppdaget et fåtall slike, for eksempel hepatocyttvekstfaktor og keratinocyttvekstfaktor som stimulerer vekst av kjertelceller, eller nikotinamid som stimulerer differensiering til insulinproduserende betaceller.
– Ikke før vi oppdager flere faktorer, vil det være mulig å dirigere og differensiere umodne celler. Foreløpig er xenotransplantasjon et mer realistisk alternativ enn stamcelleterapi for fremtidens diabetespasienter, sier Jan Holgersson. Han er likevel optimist og tror på et gjennombrudd for celleterapi innen noen tiår.
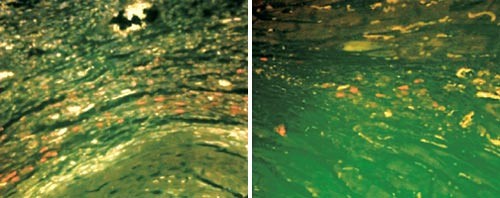
De to bildene viser vev i infarsert hjerte hos mus som fikk injeksjoner med humane mesenkymale stamceller: a) Etter et par dager har stamcellene, farget med rødt, søkt seg til det skadede området. b) Ti dager senere sees overlevende stamceller, men antallet er betydelig redusert. Foto K. Le Blanc, Huddinge Universitetssjukhus
Advarer mot snarveier
På en annen kant av Huddinge Universitetssjukhus prøver kardiologiprofessor Christer Sylvén å finne ut om stamceller kan brukes i behandlingen av hjerteinfarkt. Sylvén, som har forsket på genterapi og angiogenese i tilknytning til iskemisk hjertesykdom, har foruten embryonale stamceller kastet øynene på mesenkymale stamceller; en type beinmargscelle, og myoblaster; et mellomstadium mellom mesenkymale stamceller og ferdig utviklede muskelceller. Forskernes interesse for disse cellene beror på at de under visse betingelser uttrykker hjertespesifikke proteiner og har elektriske egenskaper som man ellers bare finner i hjertemuskelceller (9). Begge typene er adulte stamceller, og dermed ikke befengt med de samme etiske kontroverser som omgir forskning med embryonale stamceller. De er også lettere å kultivere. Myoblaster høstes gjennom muskelbiopsier, mesenkymale stamceller gjennom beinmargsbiopsier.
Ved hjerteklinikken ved Huddinge har man injisert humane stamceller inn i mus etter først å ha fremkalt hjerteinfarkt hos forsøksdyrene. Både myoblaster og mesenkymale stamceller har vært brukt i pilotforsøkene.
– Cellene søker seg til det skadede området og utvikler seg til noe som likner muskelceller. De ser ut til å ha en viss reparativ kapasitet, men overlever maksimalt i et par uker, forteller Sylvén.
Noen prosentandeler av myoblastene klarer seg, mens overlevelsen er høyere for de mesenkymale stamcellene. Myoblastene er dessuten predisponert til å utvikle seg til skjelettmuskelceller, og har derfor ikke samme potensial som mesenkymale celler til å danne hjertemuskelceller. Jo mer differensiert stamcellene er, jo lavere utnyttelsesgrad har de. Cellene taper antakelig sine plastiske egenskaper når de eldes, noe som trolig også vil være tilfelle hos eldre mennesker som hyppigst rammes av hjerteinfarkt.
Trass i disse begrensningene, er Christer Sylvén mest opptatt av mulighetene knyttet til stamcellene: – Hvis vi kan få mesenkymale celler til å overleve og migrere til infarsert vev, og dessuten påvise bedring av hjertefunksjonen, vil vi ha kommet et langt skritt i retning av en celleterapi, sier han. Planen fremover er å gi forsøksdyr det immunsupprimerende midlet ciklosporin forut for celletransplantasjon. Etter hvert håper man å innlede kliniske forsøk med mesenkymale stamceller på hjertepasienter; en første søknad om dette ble i fjor avslått av den lokale etiske komiteen.
Ifølge Sylvén er stamcelleforskningen som skjer på Huddinge strengt tuftet på eksperimentelle studier. Han sier han er rystet over mye av det som skjer på denne fronten internasjonalt, og som han kaller for cowboyforskning: – Det er stadig kreative eksempler på bruk av stamceller i pasientforsøk uten at man først dokumenterer nytten av dette i eksperimentelle studier, sier han. Han viser til Frankrike, der forskere har sprøytet beinmarg direkte inn i infarserte hjerter på levende mennesker. Ukontrollerte forsøk som det er nærmest verdiløse, mener han.
– Dette er en form for spekulativ forskning ingen er tjent med. Skal vi komme noen vei innen stamcelleforskning, må tingene gjøres systematisk og skritt for skritt. Man kan ikke ta snarveier, sier den svenske forskeren.
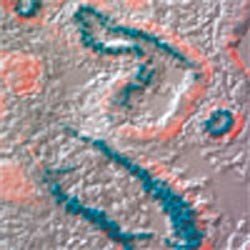
Hjernestamceller fra mus (blå farge) er blitt overført til et kyllingembryo, der de deler seg og gir opphav til nyretubuli-celler (rød farge). Foto J. Frisen & Neuro Nova.
Etiske kjøreregler
Den etiske debatt rundt stamceller er langt fra fraværende i svensk forskning. Tvert om, har det siden 2000 vært en bred prosess for å etablere klare etiske retningslinjer for human stamcelleforskning (10). Foranledningen var at en gruppe forskere ved Huddinge Universitetssjukhus hadde søkt om å få dyrke stamceller fra fem dager gamle embryoer som var til overs etter kunstig befruktning.
I 2001 formulerte det svenske vitenskapsrådet nye retningslinjer basert dels på anbefalinger som EU-kommisjonens rådgivende gruppe i etiske spørsmål og Nordisk ministerrådGOs bioteknologikomité har utarbeidet. Deler av forskningen innen området er allerede regulert av den svenske transplantasjonsloven, hälso- og sjukvårdslagen samt loven om forskning på befruktede egg hos mennesker.
Vitenskapsrådets retningslinjer er et supplement til gjeldende lovverk og skal legges til grunn for vurderinger som gjøres i de regionale etiske komiteer. Retningslinjene setter et klart forbud mot å utvikle humane embryoer utelukkende til forskningsformål. Forbudet inkluderer embryoer skapt ved somatisk kjerneoverføring, såkalt terapeutisk kloning. Forskning på befruktede egg som er til overs etter prøverørsbefruktning og som er høyst 14 dager gamle, kan tillates dersom det vurderes som helt nødvendig og det ikke finnes alternativer. I særlige tilfeller tillates også bruk av stamceller fra aborterte fostre før uke 14. Det åpnes for forskning på stamceller fra navlestrengsblod dersom foreldrene samtykker til det. Bruk av adulte stamceller vurderes på lik linje med vevsdonasjon og er uproblematisk.
I Norge er det forbud mot forskning på befruktede egg, menneskeembryoer og på stamceller fra befruktede egg, fordi slike cellelinjer kan importeres fra utlandet. Bioteknologiloven forbyr også terapeutisk kloning, mens forskning på adulte stamceller er fullt ut tillatt.
Stamceller – en kort ordliste
Stamceller
Umodne celler som gjennom deling kan gi opphav til nye umodne celler eller mer spesialiserte celler
Totipotente stamceller
Cellene som finnes i en blastocyst de første dagene etter at egget er befruktet, og som gir opphav til alle celletypene i kroppen. De danner fosterhinne, morkake og annet vev rundt fosteret.
Pluripotente stamceller
Celler som kan utvikle seg til alle celletyper, men ikke danne morkake og fosterhinne og annet vev utenfor fosteret.
Multipotente stamceller
Stamceller i det fødte individ, og som kan utvikle seg til andre og mer spesia-liserte celler.
Embryonale stamceller
Pluripotente stamceller i embryo og foster; omfatter også stamceller fremstilt fra kloningsembryoer gjennom terapeutisk kloning.
Adulte stamceller
Multipotente stamceller i det fødte individ. Navlestrengsblod inneholder også stamceller.
Et bioteknologisk satsingsfelt
Bioteknologisektoren har for alvor fått øynene opp for fremtidsmulighetene innen stamcelleforskning. På verdensbasis har et titall foretak vokst frem de siste årene. I Sverige er forholdene lagt til rette for at forskere kan involvere seg i industriell utvikling, ved at patentrettighetene til en oppdagelse tilfaller den enkelte forsker eller forskergruppe som står bak.
Forskerne Jonas Frisén og Ann Marie Jansson ved Karolinska Intitutet etablerte selskapet Neuro Nova i Stockholm i 1998. Neuro Nova arbeider med å fremstille vekst- og stimuleringsfaktorer for stamceller, men målet på sikt er å utvikle strategier for celleterapi for visse nevrogenerative lidelser. Neuro Nova har et kapitalgrunnlag på 30 millioner SEK, fremskaffet gjennom Investor Growth Capital, Health Cap og Sveriges sjette pensjonsforsikringsfond. Staben har et fåtall ansatte, men direktør Anders Hägerstrand forventer vekst når man om få år trolig går i gang med kliniske utprøvinger av transplantasjonsterapi for Parkinsons sykdom. Fremtidsmålet er å utvinne farmaka for å stimulere og utnytte adulte stamceller i medisinsk behandling.