Binyrebarkkarsinom er en sjelden, men høymalign lidelse med dårlig prognose. Årlig insidens er to tilfeller per million (1). Binyrebarkkarsinomer inndeles etter TNM-systemet og stadieinndeles etter MacFarlane (2) (tab 1). Binyrebarkkarsinomer er ofte over 10 cm i diameter og har metastasert når de oppdages. Halvparten av disse tumorene har endokrine manifestasjoner, slik som Cushings syndrom, virilisering, feminisering eller hyperaldosteronisme. Binyrebarkkarsinomer uten økt hormonproduksjon gir, pga. tumors størrelse, symptomer i lokalområdet som abdominal oppblåsthet, smerte, fordøyelsesvansker, kvalme og oppkast. Sykdommen opptrer i alle aldre, men har en overhyppighet hos barn under fem år og hos voksne i 40 – 50 års alder. Binyrebarkkarsinom ses noe hyppigere hos kvinner enn hos menn og opptrer oftere i venstre enn i høyre binyre (3).
|
Tabell 1 Stadieinndeling av binyrebarkkarsinomer (2)
|
|
Stadieinndeling
|
Kliniske funn
|
|
Stadium I
|
< 5 cm, uten lokal spredning, uten lymfeknuteaffeksjon, ingen fjernmetastaser
|
|
Stadium II
|
> 5 cm, uten lokal spredning, uten lymfeknuteaffeksjon, ingen fjernmetastaser
|
|
Stadium III
|
Med lokal spredning eller lymfeknuteaffeksjon
|
|
Stadium IV
|
Med enten lokal spredning og lymfeknuteaffeksjon eller fjernmetastaser
|
Radiologisk erkjennes diagnosen best ved CT eller MR. Man finner som oftest en stor, eventuelt forkalket tumor svarende til binyrens plass. Metastaser påvises samtidig med primærtumor i opptil 70 % av tilfellene (4). Hormonell utredning inkluderer minimum serummåling av DHEAS (dehydroepiandrosteron-sulfat), testosteron, androstendion, østradiol, aldosteron, renin, kortisol og ACTH, inkludert suppresjonstest med lavdose deksametason. Kortisolutskilling i døgnurin og katekolaminutskilling i døgnurin er obligatorisk. Måling av 17-OH-progesteron og 11-deoksykortisol anbefales også, da de kan brukes som tumormarkører ved kontroller.
De viktigste momentene i behandlingen er tidlig, ekstensiv kirurgisk intervensjon og eventuelt senere rereseksjoner. Adjuvant kjemoterapi må vurderes (5). Hos pasienter med hormonproduserende, ikke-resektabel tumor anses også kirurgiske inngrep som nødvendig, både for å redusere mengden hormonproduserende vev og for å oppnå maksimal effekt av adjuvant kjemoterapi (2). Selv ved radikal kirurgi er dødeligheten ca. 50 % (6).
Pasienten. 39 år gammel kvinne, tidligere stort sett frisk. Høsten 1999 fikk hun amenoré og økende hirsutisme, og det ble målt lett forhøyet testosteronnivå og betydelig forhøyet androstendionnivå (tab 2). (Androstendion er et steroid med svak androgen effekt som produseres hovedsakelig i binyrer, men også i testikler eller ovarier.) Etter hvert ble pasienten trett, fikk dårlig allmenntilstand og abdominale smerter. Ved første gangs konsultasjon, mai 2000, hadde pasienten et cushingoid utseende med sentral adipositas, en moderat hirsutisme og proksimal myopati. Differensialdiagnostisk tenkte man på androgenproduserende tumor i binyre eller ovarium med Cushings syndrom. Biokjemisk utredning verifiserte et Cushings syndrom utgått fra binyrer med opphevet døgnvariasjon av kortisol (525 nmol/l morgen og 592 nmol/l kveld), høy urin-kortisolutskilling og supprimert ACTH. Det var ingen kortisolsuppresjon av 1 mg deksametason gitt om kvelden. Pasienten hadde økt produksjon av flere binyrebarkhormoner med skyhøyt androstendionnivå og høye verdier av 17-OH-progesteron og 11-deoksykortisol (tab 2).
CT-abdomen viste en stor tumor, 12 – 13 cm i diameter i området for venstre binyre, mulig retroperitoneale lymfeknutemetastaser og to store metastaser med diameter 8 – 9 og 7 – 8 cm i henholdsvis høyre og venstre leverlapp (fig 1). Pasienten ble henvist til Radiumhospitalet som vurderte pasienten som inoperabel på grunn av store levermetastaser. Økende abdominalsmerter og vanskeliggjort matinntak gjorde at pasienten ble henvist til Rikshospitalet med tanke på palliativ kirurgi. Pasienten ble laparotomert, og man kunne påvise en stor binyretumor med flotterende tumormasser ned i nyrevenen og ut i v. cava. Tumormassene i venesystemet ble melket opp i en monstrøst forstørret binyrevene og hele tumor ble fjernet, dog med noe usikker radikalitet oppad og medialt. Ved operasjonen fant man levermetastaser forenlig med CT-funnet. Metastasen i venstre lapp (segment II og III) var velavgrenset og lå som et lodd over ventrikkelen. Denne ble resecert. Metastasen i høyre leverlapp affiserte alle segmentene (V, VI, VII og VIII), og man fant det uforsvarlig samtidig å resecere høyre leverlapp på grunn av lite gjenværende levervev (segment I og IV). Postoperativt kom pasienten seg bemerkelsesverdig fort, og hennes allmenntilstand bedret seg radikalt i forhold til tilstanden preoperativt. Hun ble overflyttet til sentralsykehuset tredje postoperative dag og ble utskrevet til hjemmet en uke senere. Det ble avtalt CT-kontroll tre måneder etter primæroperasjonen med tanke på eventuell reseksjon av den gjenværende levermetastasen. Postoperativt fikk hun et spontant fall i urin-kortisolutskilling per døgn fra 3 191 nmol/ 24 timer til 1 118 nmol/24 timer, og nivået av androgenmetabolitter (androstendion, DHEAS-sulfat og testosteron) ble halvert (tab 2).
I løpet av sommeren 2000 fikk hun adjuvant kjemoterapi med intravenøs streptozocin 9 g (en induksjonskur på 5 g og to kurer på 2 g) samt mitotan (Lysodren) tabletter 1 g fire ganger daglig. Etter evaluering av kjemoterapi ble streptozocinbehandlingen avsluttet da pasienten opplevde behandlingen som belastende på grunn av bivirkninger og det var vekst av metastase i høyre leverlapp. Imidlertid viste biokjemiske markører (tab 2) bedring etter tre måneders behandling slik at vi valgte å fortsette mitotanbehandlingen som adjuvant behandling, men i lavere dose, 0,5 g x 2.
CT-kontroll september 2000 viste ikke tegn til lokalt residiv i buken. Venstre leverlapp hadde regenerert, men gjenværende metastase i høyre leverlapp hadde vokst til en diameter på 12 – 13 cm. Metastasen hadde nær relasjon til høyre portastamme (fig 2). Fordi restleveren venstre side hadde regenerert, fant man det nå riktig å utføre en høyresidig leverreseksjon. Leveren var svært skjør og lettblødende, sannsynligvis på grunn av preoperativ cytostatikabehandling og langvarig steroidpåvirkning. Hun fikk i alt 22 enheter SAG-blod under operasjonen. For øvrig var inngrepet ukomplisert. Etter denne operasjonen var pasienten makroskopisk fri for tumorvev. Hun var postoperativt betydelig slapp og trett den første uken, men kom seg deretter raskt. Hennes hormonverdier normaliserte seg, og hun fikk igjen menstruasjonen. Pasienten har fått kortisonmedikasjon etter den siste operasjonen da mitotan hemmer egenproduksjonen av binyrebarkhormoner.
CT-kontroll september 2001, ett år etter siste inngrep, viste regenerert lever uten tegn til residiv (fig 3). To år etter første operasjon var pasienten klinisk frisk med normal hormonstatus, og hennes Cushings-stigmata hadde gått betydelig tilbake og hun var i arbeid.
Ved rutinekontroll 27 måneder etter primæroperasjonen ble det påvist en 12 mm stor residivtumor sentralt i leveren, i nær relasjon til gjenværende levervene. I tillegg fant man to små metastasesuspekte forandringer i lunger og osteolytisk prosess i tuber os ischii venstre side. Pasienten fikk strålebehandling 3 Gy x 10 mot hoften for å forebygge patologisk fraktur. Mitotandosen som hele tiden har vært lav av hensyn til bivirkninger, ble økt fra 1 g til 5 g for å være i anbefalt terapeutisk plasmanivå (44 – 62 mol/l) (7, 8). Nå opprettholdes terapeutisk nivå med 2 g mitotan daglig. Pasienten ble vurdert med tanke på å fjerne levermetastasen kirurgisk, eventuelt med RF-ablasjon (radio frequency ablation) eller kryobehandling. Dette ble imidlertid oppfattet som for risikofylt for pasienten på grunn av tidligere leverreseksjoner og den nære relasjonen til gjenværende levervene. På ett år vokste den solitære levermetastasen fra 1,2 cm til 9,5 cm i største diameter. Det ble besluttet å gi strålebehandling mot levermetastasen 3 Gy x 10 som livsforlengende palliasjon høsten 2003. Strålefeltet innbefattet ca. 75 % av gjenværende lever og førte til en viss reduksjon av tumorstørrelse, normalisering av leverenzymverdier og LDH-nivå og fall i hormonverdier (tab 2). Lunge- og skjelettmetastasene har vært stasjonære. 33 måneder etter første operasjon fikk pasienten igjen verdistigning av enkelte binyrebarkhormoner ( tab 2).
Status fire år etter primæroperasjonen er at pasienten er i god allmenntilstand, med normal leverfunksjon. Hun har ikke fått residiv av Cushings syndrom og er delvis i arbeid.
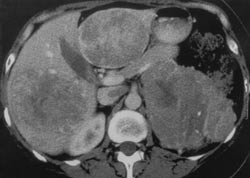
Figur 1 CT-bildet viser primærtumor i venstre binyre og to store metastaser i henholdsvis høyre og venstre leverlapp

Figur 2 CT-bildet av status tre måneder etter primæroperasjonen. Det er ikke tegn til lokalt residiv i abdomen. Venstre leverlapp har regenerert. Metastasen i høyre leverlapp har vokst

Figur 3 CT-bildet viser regenerert lever uten tegn til residiv 12 måneder etter siste operasjon
|
Tabell 2 Hormonverdier hos pasienten
|
|
3.5. 2000
|
30.5. 2000
|
23.8. 2000
|
15.9. 2000
|
4.10. 2000
|
Desember 2002
|
Oktober 2003
|
Mai 2004
|
|
Hormonverdier
|
Ved diagnose
|
1 uke postoperativt
|
3 md. postoperativt
|
4 md.¹ postoperativt
|
2 uker etter andre operasjon
|
|
Start strålebehandling av lever
|
|
|
Urin-kortisol (45 – 272 nmol/24 t)
|
3 191
|
1 118
|
1 781
|
185
|
72
|
255²
|
Ikke utført
|
38
|
|
S-androstendion (< 6,6 nmol/l)
|
95
|
40
|
42
|
13
|
< 1,1
|
2,0
|
Ikke utført
|
8,3
|
|
S-17-OH-progesteron (< 6 nmol/l)
|
116
|
36
|
84
|
18
|
0,9
|
2,7
|
29
|
9,6
|
|
S-DHEAS (0,8 – 10 µmol/l)
|
26
|
Ikke utført
|
5,7
|
5,7
|
< 0,8
|
< 0,8
|
2,2
|
< 0,4
|
|
S-11-deoksykortisol (<10 nmol/l)
|
379
|
Ikke utført
|
557
|
138
|
7,3
|
< 7,2
|
238,5
|
120,5
|
|
S-testosteron (< 2,8 nmol/l)
|
10 – 3,0³
|
Ikke utført
|
6,3³
|
< 1,0
|
< 0,5
|
< 1,0
|
3,0
|
< 1,0
|
|
LDH (150 – 450 U/l)
|
Ikke utført
|
1 165
|
804
|
667
|
576
|
45
|
652
|
188
|
|
[i]
|
Diskusjon
Binyrebarkkarsinom er en sjelden, men alvorlig kreftform med dårlig prognose. Årsaken er ukjent, men det antas at svulsten utvikler seg fra en hyperplastisk kjertel til adenom og senere til karsinom. Denne teori støttes av at en del pasienter har unormal binyrebarkproduksjon i mange år før kreftutviklingen (9). Den refererte pasienten hadde gjennom noen år hatt antydning til hirsutisme og uregelmessig menstruasjon.
Leveutsiktene vurdert ut fra metaanalyse av fem studier viser at tumorstørrelse og spredning på diagnosetidspunktet samt radikalitet ved primæroperasjonen er de viktigste parametere for prognosen (6, 7, 10 – 12).
Adjuvant behandling og behandling mot manifeste metastaser med mitotan er omdiskutert, men har vist objektive respons hos ca. 20 % og hemming av hormonal hypersekresjon hos 75 % av pasientene (13 – 16). Vellykket behandling med mitotan av en pasient med binyrebarkkarsinom og metastaser ble første gang beskrevet for mer enn 40 år siden (17). Mitotan (o,p’-DDD) er en kjemisk slektning av insekticidet DDT. Det har en adrenolytisk effekt på binyrebarken. Mitotan blir gitt som tabletter (Lysodren) eller som kapsler. Medikamentmonitorering er viktig og utføres ved sentrallaboratoriet, Radiumhospitalet ved en egenutviklet metode (8). Det er funnet at medikamentnivå > 14 mg/l er nødvendig for å oppnå tumorregresjon (7). Pasienten får ofte bivirkninger som er doseavhengige: gastrointestinale (diaré, kvalme, anoreksi) og cerebrale (apati, somnolens, svimmelhet, forvirring). Ved langvarig bruk viser serummålinger at det er nødvendig med dosereduksjoner.
Streptozocin er et alkylerende stoff som blir brukt ved gastrointestinale endokrine tumorer. Det er publisert positiv effekt i kombinasjon med mitotan ved binyrebarkkarsinom. Kolleger i Uppsala har brukt streptomycin mot binyrebarkkarsinom siden 1987 med godt resultat; komplett eller partiell respons ble oppnådd hos 36,4 % av pasientene (18). Derfor valgte vi å prøve kombinasjonen mitotan/streptozocin etter protokoll fra Uppsala og i tråd med anbefalinger i norske retningslinjer (16). Annen kjemoterapi har varierende og dårlig dokumentert effekt, og man mangler prospektive randomiserte studier for å verifisere en positiv effekt av mitotan, streptozocin og andre kjemoterapeutika.
Palliativ stråleterapi har vist effekt hos enkelte pasienter ved metastatisk sykdom (19) og brukes ved skjelettmetastaser. Vår pasient har hatt god nytte av strålebehandling mot lever i form av tumorregresjon og normalisering av verdiene for leverenzymer, LDH og binyrebarkhormoner. Hennes metastaser til bekkenskjelettet har ikke vist tegn til vekst etter strålebehandling mot denne regionen.
Primærbehandlingen ved binyrebarkkarsinom, med eller uten metastaser, er operasjon og eventuelt adjuvant kjemoterapi. Selv ved tumortrombosering i tilstøtende venesystem og perifere metastaser er det vesentlig å tilstrebe tumorreduksjon, noe som vil redusere eventuell hormonproduksjon og bedre responsen av adjuvant kjemoterapi (20). Selv ved tilsynelatende radikal reseksjon av tumor er residivfrekvensen stor. Rereseksjoner eventuelt repeterte rereseksjoner er indisert da det foreligger dokumentasjon for at overlevelsen øker hvis metastasene kan fjernes i sin helhet (5). Den aktuelle pasienten hadde to store levermetastaser på diagnosetidspunktet (stadium IV). Ifølge tilgjengelig litteratur ville hennes leveutsikter uten operasjon vært svært dårlige. I tillegg var hennes livskvalitet meget dårlig. Preoperativt var pasienten nærmest sengeliggende og hadde vanskelig for å få i seg næring. Fjerning av hennes primærtumor og levermetastasene gjorde at hun kunne være oppe og fikk en betydelig bedret livssituasjon.
Vi mener at ekstensiv tumorkirurgi, eventuelt repeterte kirurgiske inngrep, bør vurderes og tilbys pasienter med binyrebarkkarsinom der dette er teknisk mulig, eventuelt med påfølgende adjuvant kjemoterapi.