Lokalt residiv uten samtidige fjernmetastaser forekommer hos 3 – 12 % av dem som er operert for coloncancer (1 – 3). Mens radioterapi inngår som en viktig del både av helbredende og lindrende behandling ved bekkenresidiv, vil det sjelden være aktuelt å gi bestråling ved abdominale residiver på grunn av risikoen for betydelige skader på tarmen.
Pasienten. En tidligere frisk kvinne ble som 68-åring operert for cancer coeci med perforasjon. Det forelå en perikolisk abscess, og det ble gjort høyresidig hemikolektomi med reseksjon av fremre bukvegg. Inngrepet ble ansett som radikalt. I operasjonspreparatet fant man spredning til regionale lymfeknuter (Dukes C), og hun fikk derfor adjuvant kjemoterapi med 5-fluorouracil/leukovorin i seks måneder. Ett år senere utviklet hun sterke smerter i høyre flanke med utstråling til høyre lår, og ved CT ble det påvist en 12 cm stor tumor som infiltrerte m. iliopsoas dexter, oppfattet som et lokoregionalt residiv (fig 1). Det var ingen fjernmetastaser. Residivet ble resecert i muskulatur ved laparotomi, men tumorvev måtte etterlates omkring iliacakarene. Svulsten omsluttet n. femoralis, som måtte deles. Tumorsengen ble markert med metallklyper, og en brystprotese i silikon ble lagt på reseksjonsflaten for å skyve tynntarmen vekk fra det påtenkte strålefeltet (fig 2). Postoperativ CT viste likevel en interponert tarmslynge mellom protesen og fremre bukvegg (fig 3). Seks uker etter inngrepet ble det påbegynt radiokjemoterapi med 2 Gy x 25 som to motgående skråfelt og strålesensibiliserende 5-fluorouracil/leukovorin (fig 3). Under bestrålingen utviklet kvinnen høyresidig bekkenvenetrombose, og hun fikk antikoagulasjonsbehandling. Radioterapien var ledsaget av periodevise buksmerter, men uten diaré eller andre tegn til akutt stråleenteritt. Åtte uker etter endt bestråling ble hun igjen laparotomert. Den nevnte tarmslyngen frembød da ganske uttalte stråleskader. Protesen lot seg fjerne, i hovedsak ved stump disseksjon (fig 4). Pasienten ble likevel påført en ureterskade, som kunne repareres umiddelbart. Det var ingen gjenværende tumor, verken makro- eller mikroskopisk.
Pasienten har siden vært fulgt poliklinisk med regelmessige CT-undersøkelser. Hun har høyresidig quadricepsparalyse etter nevrotomi av n. femoralis. Hun har fått tilpasset kneortose og er avhengig av krykker ved gange på ujevnt underlag. Hun har hatt forbigående bevegelses- og belastningsrelaterte smerter i det bestrålte området. Fordøyelsen fungerer normalt. Hun er i god allmenntilstand. Halvannet år etter avsluttet stråleterapi er det ikke påvist nytt residiv.
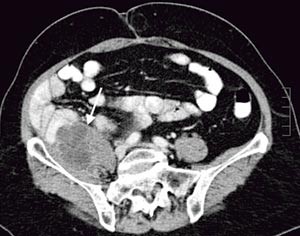
Figur 1 Infiltrerende residiv i m. iliopsoas dexter
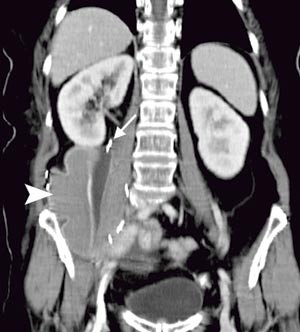
Figur 2 Tumorsengen markert med metallklyper (pil) etter reseksjon. Implantert silikonprotese (pilhode)
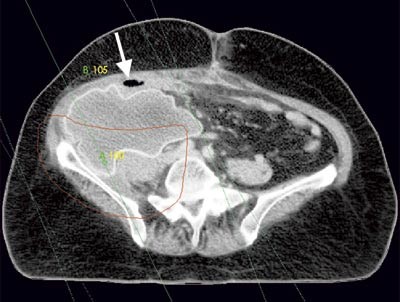
Figur 3 Implantert protese etter reseksjon av tumor. Markerte strålefelter (grønne linjer) og målvolum (rød linje). Interponert tarm (pil) ses mellom protesen og fremre bukvegg
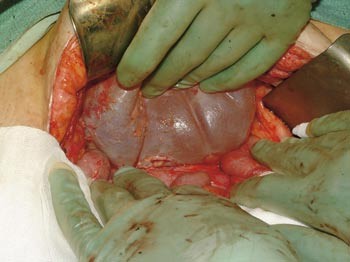
Figur 4 Protesen fjernes etter bestråling
Diskusjon
Lokale og lokoregionale residiver av kolorektalcancer vil i de fleste tilfeller skyldes peroperativ utsæd eller at man ved operasjonen har etterlatt metastatiske lymfeknuter eller svulstvev. Den moderne operasjonsteknikken ved rectumcancer, der man omhyggelig fjerner rectum og mesorectum med tumor og lymfebaner, har ført til betydelig reduksjon i forekomsten av lokale bekkenresidiver (4). Dette er i prinsippet samme teknikk som i lang tid har vært anvendt ved coloncancer, der krøset med dets blodkar og lymfebaner reseceres sammen med det svulstbærende tarmsegmentet. Ved coloncancer har således lokale og lokoregionale residiver vært et begrenset problem i forhold til fjernmetastasene, som opptrer hos 20 – 25 % av dem som opereres i helbredende hensikt (3). Noen vil likevel få et lokalt residiv (1 – 3). I motsetning til ved lokale residiver av rectumcancer, som ofte kan radikalopereres etter bestråling med håp om langtidsoverlevelse (5), vil det ved lokalt residiv av coloncancer sjelden ligge til rette for helbredende kirurgi. Tumor vil ofte ha vokst inn i vitale strukturer på bakre bukvegg eller i naboorganer. Preoperativ tumorreduserende strålebehandling vil i de fleste tilfeller være vanskelig å gjennomføre på grunn av skadene som påføres tilliggende organer, som lever og nyrer ved doser over 20 Gy og ventrikkel og tynntarm ved doser over 45 til 50 Gy. Ikke-radikale svulstreduserende inngrep («debulking») gir ingen overlevelsesgevinst ved kolorektalcancer (6), men kirurgiske eller endoskopiske prosedyrer vil kunne være indisert i lindrende hensikt, som for eksempel ved obstruksjon av gastrointestinaltractus, urin- eller galleveier. Prognosen er da dårlig, med en femårsoverlevelse på omkring 5 % (1).
På denne bakgrunn er det innen kolorektal cancerkirurgi skapt et skarpt skille mellom helbredende og lindrende behandling. Blir sykdommen vurdert som potensielt kurabel, vil man kunne overveie ekstensive inngrep. På den annen side, dersom pasientens sykdom vurderes til å være i palliativ fase, vil behandlingen ofte begrense seg til medikamentell smertelindring, eventuelt supplert med lindrende kjemo- eller radioterapi. I dette skjebnesvangre skillet ligger det en fare for at man uriktig avstår fra operativ behandling, idet et residiv per seoppfattes som uttrykk for en uhelbredelig tilstand. Det er imidlertid ikke alltid lett å avgjøre om et inngrep utføres i helbredende eller lindrende hensikt. Selv etter radikale reseksjoner vil risikoen for tilbakefall ofte være svært stor, og indikasjonsstillingen må basere seg på en vurdering der både kortsiktige og langsiktige gevinster veies mot sekveler og potensielle komplikasjoner (7).
Operasjonsindikasjonen for vår pasient var smerter, og siktemålet var radikal fjerning av residivet, med tanke på både optimal palliasjon og mulig helbredelse. Da vi måtte etterlate svulstvev omkring iliacakarene, var det klart at håpet om kurasjon var betydelig redusert. Postoperativ bestråling ville likevel kunne utsette tiden til residiv, og det ble derfor gitt 50 Gy som to motgående skråfelt. Denne dosen kan synes lav – for å sanere makroskopisk tumorvev anses vanligvis doser under 60 Gy som utilstrekkelige, men med tarm i strålefeltet ble en så høy dose vurdert som risikabel. Et alternativ ville vært å gi tilleggsdoser konsentrert mot det etterlatte svulstvevet («boost»), men markeringen måtte da vært bedre enn tilfellet var. Intensitetsmodulert radioterapi (IMRT) vil snart være et tilbud ved norske stråleenheter. Ved slik behandling vil man i større grad enn ved tradisjonell doseplanlegging bli i stand til å begrense den høye bestrålingen til det tilsiktede målvolumet. Men behandlingen er ressurskrevende, og om pasienter av vår kategori vil kunne bli prioritert, gjenstår å se.
Vi valgte å gi postoperativ bestråling. Hvorvidt man ved lokoregionale residiver av coloncancer heller bør gi preoperativ bestråling, er uavklart – både pre-, intra- og postoperativ bestråling anvendes (6, 8). Ved rectumcancer er bestråling preoperativt å foretrekke (9), og man kan tenke seg en strategi ved residiv i abdomen der protesen implanteres mellom tumor og tarm før preoperativ bestråling, slik enkelte har praktisert ved bekkensvulster. Hos vår pasient var imidlertid tumor så stor at protesen neppe ville gitt tilstrekkelig skjerming.
Vår pasient fikk strålesensibiliserende kjemoterapi i form av fluorouracil/leukovorin, som lenge har vært standard ved postoperativ bestråling. Stråleeffekten økes på denne måten med omkring 10 %. Som lindrende behandling ved utbredt sykdom er det dokumentert bedre effekt av oxaliplatin- og irinotecanbaserte regimer (10, 11). Oxaliplatin er nå også innført som adjuvant behandling i Norge ved coloncancer hos personer under 65 år, og er under utprøvning som adjuvans ved preoperativ radioterapi av rectumcancer (12).
Implantasjon av brystproteser for å deplassere tynntarm har tidligere vært anvendt før bekkenbestråling (13, 14); ved abdominal bestråling er det kun rapportert brukt enkelte ganger (15). Mens migrasjon av protesen ikke utgjør noen stor risiko i bekkenet, er faren for dette større i abdomen. Av frykt for silikonlekkasje unnlot vi å fiksere protesen med suturer, og det viste seg at postoperative adheranser stabiliserte den uten forlenget sengeleie. En sikrere løsning kan være å pakke protesen inn i et resorberbart nett, som så sutureres til nabostrukturer (14). Det anbefales postoperativ kontrastundersøkelse for å kontrollere at tarm ikke interponeres i strålefeltet mellom protesen og tumorsengen eller i strålefeltet mellom protesen og bekken- eller bukveggen (13 – 15). Dette skjedde hos vår pasient, og, som vi kunne konstatere ved relaparotomien, var et tarmsegment blitt stråleskadet. Det er beskrevet flere teknikker for å forhindre dette, både transposisjon av omentum majus og innsying av resorberbare nett (13 – 15). Enkelte forfattere anbefaler saltvannsproteser i stedet for silikonproteser (14, 15). Fra et strålefysisk synspunkt er saltvannsproteser kanskje bedre egnet (16). Viktigere er det nok at en slik protese kan fylles i varierende grad slik at størrelsen kan tilpasses, og sist, men ikke minst, at en saltvannsprotese ikke nødvendigvis må fjernes – den kan aspireres perkutant etter endt strålebehandling slik at relaparotomi unngås (14). Fra mammakirurgien er det kjent at implanterte proteser kan være vanskelige å ekstirpere, og selv om implantatet i vårt tilfelle i hovedsak lot seg dissekere ut stumpt, ble pasienten påført en ureterskade under uthentingen. Under strålebehandlingen fikk hun bekkenvenetrombose, sannsynligvis betinget i en kombinasjonen av mekanisk kompresjon fra protesen og bestråling. Dette kunne vært forutsett, og pasienten burde fått tromboseprofylakse.
Konklusjon
Ved lokoregionalt residiv av coloncancer vil forholdene som regel ikke ligge til rette for radikal kirurgisk behandling, og lindrende tiltak, enten medisinske eller kirurgiske, vil være avhengig av symptomene. Enkelte ganger kan reseksjon av tumor likevel være aktuelt, og prognosen kan da bedres med pre- eller postoperativ stråleterapi. Implantasjon av en skjermende protese for beskyttelse av tarmen vil kunne gjøre denne behandlingen tryggere og mer effektiv.