Det er over 20 000 pasienter med type 1-diabetes i Norge (1). Alle disse har manglende egenproduksjon av insulin og må behandles med insulininjeksjoner. Behandlingen skal hindre ukontrollert blodsukkerstigning med utvikling av ketoacidose, fjerne symptomer på hyperglykemi og redusere risikoen for utvikling av diabetiske senkomplikasjoner (2, 3). Det er de siste årene kommet mange nye insulinpreparater og forbedrede tekniske hjelpemidler til å justere behandlingen.
Prinsipper og preparater
Insulinbehandling ved type 1-diabetes er substitusjonsbehandling, og den tar sikte på å gjenopprette en normal fysiologisk funksjon som er tapt (4). Behandlingen skal erstatte manglende basal insulinproduksjon og bortfall av de normale sekresjonstoppene ved måltid. Normalt stiger insulinnivået i plasma svært raskt etter et måltid, for så å falle tilbake til basalnivået igjen (fig 1).
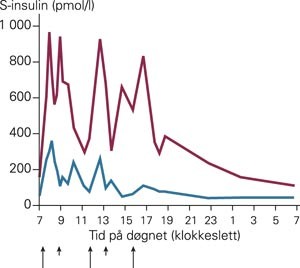
Insulinkonsentrasjon i serum gjennom døgnet hos to friske personer. Lange piler = tidspunkt for tre hovedmåltider. Korte piler = tidspunkt for to mellommåltider. Figuren illustrerer stor forskjell i nivåene hos friske personer avhengig av insulinfølsomhet
På markedet finnes en rekke insulintyper med ulike farmakokinetiske egenskaper (tab 1, fig 2). Alle registrerte insulinpreparater er fremstilt bioteknologisk og har samme konsentrasjon (100 IE/ml), men andre formuleringer (avvikende konsentrasjoner, svineinsulin) kan skaffes på registreringsfritak. I tillegg til regulært humant insulin finnes modifiserte insulintyper med ulike farmakokinetiske egenskaper, som er oppnådd enten ved tilsetninger til løsningsmidlet eller ved endringer av insulinmolekylet (5).
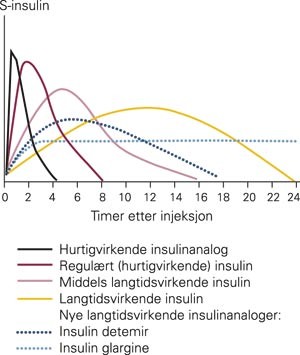
Gjennomsnittlig insulinkonsentrasjonen i serum etter injeksjon av ulike insulinpreparater fremstilt skjematisk
|
Tabell 1 Insulintyper på markedet i Norge (juni 2005).
|
|
Type insulin
|
Handelsnavn
|
Innsettende effekt
|
Maksimal effekt (timer)
|
Virkningsvarighet (timer)
|
|
Hurtigvirkende insulinanalog
|
NovoRapid
Humalog
|
10 – 20 min
|
–2
|
3 – 5
|
|
|
|
|
|
|
Hurtigvirkende humant insulin
|
Actrapid
Insuman Rapid
Humulin Regular
|
time
|
1 – 3
|
7 – 9
|
|
|
|
|
|
|
Middels langtidsvirkende insulin (NPH)
|
Insulatard
Insuman Basal
Humulin NPH
|
1 time
|
4 – 12
|
12 – 20
|
|
|
|
|
|
|
Langtidsvirkende insulin
|
Ultratard
|
4 timer
|
8 – 24
|
24 – 28
|
|
|
|
|
|
|
Langtidsvirkende insulinanalog
|
Lantus
Levemir
|
Ikke angitt
|
Ikke angitt
3 – 14
|
Inntil 24
Inntil 24
|
|
|
|
|
|
|
Blandinger av hurtigvirkende og middels langtidsvirkende humant insulin
|
Mixtard 10/90, 20/80, 30/70, 40/60, 50/50
Insuman Comb 25
|
time
|
2 – 8
|
Inntil 20
|
|
|
|
|
|
|
Blanding av hurtigvirkende og middels langtidsvirkende insulinanalog
|
NovoMix 30
Humalog Mix 25
|
10 – 20 min
|
1 – 4
|
Inntil 20
|
Etter subkutan injeksjon av regulær (hurtigvirkende) insulin oppnås vanligvis maksimal plasmakonsentrasjon etter 60 – 90 minutter og ca. 30 minutter tidligere ved bruk av hurtigvirkende insulinanalog, som ikke danner aggregater subkutant slik regulær insulin gjør. Etter injeksjon av middels langtidsvirkende insulin (NPH-insulin), øker plasmakonsentrasjonen gradvis over 4 – 6 timer, for deretter å avta igjen over 6 – 12 timer. De nye langtidsvirkende insulinanalogene (glargine og detemir) har enda langsommere innsettende virkning og flatere virkningsprofil. Hurtigvirkende og middels langtidsvirkende insulin kan blandes i sprøyte før injeksjon og foreligger også i ferdige blandinger i insulinpenn (blandingsinsulin, premiks). Insulinanalogene kan ikke blandes, men det foreligger ferdigblandede løsninger av både insulin lispro og insulin aspart med middels langtidsvirkende insulinanalog.
Den blodsukkersenkende virkningen av en fast insulindose varierer mye fra injeksjon til injeksjon hos det enkelte individ. Dette er en av de vanskeligste og mest uforutsigbare faktorene ved insulinbehandling. Absorpsjonsstudier indikerer en variasjonskoeffisient for blodsukkersenkende effekt på minst 20 – 30 % for hurtigvirkende insulin og minst 50 % for NPH-insulin. Dag-til-dag-variasjon i virkningen er kanskje litt mindre for insulinanalogene. Absorpsjonshastigheten varier noe mellom ulike regioner; den er raskest fra øvre del av abdomen, langsommere fra nedre del av abdomen og enda langsommere fra armen og låret. Andre faktorer som påvirker absorpsjonshastigheten, er injeksjonsteknikk, temperatur og fysisk aktivitet.
Insulin som ikke er i bruk, skal oppbevares i kjøleskap (2 – 8 °C). Ampullen eller pennen som er i bruk, oppbevares ved romtemperatur (< 25 °C ) for å redusere lokalirritasjon som kan forekomme ved injeksjon av avkjølt preparat, og for å unngå temperatursvingninger som kan gi danning av luftbobler. Tilstrekkelig blanding av NPH-insulin og ferdigblandet insulin før injeksjon er avgjørende for å oppnå reproduserbar effekt, ettersom dette insulinet foreligger i suspensjon og ikke i løsning. Blanding oppnås best med en kombinasjon av rulling og vending av sprøyte eller penn: Risting bør unngås. Hurtigvirkende insulin og langtidsvirkende insulinanaloger er klare løsninger og trenger ikke blandes.
Injeksjonsnålene som brukes er 5 – 12 mm lange og ser ut til å gi samme insulinprofil i serum når injeksjonen settes subkutant. Hos pasienter som har lite subkutant fettvev, kan de lange nålene medføre intramuskulær injeksjon, noe som innebærer raskere absorpsjon og kraftigere effekt. Nålene er i utgangspunktet engangsutstyr, men nåler som brukes til hurtigvirkende insulin og insulinanaloger, kan brukes om igjen. Nålene skal skiftes etter hver injeksjon av NPH-insulin pga. tendens til utfelling og gjenplugging. Verken penner eller nåler skal selvsagt brukes til flere pasienter, fordi cellulært materiale kan transporteres inn i insulinampullen ved injeksjon og utgjøre en potensiell smitterisiko.
Insulinfølsomme vev trenger insulin hele døgnet. Behovet varierer, først og fremst i forhold til matinntak og fysisk aktivitet. I tillegg opplever mange at psykiske faktorer og stress påvirker blodsukkernivået direkte. Det betyr at insulinbehandlingen må tilpasses dagens gjøremål og ofte varieres fra dag til dag. For å erstatte både basalinsulin og måltidsinsulin brukes oftest hurtigvirkende insulin eller insulinanalog til hvert hovedmåltid og middels langtidsvirkende insulin eller langtidsvirkende insulinanalog for å dekke basalbehovet (basalbolusregime). Slike regimer reduserer antall insulinfølinger og bedrer langtidsreguleringen av blodsukkernivået i forhold til eninjeksjons- og toinjeksjonsregimer (6). Noen ganger kan man likevel komme til målet med enkle insulinregimer, fordi pasienten har en restproduksjon av insulin, eller fordi han eller hun lever regelmessig og tar hensyn i forhold til kost og aktivitet slik at blodsukkernivået reguleres tilfredsstillende.
Praktisk gjennomføring
I forbindelse med oppstart av insulinbehandling bør pasienten lære egenmåling av blodsukkernivået. Det bør avtales hvordan pasienten skal benytte egenmålingene tilpasset det insulinregimet vedkommende skal bruke. Man bør bruke mye tid på å informere, både muntlig og skriftlig, om hvorfor insulinbehandling er nødvendig og hvordan behandlingen gjennomføres. Spesielt er det viktig å legge vekt på behandlingens dynamiske natur, at startdosen må modifiseres etter hvert som den enkelte pasient vinner erfaring, og at dette er en livslang prosess. Når behandlingen er igangsatt, er målet for de fleste pasientene at de selv skal være i stand til å endre dosene etter behov. Det vil særlig gjelde for måltidsinsulinet (bolusdosene).
Insulin administreres med engangssprøyte, insulinpenn eller insulinpumpe. De fleste pasientene velger i dag å bruke ferdigfylte insulinpenner eller flergangspenner. Noen pasienter behandles med insulinpumpe, men slik behandling bør nok reserveres for pasienter med spesielle behov og er en spesialistoppgave som ikke vil bli nærmere omtalt her. Indikasjon for bruk av insulinpumpe er sterkt svingende blodsukkernivå med hyppige insulinfølinger, særlig om natten. Det er en tendens til økende bruk av pumpebehandling, og metaanalyser indikerer at insulinpumpebehandling kan gi bedring av blodsukkerkontrollen sammenliknet med andre regimer (7).
Etter start av insulinbehandling ved nyoppdaget type 1-diabetes vil man ofte oppleve et synkende insulinbehov, og noen ganger kan insulin seponeres helt for en kortere periode. Denne første perioden skyldes at betacellenes restproduksjon av insulin tar seg opp igjen når det høye blodsukkernivåets negative effekt på insulinproduksjon og insulinvirkning forsvinner, og kan vare fra uker til måneder. God informasjon til pasienten om fenomenet og opplæring til pasientovervåking med egenmåling av blodsukkernivå hindrer ubehagelig og alvorlig blodsukkerstigning når egenproduksjonen reduseres ytterligere.
De fleste vil i dag starte behandlingen med et basalbolusregime etter det fysiologiske prinsippet som er omtalt over. Imidlertid kan en del pasienter greie seg godt med 1 – 2 injeksjoner av middels langtidsvirkende insulin eller langtidsvirkende insulinanalog i denne perioden, fordi de fortsatt har egen produksjon som kan ta seg av insulinbehovet ved måltid. Man kan også starte direkte med insulinpumpebehandling, og dette er blitt vanlig ved flere barneavdelinger.
Den nødvendige døgndose av insulin varierer betydelig, men vil vanligvis ligge omkring 0,5 – 1,0 IE per kg kroppsvekt, mens startdosen gjerne vil være 0,2 – 0,4 IE per kg. Ved et vanlig basalbolusregime gis vanligvis en tredel av døgndosen som basalinsulin ved sengetid og resten som måltidsinsulin. Måltidsinsulinet fordeles på 3 – 5 måltider avhengig av pasientens preferanser og levesett. Dersom hurtigvirkende insulinanalog brukes som måltidsinsulin, kan dosen settes når måltidet begynner. Virketiden er så kort at hvis det går mer enn tre timer mellom injeksjonene av måltidsinsulin, trenger man ofte å sette en liten del av basalinsulinet (for eksempel en firedel) om morgenen for at pasienten ikke skal «gå tom» for insulin. Hurtigvirkende humant insulin settes 20 – 30 minutter før måltidsstart og varer så lenge at det oftest er tilstrekkelig til å dekke insulinbehovet mellom måltidene.
Bivirkninger
Hypoglykemi er den vanligste og mest fryktede komplikasjon til insulinbehandling. Hyppigheten varierer betydelig mellom pasienter, men pasienter med type 1-diabetes må regne med å oppleve lette insulinfølinger (hypoglykemiepisoder som de selv kan håndtere) flere ganger ukentlig. Alvorlige følinger og insulinsjokk (hypoglykemi med bevissthetstap og behov for hjelp av andre) er for de fleste pasienter sjeldent, men ble rapportert av hele 26 % av pasientene som ble behandlet i intensivguppen i DCCT-studien. Gjennomsnittlig prevalens i denne gruppen var 1,9 episoder per pasient per år, og nesten halvparten av episodene inntraff om natten (8). Alle pasienter skal opplæres i symptomer på hypoglykemi. Mange synes det er en fordel bevisst å utløse en føling under kontrollerte betingelser tidlig etter oppstart av insulinbehandling. Det kan redusere frykten som mange føler når de selv skal ha hovedansvaret for behandlingen hjemme. Insulinbehandlede pasienter med type 1-diabetes bør bære med seg minst 15 g druesukker, sukkerbiter eller andre hurtigvirkende karbohydrater til bruk ved uforutsette følinger. Mange vil også ha nytte av å ha et par sett med glukagon og injeksjonsutstyr tilgjengelig, som brukes av pårørende til intramuskulær injeksjon for å bringe pasienten ut av en situasjon med alvorlig føling når det tar for lang tid å få medisinsk hjelp.
Etter noen år med sykdommen opplever noen pasienter å miste evnen til å kjenne insulinfølinger. Dette kan være svært dramatisk, fordi pasienten ikke får de vanlige adrenerge varselsymptomene på lavt blodsukkernivå, men direkte endringer i bevissthetsnivået og eventuelt insulinsjokk uten forvarsel. De siste års forskning har vist at mange pasienter kan få tilbake følingssymptomene ved å unngå hyppige hypoglykemier. Det gjøres best ved god pasientopplæring, bruk av mest mulig fysiologiske behandlingsregimer (ev. insulinpumpe) og ev. ved å legge målet for gjennomsnittlig blodsukkernivå noe høyere en periode.
Vektøkning følger ofte etter oppstart av insulinbehandling. Mesteparten av den initiale vektøkningen skyldes at pasienten før behandlingsstart har vært i en katabol situasjon med glukosuri og ofte betydelig vekttap. Imidlertid kan vekten fortsette å øke i en del tilfeller, enten på grunn av hyppige insulinfølinger med overspising eller direkte som følge av insulinets anabole virkning. I DCCT-studien økte vekten 4,75 kg mer i intensivbehandlet gruppe enn i en gruppe med konvensjonell behandling, og personene med sterkest vektøkning hadde en uheldig utvikling av lipidprofil og blodtrykk.
En del pasienter med type 1-diabetes kan bruke mangelfull insulinbehandling bevisst som «slankemetode». Det gjelder særlig unge kvinner. Fenomenet, som kalles insulinspyling (insulin purging), må oppfattes som en form for spiseforstyrrelse. Helsepersonell som behandler denne pasientgruppen, må være spesielt oppmerksomme på fenomenet hos pasienter som har en tendens til å være undervektige, eller som har uforklarlig dårligere blodsukkerkontroll.
Behandlingsmål
Det bør settes individuelle behandlingsmål i samråd med pasienten. Målene vil variere om man bare vil fjerne symptomer på hyperglykemi eller om det også er viktig å forebygge utvikling av diabetiske senkomplikasjoner. Behandlingsmålene bør omfatte veiledende verdier for blodsukker før og 1,5 – 2 timer etter måltid, antall følinger som er akseptabelt og et nivå for glykosylert hemoglobin (Hb A1c). Ulike internasjonale organer angir litt ulike mål for god kontroll, og kravene skjerpes stadig. Man må imidlertid være klar over at det er en kontinuerlig sammenheng mellom risiko for senkomplikasjoner og grad av blodsukkerkontroll. Det er viktigere med individuelle mål som justeres underveis enn ideelle mål som er uoppnåelige for mange.
Vanskelig regulerbar diabetes
Ved vurdering av pasienter som har uforklarlig høy Hb A1c eller svært svingende blodsukkerverdier, er det nyttig å la pasientene ta en uke med intensiv blodsukkermåling før og to timer etter alle måltider, ved sengetid og kl 3 – 4 om natten. Man har dessuten ved mange poliklinikker fått automatiserte blodsukkermålere som måler kontinuerlig i tre døgn. Ved å gå igjennom resultatene fra slike målinger sammen med pasienten kan man få viktige tips til å justere behandlingen. I mange tilfeller skyldes den dårlige reguleringen insulinoverdosering, med hyppige, kortvarige insulinfølinger som gir etterfølgende hyperglykemi på grunn av motreguleringshormoner og overspising. Det kan gi hyperglykemi i et døgn eller mer etterpå. Bare unntaksvis trenger pasienter med type 1-diabetes høyere insulindose enn 1 IE/kg per dag. Det er også viktig for pasientene å variere stikkstedene for å unngå infiltrater (fettvevshypertrofi) som ofte gir langsom og varierende insulinoppsuging.
Den store bedring i diabetesbehandlingen skyldes først og fremst at pasientene har fått bedre kunnskap og tekniske hjelpemidler til selv å ta vare på sykdommen. Pasientenes egne erfaringer blir i dag i stor grad trukket inn i behandlingen, noe som er av avgjørende betydning for et godt resultat (9).