Mange kreftpasienter får i sykdomsforløpet smerter som krever behandling med sterke opioider, dvs. trinn 3 på WHOs smertetrapp. Nyere norske studier viser imidlertid at mange har sterke smerter selv om de får opioidbehandling (1). Dette kan forklares av flere forhold – mangelfull diagnostikk, dårlig oppfølging eller at opioidene ikke blir brukt optimalt. I behandlingen av sterke smerter må også psykologiske og sosiale faktorer tas med i vurderingen. Dokumentasjonen av ulike behandlingsmetoder for kreftsmerter er nylig vurdert av Nasjonalt kunnskapssenter for helsetjenesten (2).
Riktig oppstart, dosetitrering, vedlikeholdsbehandling og behandling av gjennombruddssmerter med sterke opioider er tidligere beskrevet i Tidsskriftet (3). Når opioidbehandling i tråd med disse retningslinjene ikke fører til akseptabel balanse mellom smertelindring og bivirkninger, er det nødvendig med en ny totalvurdering av smertetilstanden. Den bør omfatte nytt anamneseopptak, ny klinisk undersøkelse og supplerende bildeundersøkelser. Kombinasjoner med andre aktuelle analgetika eller andre behandlingsmåter bør vurderes. Onkologisk behandling, som stråleterapi, kjemoterapi eller hormonterapi, kan være indisert ved en rekke smertetilstander som skyldes kreftsykdom. For pasienter der man etter fornyet smertediagnostikk ikke finner gode alternativer til opioider, kan man vurdere å bytte administrasjonsmåte eller sette vedkommende på et annet opioid – opioidrotasjon. Ved kvalme/oppkast eller mistanke om dårlig absorpsjon bør man gå over til subkutan infusjon eller plaster. Klinisk erfaring tilsier også at det hos terminalt syke kreftpasienter med dårlig respons på peroral behandling kan være nyttig å bytte til subkutan infusjon. Ved kraftige smerter og behov for umiddelbar effekt bør man i samråd med smerteklinikk eller palliativ enhet vurdere å gi pasientene en blanding av morfin og lokalanestetika intratekalt eller epiduralt.
Det mangler gode klinisk kontrollerte studier der man har evaluert effekten av opioidrotasjon, men mange ukontrollerte studier støtter klinisk erfaring om at en del pasienter har stor nytte av å bytte opioid (4). I de fleste publiserte studiene omtales bytte fra morfin til metadon.
Mulige årsaker til effekt av opioidrotasjon
Årsaken til at bytte fra ett opioid til et annet hos en del pasienter kan gi bedret smertelindring og/eller mindre bivirkninger, er ikke sikkert klarlagt. Aktuelle mekanismer er opioidenes ulike bindingsprofiler til opioidreseptorene, effekt på andre reseptorer enn µ-opioidreseptoren eller fravær av toksiske metabolitter. Videre vet man at det finnes interindividuelle genetiske forskjeller som har betydning for medikamentomsetningen og konfigurasjonen til opioidreseptorene. Det er vist at forskjeller i arvematerialet forklarer ulikt behov for morfin hos kreftpasienter (5), og at forskjeller i genotype er assosiert med nødvendigheten av å bytte fra morfin til andre opioider (6). In vitro-forsøk viser at metadon virker som en NMDA-reseptorantagonist. Hypotesen om at metadon derfor virker bedre mot nevropatisk smerte enn andre opioider, er imidlertid ikke bekreftet i kliniske studier.
Hva skal man bytte til?
Ved alvorlig nyresvikt med opphopning av toksiske metabolitter bør man bytte til et medikament uten kjente aktive metabolitter, slik som fentanyl eller metadon. Oksykodon har aktive metabolitter, men det er foreløpig uavklart hvilke konsekvenser opphopning av disse har ved nyresvikt. Det finnes ingen kontrollerte studier der forskjellige typer medikamenter ved opioidrotasjon er sammenliknet, men det er rapportert at pasienter har ulike preferanser for de hyppigst brukte opioidene (7). En rotasjon mellom disse kan derfor være en alternativ strategi til metadon. Hvis det ikke er effekt av den første opioidrotasjonen, kan man ha nytte av å gjennomføre flere rotasjoner (8).
Hvordan bytte?
Når man veksler mellom ulike opioider og administrasjonsformer, er det viktig å være klar over at det er interindividuelle forskjeller i peroral biotilgjengelighet og halveringstid for alle opioidene (9). Disse to forholdene gjør at ekvianalgetisk doseratio varier fra pasient til pasient og at doseratio fra preparatomtaler, Felleskatalogen eller tabeller i lærebøker må brukes med stor forsiktighet. Mange slike tabeller er basert på enkeltdoser og gjenspeiler ikke forholdene i en pasientpopulasjon under langtidsbehandling. Tabell 1 viser ekvianalgetiske doser for de vanligste opioidene. I de tilfellene der man har observert toleranseutvikling forut for bytte av opioid, må man ved dosering av det alternative opioidet være oppmerksom på at det ikke nødvendigvis er fullstendig krysstoleranse. Forskjellene i halveringstid gjør også at ulike pasienter har behov for ulike doseringsintervaller for å oppnå stabil smertelindring.
|
Tabell 1 Ekvianalgetiske doser for ulike opioider. Ved bytte av opioid eller administrasjonsmåte må man være oppmerksom på at verdiene kan variere betydelig individer imellom
|
|
Preparat og administrasjonsmåte
|
Ekvianalgetisk dose
|
|
Morfin peroralt
|
60 mg
|
|
Morfin intravenøst/subkutant
|
20 mg
|
|
Oksykodon peroralt
|
30 mg
|
|
Oksykodon intravenøst/subkutant
|
15 mg
|
|
Hydromofon peroralt
|
8 mg
|
|
Metadon peroralt
|
Se tabell 2
|
|
Metadon intravenøst/subkutant
|
3/4 av peroral dose
|
|
Fentanyl transdermalt¹
|
100 µg/t per 350 mg morfin peroralt/døgn
|
|
[i]
|
|
Tabell 2 Veiledende ratio morfin-metadon ved opioidrotasjon. Ved parenteral administrasjon av morfin må dosen ganges med 3 for å finne tilsvarende peroral dose
|
|
Morfin peroralt (mg)
|
Morfin-metadon-ratio
|
|
30 – 90
|
4 : 1
|
|
90 – 300
|
6 : 1
|
|
300 – 600
|
8 : 1
|
|
600 – 1 000
|
10 : 1
|
|
> 1 000
|
12 : 1
|
Selv om det er rapportert forskjellige måter å gjennomføre opioidrotasjon på, er de ulike måtene så langt ikke blitt sammenliknet i kontrollerte studier. I hovedsak kan byttene skje på tre måter: Pasienten konverteres umiddelbart til det nye opioidet (kalt «stop and go»), konverteringen skjer gradvis over noen dager eller den gjennomføres gradvis over uker. Uansett hvordan man roterer, er det alltid nødvendig å begynne med en lav dose av det nye opioidet og titrere dosen opp til tilfredsstillende effekt. Pasienten må informeres nøye om at det ofte tar tid å titrere seg frem til optimal dose. For bytte mellom de vanligste opioidene, dvs. morfin, oksykodon og fentanyl, er ekvianalgetiske doser rimelig godt kjent og halveringstidene tilstrekkelig forutsigbare til at bytte kan skje etter «stop-and-go-metoden» dersom pasientene bruker lave til moderate doser med opioider, dvs. inntil 300 – 400 mg morfin peroralt eller tilsvarende morfinekvivalenter. For bytte til metadon er et skifte over tre dager med gradvis reduksjon av dosen av det ene opioidet samtidig med en opptrapping av dosen av det nye opioidet mye brukt (10). Den samme strategien anbefales også ved rotasjon til andre opioider enn metadon dersom utgangsverdien er over 300 – 400 mg morfin peroralt eller tilsvarende morfinekvivalenter. Et eksempel på opioidrotasjon til metadon er vist i figur 1.
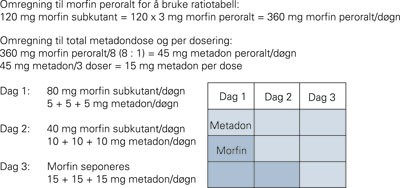
Eksempel på opioidrotasjon. Man går fra morfin subkutant til metadon peroralt over tre dager
Metadon
Metadon ble opprinnelig utviklet som et smertestillende medikament og var lenge mye brukt i smertebehandling på grunn av lang halveringstid. Etter introduksjonen av depotformuleringer av andre opioider er midlet hovedsakelig blitt brukt i substitusjonsbehandling av rusmiddelmisbrukere. Fra midten av 1990-årene er metadon i økende grad blitt tatt i bruk ved opioidrotasjon, både til kreftpasienter og til pasienter med normal livsprognose som har kroniske smerter.
Metadon har en meget variabel farmakokinetikk, og halveringstiden er rapportert å være mellom 12 og 60 timer (9). Mens det i legemiddelassistert rehabilitering er vanlig å administrere midlet en gang daglig, er det i smertebehandling nødvendig å dosere flere ganger i døgnet, som regel tre eller fire. Foreløpig er det ikke kjent hvorfor metadon må doseres så hyppig for å gi stabil smertelindring. Den variable halveringstiden gjør at pasienter må følges tett i forbindelse med oppstart og dosejusteringer for å unngå overdosering. Hos dem med lengst halveringstid vil det skje en akkumulasjon over lang tid, slik at det kan ta en uke eller mer å nå farmakologisk likevekt. Pasientene bør følges opp daglig, og personer som bor alene og ikke har et godt nettverk, bør innlegges i denne perioden, spesielt ved bruk av høye doser. Fordi det går kort tid fra peroral administrasjon til effekt kan metadon også brukes mot gjennombruddssmerter, men ved gjentatt administrasjon er faren for akkumulasjon på grunn av den lange halveringstiden stor. Ved bytte fra andre opioider til metadon må man være oppmerksom på at ekvianalgetiske doseratioer i artikler om opioidrotasjon avviker betydelig fra verdiene i de fleste lærebøker. Det er også holdepunkter for å anta at doseratioen er doseavhengig, slik at man ved høyere opioiddoser behøver forholdsvis mindre metadon enn forventet (10). Vi anbefaler derfor å begynne med en dose som er lavere enn beregnet ekvianalgetisk dose, sørge for mulighet til å ta ekstra metadon ved sterke smerter og deretter titrere dosen oppover om nødvendig. Tabell 2 viser et forslag til doseratioer for opioidrotasjon til metadon.
Det har vært rapportert tilfeller av torsades de pointes-arytmi under behandling med store doser metadon, og det er sprikende data for hvorvidt metadon i lave doser fører til økt QT-tid. Man bør derfor før oppstart nøye vurdere indikasjonen for å bytte til metadon dersom pasienten har kjente risikofaktorer for torsades de pointes-arytmi eller forlenget QT-tid. Statens legemiddelverk har anbefalt at man følger QT-tiden med EKG ved oppstart og doseendringer.
I Norge er metadon bare registrert for bruk i substitusjonsbehandling, men fra 1.1. 2005 gis det refusjon etter § 5.22 for smertebehandling, på lik linje med andre opioider.
Metadon finnes som mikstur, injeksjonsveske og tabletter. Bare 5 mg-tabletter er kommersielt tilgjengelig, men tabletter med høyere dose kan produseres i apotek. Metadon kan være lokalirriterende, og ved bruk av injeksjonsvæske i smertepumpe anbefales intravenøs fremfor subkutan injeksjon. Ved behandling i en kortere periode kan imidlertid subkutan administrasjon være aktuelt. Da må man være oppmerksom på irritasjonstegn og bytte injeksjonssted regelmessig. Biotilgjengeligheten for metadon peroralt er vanligvis 70 – 90 %. Metadon parenteralt bør derfor i begynnelsen doseres med 3/4 av peroral dose.
I ulike retningslinjer for opioidbehandling av kreftpasienter anbefales rotasjon dersom førstelinjeopioidet ikke har tilfredsstillende effekt (11), og opiodrotasjon bør vurderes både ved kreftsmerter og andre smerter (12, 13). Verken genetiske tester eller kliniske karakteristika kan foreløpig forutsi enkeltpasienters respons på de ulike opioidene. For opioidrotasjon er det ikke holdepunkter for å hevde at spesielle opioider er bedre egnet enn andre. Vi anbefaler derfor at leger bør ha et sterkt opioid som brukes fast som førstevalg og et annet sterkt opioid som man bytter til hvis andre tiltak ikke er aktuelle – det kan for eksempel være morfin og enten oksykodon, fentanyl eller hydromorfon. Opioidrotasjon til metadon bør kun utføres etter rådgivning fra smertesentre, palliative enheter eller andre med særlig kompetanse.