Jehovas vitner motsetter seg transfusjon av blod og blodets hovedbestanddeler. Dette gjelder også eget blod dersom det har vært ute av kroppen. Med blodets hovedbestanddeler menes røde blodceller, hvite blodceller, blodplater og plasma. Enkelte vil godta fraksjoner utvunnet av blodets hovedbestanddeler, slik som albumin, immunglobuliner og koagulasjonsfaktorer. Rekombinante produkter godtas vanligvis. Alle syntetiske volumerstatninger godtas. Beslutningen om å godta at eget blod for en kort periode er utenfor, men i et kontinuum med kroppen, tas av det enkelte vitne. Dette vil gjelde ved bruk av akutt normovolemisk hemodilusjon, «cellsaver», hjerte-lunge-maskin og hemodialyse. Større kirurgiske inngrep kan gjennomføres uten bruk av allogent eller preoperativt donert autologt blod (1, 2).
Pasienten. En 70 år gammel mann, medlem av Jehovas vitner, ble henvist fra lokalsykehus med endetarmskreft lokalisert 12 cm fra endetarmsåpningen. Histologisk undersøkelse viste ulceroinfiltrerende middelshøyt differensiert adenokarsinom. Henvisningen til Radiumhospitalet skyldtes at man fra lokalsykehuset ikke ville garantere gjennomføring av et kirurgisk inngrep uten transfusjon. Pasienten hadde tidligere fått medisiner pga. angina pectoris, men behandlingen ble seponert et halvt år før den aktuelle sykdomsepisoden, uten residiv av besvær. Et abdominalt aortaaneurisme med diameter 4 cm ble funnet preoperativt. Han var ellers stort sett frisk og brukte ingen medisiner da han ble innlagt ved Radiumhospitalet. Hemoglobinnivået ved henvisningstidspunktet var 12,8 g/100 ml, og han fikk preoperativt to ganger jernhydroksidsukrose 200 mg intravenøst og erytropoietin α 40 000 IE subkutant. Ved innleggelsen var han i god allmenntilstand, og klinisk undersøkelse avdekket intet påfallende. Preoperativ Hb var 13,4 g/100 ml. Det ble utført lav fremre rectumreseksjon, med peroperativ blødning 300 ml. Første postoperative dag var Hb 11,8 g/100 ml. Bortsett fra atrieflimmer var det et ukomplisert postoperativt forløp.
Ett år senere fikk pasienten (ved et annet sykehus) utført perkutan koronar intervensjon etter gjennomgått subendokardialt hjerteinfarkt. Han hadde ingen anginaplager etter dette.
To år etter primæroperasjonen ble det funnet metastaser fra endetarmskreften i leverens segment 8. Hb var ved henvisningstidspunktet 13,4 g/100 ml. Under preoperativ samtale kom det frem at pasienten aksepterte bruk av akutt normovolemisk hemodilusjon og «cellsaver», i tillegg til albumin og koagulasjonsfaktorer. Preoperativt ble det gitt jernhydroksidsukrose 200 mg intravenøst og erytropoietin β 40 000 IE tre ganger. Ved innleggelse for operasjon var pasienten i god allmenntilstand. Man fant en systolisk bilyd grad 1 over hjertet, ellers var det ved klinisk undersøkelse intet spesielt. Han brukte simvastatin 20 mg x 1, metoprolol (Selo-Zok) 25 mg x 1 og furosemid 40 mg x 1. Preoperativ Hb var 14,4 g/100 ml. Akutt normovolemisk hemodilusjon ble gjennomført med to enheter fullblod tappet, kompensert med 1 500 ml Haemaccel. Det ble utført en utvidet høyresidig leverreseksjon. Vanskelige kirurgiske forhold bidro til en peroperativ blødning på ca. 4 600 ml. Ved bruk av «cellsaver» prosesserte man ca. 1 000 ml transfusat, som ble retransfundert med bruk av leukocyttfilter. De to enhetene fullblod ble gitt tilbake ved slutten av inngrepet. Han kunne ekstuberes to timer etter avsluttet operasjon. Postoperativt var INR 2,0, og pasienten fikk Octaplex 500 IE to ganger første døgn og traneksamsyre 1 g x 4. Ved første postoperative måling var Hb 9,1 g/100 ml, om morgenen første postoperative dag var Hb-nivået 8,9 g/100 ml.
Aktuelle blodsparende teknikker
Akutt normovolemisk hemodilusjon
Ved akutt normovolemisk hemodilusjon (fig 1) tappes fullblod fra pasienten etter innledning av anestesi, men før det kirurgiske inngrepet er startet. Det tappede blodvolumet blir erstattet av kolloider eller krystalloider for å beholde normovolemi, man påfører således pasienten moderat anemi. Det tappede fullblod tilsettes antikoagulans og lagres på operasjonsstuen, tilkoblet pasienten. For å beholde adekvat vevsoksygenering kompenseres anemien ved redistribusjon av blodsirkulasjon til prioritert vev, økt hjerteminuttvolum og økt oksygenekstraksjon. I tillegg vil antakelig mikrosirkulatoriske forandringer under anemi lette vevsoksygeneringen (3). Kompensasjonsmekanismer sikrer oksygenleveranse ned til en kritisk hemoglobingrense, som hos ellers friske antakelig ligger omkring 5 g/100 ml (3, 4).
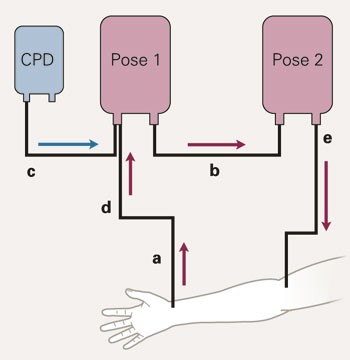
Akutt normovolemisk hemodilusjon. Eksempel på sett med to poser. Fullblod tappes fra radialisarterien (a) til pose 1, som kommer forhåndsfylt med sitrat-fosfat-dekstrose (CPD). Dette blandes og overføres til pose 2, som kommer uten tilsetninger (b). Ny CPD-blanding tilsettes så pose 1 (c), som fylles på nytt (d). Ved transfusjonsbehov kan dette gjøres via infusjonssett (e), som er forhåndsfylt med natriumklorid slik at man hele tiden har en kontinuerlig sirkel
Etter dilusjon vil et eventuelt blodtap per volumenhet inneholde færre røde blodceller enn før. Når hemoglobinnivået har sunket så mye at kompensasjonsmekanismene for dilusjon er oppbrukt, må pasienten ved videre blødning retransfunderes for å sikre adekvat oksygenleveranse. Retransfundert blod er fullblod og vil derfor i tillegg til røde blodceller inneholde blant annet koagulasjonsfaktorer og blodplater. Man kan således eventuelt transfundere tidligere hvis det er behov for andre av blodets bestanddeler.
Akutt normovolemisk hemodilusjon krever kardiopulmonal reservekapasitet, og hjerte-/lungesykdom kan således, sammen med hemoglobinopatier, nyresvikt og koagulopatier, utgjøre relative kontraindikasjoner mot bruk av metoden (3).
For å oppnå effekt i form av sparte allogene transfusjoner krever akutt normovolemisk hemodilusjon antakelig tilstrekkelig høy differanse mellom hemoglobinnået før og etter dilusjon samt en tilstrekkelig, men ikke for stor blødning (5).
En forutsetning for at akutt normovolemisk hemodilusjon skal bli akseptert av Jehovas vitner, er at et infusjonssett fylt med saltvann er koblet mellom det tappede blodet og pasienten, slik at man får en kontinuerlig sirkel fra pasienten til det tappede blodet og tilbake.
«Cellsaver»
Denne teknikken (fig 2) innebærer at det aspireres blod fra operasjonsfeltet. Dette tilsettes antikoagulans, lagres i et reservoar og kan siden vaskes i isotont natriumklorid. Røde blodceller konsentreres til hematokrit ca. 60 % og retransfunderes. Vanlige indikasjoner er kirurgiske inngrep på hjerte, store kar og lever samt stor urologisk og ortopedisk kirurgi (6).
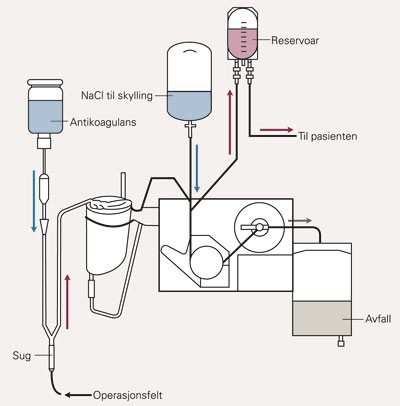
«Cellsaver». Blod fra operasjonen tilsettes heparin og aspireres til «cellsaver»-systemet. Her vaskes antikoagulerte blødningsprodukter i natriumklorid før overføring av røde blodceller til reservoaret. Herfra kan disse retransfunderes gjennom leukocyttfilter. Infusjonssettet er forhåndsfylt med natriumklorid, slik at man hele tiden har en kontinuerlig sirkel
Forhold som fører til lyse av røde blodceller regnes som kontraindikasjoner mot bruk av «cellsaver». Dette kan være for eksempel sterilt vann eller hydrogenperoksid i operasjonsfeltet. Kontaminasjon med bakterier eller maligne celler er relative kontraindikasjoner. Det er ikke vist at bruk av «cellsaver» ved antatt bakteriekontaminasjon fører til økt forekomst av bakteriemi og sepsis. Man kan ha to sug, ett vanlig og ett til «cellsaver». Ved antatt stor kontaminasjon kan det vanlige suget benyttes for å redusere bakteriebyrden som tilføres systemet. Vanlig antibiotikaprofylakse anbefales (6). Transfusjon gjennom leukocyttfilter reduserer bakteriemengden i transfusatet ytterligere (7). Kontaminasjon med maligne celler og påfølgende risiko for hematogen spredning fra operasjonsfeltet utgjør en bekymring. Leukocyttfiltre fjerner en stor andel maligne celler (8). Det er ikke vist at bruk av «cellsaver» gir økt residivfrekvens etter radikal retropubisk prostatektomi for prostatakreft (9).
En forutsetning for at bruk av «cellsaver» skal bli akseptert av Jehovas vitner er at et infusjonssett fylt med saltvann er koblet mellom reservoaret og pasienten slik at man får en kontinuerlig sirkel fra blødningen i operasjonsfeltet tilbake til pasienten.
Preoperativ økning av hemoglobinnivå
Preoperative erytropoietininjeksjoner reduserer risikoen for allogen transfusjon ved en del kirurgiske inngrep (10, 11). Man kan heve hemoglobinkonsentrasjonen slik at den hemoglobinverdi som kreves for effekt av akutt normovolemisk hemodilusjon oppnås. Flere regimer for erytrpoietinbehandling er lansert (10, 11). Erytropoietin α (Eprex) er godkjent til bruk før elektiv ortopedisk kirurgi med 600 IE/kg subkutant én gang per uke i tre uker før operasjonen samt på operasjonsdagen. Retikulocyttallet stiger fra tredje dag av behandlingen. Røde blodceller tilsvarende ca. én enhet er produsert etter én uke og en mengde tilsvarende ca. fem enheter etter fire uker (10). Hemoglobinøkning er også demonstrert hos pasienter med gastrointestinal kreft (12). Erytropoietinbehandling bør ledsages av jerntilskudd, med tanke på jernbegrenset erytropoese. Denne er for Jehovas vitner anbefalt gitt intravenøst (13).
Bekymringer ved bruk av erytropoietinpreparater hos kreftpasienter er særlig knyttet til hypertensjon, trombotisk tendens og eventuell stimulering av kreftcellelinjer (14). Det er ikke rapportert tilfeller av erytropoietinindusert «pure red cell aplasia» hos kreftpasienter.
Legemidler
Det er vist blødningsreduserende effekt av fibrinolysehemmeren traneksamsyre i forbindelse med flere typer kirurgiske inngrep, så som innsetting av hofte- eller kneprotese, ved keisersnitt og aortaventiloperasjon, uten at det er økt risiko for tromboemboliske komplikasjoner. Det er vanskelig å se at det foreligger dokumentasjon for at desmopressin har perioperativ blodsparende effekt utover eventuelt i subgrupper, som hjerteopererte. Kunnskapsgrunnlaget for bruk av aktivert faktor VIIa er begrenset (4, 15). Enkelte Jehovas vitner godtar bruk av kryopresipitat (SD-kryo), som inneholder von Willebrands faktor, faktor VIII og fibrinogen samt humant protrombinkomplekskonsentrat (Octaplex) med faktorene II, VII, IX og X. Lokalhemostasemidlet TachoSil har vist effekt ved leverreseksjoner (16).
Rutiner ved Radiumhospitalet
Etter at operasjonsindikasjonen er vurdert ved kirurgisk avdeling, henvises Jehovas vitner til anestesiavdelingen for samtale med overlege tre uker før det planlagte inngrepet. Man informerer om muligheter for og begrensninger ved gjennomføring av kirurgiske inngrep uten bruk av blodprodukter, og det avklares hvilke metoder som er akseptable for pasienten.
På bakgrunn av klinisk tilstand, laboratorieverdier, hvilke metoder som kan aksepteres og planlagt kirurgisk inngrep avgjør kirurg og anestesilege hvorvidt gjennomføring av inngrepet er forsvarlig. Det bestemmes videre hvorvidt det er hensiktsmessig å forbehandle pasienten med erytropoietin og jern, hvilket eventuelt administreres i regi av kirurgisk avdeling. For større inngrep ønsker man vanligvis Hb ≥ 16 g/100 ml for menn og Hb ≥ 15 g/100 ml for kvinner. Spesialsett for akutt normovolemisk hemodilusjon (for to eller tre enheter fullblod og sitrat-fosfat-dekstrose for tilsetning) egnet for oppkobling i sirkel bestilles fra Blodbanken i Oslo når pasienten kommer inn for operativ behandling.
Inngrepet gjennomføres med eventuell bruk av akutt normovolemisk hemodilusjon og «cellsaver» koblet i sirkel. Man har rutinemessig invasiv trykkmonitorering via arteriekran og sentralt venekateter. Der det er hensiktsmessig, benyttes epiduralanestesi i tillegg til generell anestesi, og inngrepet gjennomføres i moderat hypotensjon.
Dersom blod tappet ved akutt normovolemisk hemodilusjon ikke er retransfundert peroperativt, gis dette tilbake ved avslutning av inngrepet før pasienten forlater operasjonsstuen. Grunnet de bekymringer som foreligger ved bruk av «cellsaver» hos kreftpasienter, retransfunderes det fra denne kun på klinisk indikasjon.
Egne erfaringer
Vi har registrert 34 inngrep hos 30 pasienter ved Radiumhospitalet fra april 1992 til januar 2006. Den vanligste indikasjonsstillingen var gastrointestinal kreft (tab 1). Median hemoglobinverdi preoperativt var 14,0 g/100 ml, første postoperative dag 10,6 g/100 ml. Median peroperativ blødning var 480 ml (tab 2). Det ble gitt erytropoietin og jern før 19 av inngrepene. Median hemoglobinstigning fra siste målte verdi før behandling med erytropoietin/jern til siste måling før kirurgisk inngrep var 1,8 g/100 ml. Akutt normovolemisk hemodilusjon ble benyttet ved 16 av inngrepene. «Cellsaver» var koblet opp i sirkel ved flere av inngrepene, men retransfusjon ble kun foretatt ved tre, og da gjennom leukocyttfilter. 16 av pasientene var avvist ved annet sykehus pga. transfusjonsvegring. Ingen mottok transfusjonsprodukter de ikke på forhånd hadde akseptert.
|
Tabell 1 Indikasjonsstilling for kirurgisk inngrep representert ved lokalisasjon av sykdommen
|
|
Lokalisasjon
|
Antall inngrep
|
|
Gastrointestinal kreft
|
19 (derav 11 endetarmskreft)
|
|
Gynekologisk kreft
|
9
|
|
Nyrekreft
|
2
|
|
Intrahepatisk kreft
|
3
|
|
Sarkom
|
1
|
|
Tabell 2 Hemoglobinnivåer, blødning og operasjonstid for inngrepene (Q₁ og Q₃ er henholdsvis første og tredje kvartil)
|
|
N = 34
|
Preoperativ Hb (g/100 ml)
|
Første postoperative Hb (g/100 ml)
|
Hb første postoperative dag (g/100 ml)
|
Hb-fall fra preoperativt til første postoperative dag (g/100 ml)
|
Peroperativ blødning (ml)
|
Operasjonstid (t)
|
|
Min
|
7,1
|
3,4
|
3,1
|
–1,4
|
0
|
0,8
|
|
Q₁
|
12,9
|
9,7
|
9,1
|
1,9
|
260
|
1,7
|
|
Median
|
14,0
|
10,9
|
10,6
|
3,2
|
480
|
3,3
|
|
Q₃
|
15,3
|
12,2
|
12,1
|
4
|
1 260
|
4,0
|
|
Maks
|
18
|
16,9
|
16,9
|
11,7
|
5 000
|
10,2
|
Fire pasienter døde under den aktuelle innleggelsen. For to av dem ser man ingen sammenheng til den fulgte transfusjonsstrategi, for én pasient var anemi en mulig medvirkende dødsårsak. Denne pasienten hadde preoperativt Hb 16,3 g/100 ml, blødde peroperativt ca. 5 000 ml og hadde postoperativt etter retransfusjon av ca. 1 000 ml fra «cellsaver» et hemoglobinnivå på 8,3 g/100 ml. Pasienten døde sju dager etter inngrepet av bronkopneumoni. En eldre pasient døde av anemi. Han hadde en preoperativ Hb-verdi på 14,8 g/100 ml, blødde peroperativt ca. 2 800 ml, og Hb første dag var 3,1 g/100 ml. Man benyttet ikke «cellsaver» eller akutt normovolemisk hemodilusjon, da dette på den tiden ennå ikke var rutine i avdelingen. Han utviklet flerorgansvikt og døde fire dager postoperativt.
Diskusjon
En forutsetning for å kunne gjennomføre store kirurgiske inngrep hos Jehovas vitner er konsensus i behandlingsteamet om muligheter og begrensninger med hensyn til en forsvarlig gjennomføring av inngrepet og håndtering av pasienten i den perioperative fase. Denne konsensusen må bygge på en grundig samtale med pasienten og en nøyaktig plan for å optimalisere forholdene for å minimalisere blodtapet og finne muligheter for blodsparing. Vår erfaring er at dette lar seg gjennomføre hos Jehovas vitner som trenger omfattende onkologisk-kirurgiske inngrep.
Pasientrettighetsloven § 4-1 har som hovedbudskap at pasienten må samtykke i medisinsk behandling. Transfusjon mot pasientens vilje kan rammes av straffeloven § 222 eller § 228 om henholdsvis frihetskrenkelse eller legemsfornærmelse. Samtidig heter det i straffeloven § 387 at alle plikter å forsøke å redde liv der dette er i øyensynlig og overhengende fare, og helsepersonelloven § 7 pålegger leger å yte øyeblikkelig hjelp. Når pasienten ikke samtykker, er sistnevnte begrenset ved pasientrettighetsloven § 4-9, som gir rett til å nekte å motta blod og blodprodukter på grunn av alvorlig overbevisning. Straffeloven § 47 om nødrett gjør imidlertid en ellers straffbar handling lovlig når den blir foretatt for å redde liv. Ved en situasjon der et medlem av Jehovas vitner nekter transfusjon og man anser blodtransfusjon for å være påkrevd for å redde vedkommendes liv, gir antakelig ikke norsk lov noen endelig avklaring. Legers plikt til å utøve forsvarlig virksomhet etter helsepersonelloven § 4 kan komme i konflikt med kravet fra et medlem av Jehovas vitner om at et kirurgisk inngrep skal gjennomføres uten transfusjon. Det åpnes da for å henvise pasienten til andre (17). Vilkårene i pasientrettighetsloven § 4-9 forutsetter imidlertid at pasienten er myndig, tilstrekkelig informert og har forstått hvilke helsekonsekvenser behandlingsnekt kan ha. Barn kan således ikke nekte mottak av blod der man etter helsepersonelloven § 7 finner dette indisert. Andre, for eksempel foreldrene, kan heller ikke avgjøre om barn skal transfunderes i en akuttsituasjon (18).
Det er ikke uvanlig at velinformerte pasienter selv beslutter at videre medisinsk behandling skal begrenses eller avsluttes. Dette bygger på prinsippet om pasientens rett til selvbestemmelse. Mer problematisk er det imidlertid dersom en akutt, uforutsett tilstand fører til en klinisk situasjon der transfusjon er nødvendig for å berge pasientens liv. Har legen plikt og rett til å redde liv? Er pasienten godt nok informert til at han kan fatte en beslutning om å avvise transfusjon? Jehovas vitner vil hevde at man ikke avviser medisinsk behandling som sådan, men kun en behandlingsmodalitet der det finnes gode og etter deres mening kanskje bedre alternativer (19). Beslutningen om å nekte transfusjon kan imidlertid få store innvirkninger på det øvrige behandlingsopplegget. Mer administrative spørsmål kan også dukke opp i en elektiv situasjon. Kan en pasient på religiøst grunnlag forlange å fordyre og vanskeliggjøre et kirurgisk inngrep ved å kreve det utført uten transfusjon? Kan man på religiøst grunnlag forlange å bli operert ved et sentral- eller regionalsykehus?
Mange som er aktuelle for onkologisk kirurgi har komorbide tilstander. Det er diskutert hvorvidt særlig pasienter med hjerte- eller lungesykdommer tåler anemi dårligere enn ellers friske. I en observasjonsstudie av pasienter som nektet transfusjon fant man at ved lav hemoglobinverdi preoperativt eller stor peroperativ blødning var det høyere dødelighet i forbindelse med kirurgi hos kardiovaskulært syke enn hos friske (20). I subgruppen av kardiovaskulært syke i en intervensjonsstudie med intensivpasienter fant man ingen forskjell i dødelighet mellom pasientgruppene med transfusjonsgrense 7 g/100 ml og 10 g/100 ml (21). Det var imidlertid en statistisk ikke-signifikant tendens i retning av økt overlevelse ved en transfusjonsgrense på 10 g/100 ml i gruppen med alvorlig iskemisk hjertesykdom. Det er håp om at den pågående FOCUS-studien vil bringe ny kunnskap omkring transfusjonsgrenser hos pasienter med hjertesykdom (22).
Jehovas vitner vil ved å nekte transfusjon kunne legge begrensninger på hva slags inngrep det er mulig å gjennomføre. Prinsippene man benytter for å unngå transfusjon hos Jehovas vitner kan imidlertid også benyttes hos andre. Allogen transfusjon er i dag svært trygt, men kan innebære komplikasjoner, f.eks. smittsomme sykdommer, hemolytiske reaksjoner og immunmodulering. Ved bruk av preoperativ økning av hemoglobinnivået, akutt normovolemisk hemodilusjon, «cellsaver» og eventuell preoperativ autolog donasjon kan man redusere faren for noen av disse mulige komplikasjonene. Disse blodsparende teknikkene har imidlertid også ulemper, mulige komplikasjoner og kostnader som må tas i betraktning. Man kan kanskje likevel se for seg en større bruk av disse i andre pasientpopulasjoner. Håndtering av Jehovas vitner har ført til økt oppmerksomhet omkring og kunnskap om hemoterapi. Man har også høstet betydelig kunnskap gjennom behandling av pasienter som nekter transfusjon (20, 23, 24).