Det finnes en rekke eksempler på at ett og samme legemiddelfirma markedsfører identiske tabletter med ulike navn og ulik informasjon. Generiske navn må få en mer fremtredende plass på legemiddelpakningen.
For tre år siden oppdaget jeg at MSD markedsførte rofecoxib i Norge under to forskjellige produktnavn: Vioxx og Vioxx AC (fig 1). Tablettene hadde samme virkestoff, samme fasong, farge og hjelpestoffer. Vioxx ble trukket tilbake over hele verden i oktober 2004.
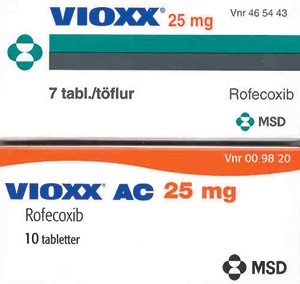
Figur 1 Vioxx og Vioxx AC 25 mg
Et annet firma, Merck, har samme markedsføringspraksis i Norge, ettersom bisoprolol også har to produktnavn, Emconcor og Emconcor CHF (fig 2). Tablettene er identiske. Det samme gjelder i mange andre land. I Sverige fant jeg Vioxx og Vioxxakut, i Danmark Vioxxalt og i Tyskland Vioxxdolor. Produktene hadde forskjellig informasjon. Vioxx var for artrose og kroniske smerter, mens Vioxx AC var for akutte smerter. Denne forskjellen fantes både i pakningsvedlegg og Felleskatalog-tekst (1) (eller tilsvarende). Situasjonen var og er den samme for Emconcor. Emconcor er indisert for hypertensjon og mot angina, mens Emconcor CHF (Cardicor i Danmark, Concor COR i Tyskland) er indisert for hjertesvikt. Et tredje eksempel er ropinirol fra GlaxoSmithKline. Som antiparkinsonmiddel finnes den i fem styrker under navnet Requip. Tre av disse gjenfinnes under navnet Adartrel mot rastløse bein (fig 3) (2).
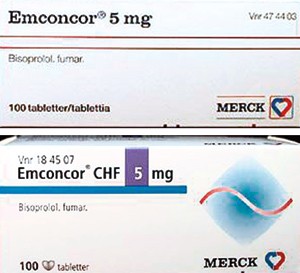
Figur 2 Emconcor og Emconcor CHF 5mg

Figur 3a Adartrel 2 mg 84 tabletter

Figur 3b Requip 2 mg 84 tabletter
Forvirring
I Norge utgir Legemiddelverket en liste over medisiner og pakninger som er generisk byttbare (3). Emconcor og Emconcor CHF står ikke på denne listen. Requip står der – men ikke Adartrel – til tross for at tablettene er identiske. Men på apotek går Emconcor og Emconcor CHF om hverandre. Det er uhyre få farmasøyter som vet om denne «forskjellen». Reseptene jeg har sett, viser at heller ikke legene vet om den. Jeg har ringt legemiddelfirmaene og etterspurt informasjon og har oppdaget at det også der hersker forvirring om spørsmålet. For pasientene tror jeg hovedregelen er mer eller mindre lykkelig uvitenhet. Helsepersonell er vant med generisk konkurranse. Men for folk flest er det uventet og ulogisk at et firma skal konkurrere med seg selv.
Også i USA finnes slike tvillingpreparater. Bupropion fra GlaxoSmithKline er markedsført som Zyban for røykestopp og som Wellbutrin mot depresjon. Fluoxetin fra Lilly var den første lykkepillen under merkenavnet Prozac. Etterpå kom Lilly med Sarafem (dette varemerket er senere blitt lisensiert til et annet selskap). Fargene er her ikke identiske. Sarafem er rosa, og det er kanskje en bedre farge for piller mot premenstruelt syndrom.
Det finnes flere eksempler hvis vi inkluderer ulike styrker. Finasterid fra MSD i 5 mg tabletter som Proscar ved godartet prostatahyperplasi og i 1 mg tabletter som Propecia mot hårtap. Medroksyprogesteron fra Pfizer i 5 mg og 10 mg styrke som Provera som gynekologisk preparat og i 100 mg styrke som Farlutal ved cancer. Kabergolin også fra Pfizer i styrkene 1, 2 og 4 mg som Cabaser som parkinsonmiddel og 0,5 mg tabletter som Dostinex for laktasjonshemming. Duloxetin fra Lilly i 20 og 40 mg styrke som Yentreve mot stressinkontinens og i 30 og 60 mg styrke som Cymbalta mot depresjon. Bemerk de overlappende, men ulike styrkene. Erytropoietin (epo) ble markedsført i USA av Amgen som Epogen for anemi ved nyresvikt. Amgen har lisensiert epo til Ortho for anemi ved cancer, og da under merkenavnet Procrit.
Mulige konsekvenser
Tvillingpreparater øker risikoen for dobbeltmedisinering. Institute for Safe Medication Practices (ISMP) i USA har til og med referert et tilfelle av trippelmedisinering med bupropion: både Zyban og Wellbutrin og generisk bupropion samtidig (4).
Tvillingpreparater kan øke samlet salg, selv om hvert produktnavn vil få lavere omsetning. Pakninger med lavt salg blir ikke lagerholdt i apotek, og dermed risikerer pasienten å vente flere dager før behandlingen kan påbegynnes. Tvillingpreparater kan medføre enklere og mer spesifikk informasjon for de forskjellige pasientgruppene. Men hvis en pasient får preparatet som er beregnet for en annen pasientgruppe, vil vedkommende også få informasjonen som er utformet for denne pasientgruppen – og altså ikke for sin egen lidelse. Tvillingpreparater kan i noen tilfeller brukes for å omgå varemerkedistraksjon. Hvis produktnavnet er sterkt knyttet til en bestemt bruk av preparatet, kan dette påvirke annen bruk av samme legemiddel. Lykkepillenavnet Prozac har en svært sterk posisjon i USA, slik at det kan være helt uegnet til enkelte pasienter.
Bruk utenfor godkjent indikasjon
Thalidomid er et gammelt virkestoff, men har kun lepra som godkjent indikasjon i USA. Lepra er sjeldent forekommende i USA, og hovedbruken av midlet er på ikke-godkjente indikasjoner som tuberkulose, kreft og aids. Patentet på virkestoffet thalidomid er utløpt, men Celgene i USA (og Pharmion i noen europeiske land) har patentert et distribusjonssystem for preparatet. Informasjonen om thalidomid fra Celgene sier ikke ett ord om annen (off-label) bruk. Informasjon fra Medmaster og USP DI (to amerikanske selskaper som leverer informasjon for pakningsvedlegg ved dispensering fra bulk) er mer generisk preget og nevner i det minste at thalidomid også brukes ved andre lidelser.
Et beslektet eksempel er misoprostol (Cytotec). All informasjon i Felleskatalogen og på pakningsvedlegg dreier seg om å motvirke magesår ved behandling med ikke-steroide antiinflammatoriske legemidler (2). Men omtrent all bruk av misoprostol er gynekologisk, slik som abort, cervikal priming og induksjon av fødsel.
Om ikke Vioxx var blitt trukket tilbake, kunne det ha blitt flere kapitler i den historien. Det finnes patenter og klinisk belegg for bruk av rofecoxib for å forebygge kolorektal cancer og Alzheimers sykdom og for å behandle hivinfeksjon. MSD valgte å bruke ett produktnavn ved bruk mot kronisk smerte og et annet ved bruk mot akutt smerte. Det er ikke vanskelig å forestille seg ytterligere tre produktnavn.
Atenolol er en ganske gammel substans. FDA i USA har godkjent tre indikasjoner for bruk av atenolol, og Legemiddelverket i Norge har godkjent ytterligere tre. Det er dokumentasjon for god effekt av atenolol ved enda fem – i alt 11 ganske forskjellige indikasjoner (5). Tenk deg 11forskjellige produktnavn – alle med informasjon om bruk bare ved én indikasjon.
Informasjonsutfordring
For pasientpakninger slik vi har i Norge, blir pakningsvedlegget og Felleskatalog-teksten utformet av produsenten. Det finnes flere eksempler på at produsenten hevder copyright på denne informasjonen. I USA, hvor de hovedsakelig dispenserer fra bulk, kommer tilsvarende produktinformasjon ofte fra selskaper som har spesialisert seg på dette. Forskjellige pasientgrupper trenger forskjellig informasjon. Hvordan løser man en slik utfordring? Et merkenavn med spesialisert informasjon for hver indikasjon, eller mer generisk informasjon som dekker alle de forskjellige terapiene?
Begge løsninger har fordeler og ulemper. Det må foretas en risikovurdering. Forskjellige substanser vil ha ulik risiko. Det kan også være mulig å differensiere informasjonen i generiske pakninger. Kanskje to ulike pakningsvedlegg eller egen ramme eller seksjon for hver pasientgruppe? Finnes det andre løsninger?
Varemerkebygging og tvillingpreparater er det motsatte av generisk medisin. Informasjonsspørsmålet her er så forvirrende og dunkelt at det minner meg om gamle dagers arkana og patentmedisin med hemmelig sammensetning. Jeg ønsker at legemiddelmyndighetene begrenser mulighetene for et legemiddelfirma til å bruke mer enn ett produktnavn på en substans. Og hvis det gis en slik tillatelse, bør det kreves at det andre produktnavnet skal være det generiske, at basisinformasjon sikres, og at informasjonen i Felleskatalogen og pakningsvedlegg ikke skal variere vesentlig.