En kvinne født i 1924 kom sommeren 1999 til medisinsk poliklinikk og presenterte en kul på halsen. Begge foreldrene til pasienten døde av tuberkulose, og ti år gammel ble hun nærmest blind på venstre øye etter sannsynligvis å ha gjennomgått en tuberkuløs keratitt. I 1979 fikk hun diagnosen Addisons sykdom og utredningen viste negativ binyrebarkantistofftest; noe som talte imot at pasientens binyrebarksvikt var autoimmunt betinget. I lys av pasientens tidligere ekstrapulmonale tuberkulose ble det konkludert med at pasientens Addisons sykdom trolig hadde tuberkuløs etiologi. Det ble startet substitusjonsbehandling med kortison og hun brukte 37,5 mg kortison daglig og 0,5 mg deksametason om kvelden.
Forut for konsultasjonen på medisinsk poliklinikk sommeren 1999 var pasienten vedvarende trett og hadde dårlig matlyst. Ved klinisk undersøkelse fant man flere suspekte lymfeknuter på halsen og i høyre aksille. Blodprøver viste normale infeksjonsparametere og normale hematologiske blodprøver. Røntgen thorax viste mindre forkalkninger perihilært, noe pleurafortykkelse og ingen patologiske oppfyllinger i mediastinum. Ultralydundersøkelse av halsen viste multiple nodulære velavgrensede lymfeknuter, hvor den største var 3,5 cm i lengdesnitt.
Ut fra funn av multiple forstørrede lymfeknuter på halsen mistenkte man først og fremst hematologisk eller metastaserende malign sykdom hos denne pasienten. Hun ble innlagt i medisinsk avdeling for videre utredning.
Det ble tatt CT hals, thorax, abdomen og bekken, som viste patologiske lymfeknuter på halsen, i høyre aksille og langs bekkenkarene på høyre side. Man så også kalk i mediastinum, milt og venstre binyre. Det ble utført pirquetprøve som gav kraftig bulløs reaksjon. Lymfeknutebiopsi av submandibulære lymfeknuter viste kronisk granulomatøs betennelse, hvor det i spesialfarging ble sett fire syrefaste staver. PCR-undersøkelse tydet på at de syrefaste stavene som ble sett var Mycobacterium tuberculosis og at det ikke fantes gen for rifampicinresistens.
Pasienten hadde en ekstrapulmonal tuberkulose som sannsynligvis var en reaktivering av hennes gamle tuberkulose. Ut fra PCR-undersøkelse ble det antatt at pasientens mykobakterier ikke ville gi resistensproblemer. Det ble startet antituberkuløs behandling med isoniazid 300 mg/d, pyrazinamid 1 500 mg /d og rifampicin som gradvis ble trappet opp fra 150 mg til 450 mg daglig over seks døgn.
De siste to dagene var pasienten mye kvalm, og sjette døgn etter oppstart av behandlingen ble hun akutt dårlig, kastet opp og fikk ikke i seg mat eller medisiner. Hun ble sløv og etter hvert nærmest bevisstløs, hypotensiv og lett febril. Tilstanden ble oppfattet som addisonkrise. Hun fikk behandling med store mengder væske og kortikosteroider intravenøst og ble på den behandlingen raskt bedre. Man fant moderat CRP-stigning, men ingen andre holdepunkter for infeksjon. Pasienten utviklet i etterforløpet akutt hjertesvikt med lungeødem og atrieflimmer, som ble behandlet effektivt med diuretika og digitoksin.
Ved tilbakegang til substitusjonsbehandling med kortison, ble pasienten igjen dårlig og man endte til slutt opp med en betydelig høyere grunndose kortison, enn det hun hadde brukt tidligere. Pasientens tilstand stabiliserte seg. Hun hadde god allmenntilstand og normalt blodtrykk ved medisinering med kortison tabletter 50 + 25 + 25 mg/d, samt deksametason 1 mg om kvelden.
Før start av antituberkuløs behandling, var pasienten i relativt god form, matlysten var fin og hun hadde normalt blodtrykk. Det gikk ikke mange dager etter start av rifampicinbehandling, før hun ble kvalm og utviklet akutt binyrebarksvikt. Hun fikk adekvat medikamentell behandling, men man hadde nok overvurdert væsketapet og gitt for mye væske intravenøst, noe som igjen ledet til hjertesvikt med lungeødem. En person med udiagnostisert binyrebarksvikt som utvikler addisonkrise, vil på grunn av det ofte meget langvarige forløp rekke å bli betydelig mer dehydrert enn en kortisonsubstituert pasient med Addisons sykdom som raskt utvikler krise pga. kortisonmangel. Det er derfor viktig når man skal behandle disse pasientene å vurdere væsketapet, så man ikke overbehandler med væske intravenøst og risikerer problemer med ødemer og hjertesvikt.
Det var først uforståelig hvorfor hennes kortisonbehov steg så mye. Hun var jo ikke febril, og hun var heller ikke dårlig pga. tuberkulosen. Kvalmen pga. tablettene forsvant straks kortisondosen ble økt. Etter titrering av kortisondosen havnet man på en vedlikeholdsdose 2 – 3 ganger høyere enn det hun tidligere brukte, noe som stemmer med tidligere erfaring med rifampicinbehandling til kortisonsubstituerte pasienter (1, 2). Det ble utført kortisonabsorpsjonstest under samtidig rifampicinbehandling. Denne viste s-kortisonnivåer for det meste innenfor referanseområdet og kun kortvarig ovenfor referanseområdet like etter inntak av 50 mg kortison (fig 1).
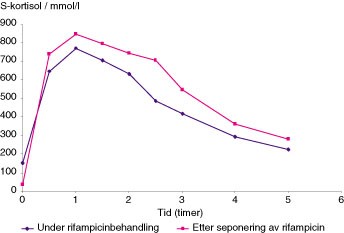
Figur 1 Kortisolabsorpsjonstest. Kortison 50 mg er gitt til fastende pasient ved tid 0 og etterpå måles s-kortisolnivået med 30 – 60 minutters mellomrom
Noen uker etter behandlingsstart med tuberkulostatika viste dyrking M tuberculosis som var følsom for alle testede medikamenter. Pasienten hadde etter tre måneders antituberkuløs behandling betydelig reduksjon i lymfeknutestørrelse, bedømt ved klinisk undersøkelse, på hals og i aksille og i abdomen bedømt ved CT.
Ved ukomplisert lymfeknutetuberkulose er anbefalt behandlingslengde seks måneder og kortere behandlingslengde vil medføre fare for residiv. Pasienten fikk som bivirkning fra tuberkulostatika et generalisert og plagsomt utslett og etter en totalvurdering valgte vi likevel å seponere tuberkulostatika etter tre måneder. Pasienten hadde en lite utbredt tuberkulose. Da antas det at tuberkellbasillmengden er relativt liten, og dermed antas det at også residivfaren er relativt liten. Pasienten ble senere fulgt opp poliklinisk med henblikk på eventuelt residiv av hennes tuberkulose.
Etter seponering av rifampicin, isoniazid og pyrizinamid kunne vi gradvis trappe ned til tidligere kortisonsubstitusjonsdose uten problemer. Ved senere kontroller har pasienten vært i velbefinnende på en dose med kortison på 37,5 mg og deksametason 0,5 mg om kvelden. Ved en poliklinisk kontroll ble det utført en kortisolabsorpsjonstest (fig 1) tre måneder etter seponering av rifampicin for å kunne sammenlikne den med den testen som ble gjort under pågående behandling med rifampicin.
Ved å sammenlikne de to kortisolabsorpsjonstestene som er gjort, finner vi mindre stigning og hurtigere senkning av kortisolnivåene på det tidspunkt pasienten brukte rifampicin sammenholdt med den kurven vi fant uten samtidig bruk av rifampicin (fig 1). Ved hjelp av verdiene for s-kortisol i kortisolabsorpsjonstesten og lineær regresjonsanalyse kunne vi gjøre en grov beregning av halveringstiden for kortisol hos denne pasienten. Kortison hadde en halveringstid uten samtidig rifampicinbehandling på 3,2 timer, mens med samtidig behandling med rifampicin var den på 2,6 timer. Halveringstiden for kortison ble dermed redusert med 20 % da rifampicin ble gitt til pasienten vår. Dette viser en klar interaksjon mellom rifampicin og pasientens kortisolmetabolisme. Ved vurdering av sykehistorien til pasienten i etterkant er det klart at interaksjonen mellom rifampicin og kortison var årsak til at pasientens Addisons sykdom kom ut av kontroll.
Diskusjon
Tuberkulostatika er en medikamentgruppe som har mange interaksjoner det er viktig å kjenne til. Ved samtidig administrasjon av rifampicin og et annet medikament som metaboliseres i leverens cytokrom P-450 enzymsystem kan en observere kortere halveringstid og dermed redusert effekt av medikamentet. Dette gjelder mange medikamenter deriblandt ciklosporin, digitoksin, enalapril, fenytoin, flukonazol, ketokonazol, verapamil, metadon, metoprolol, perorale antikonsepsjonsmidler, propanolol, sulfonylurea, teofyllin, tyroksin og warfarin. Isoniazid metaboliseres også i lever, men er mindre problematisk å bruke enn rifampicin. Isoniazid reduserer nedbrytningen av både fenytoin og valproinsyre og serumnivået av antiepileptika bør monitoreres jevnlig. Isoniazid gir også økt effekt av warfarin. Pyrizinamid og etambutol er begge førstelinje tuberkulostatika som har renal eliminasjon og færre problematiske interaksjoner. Både pyrizinamid og etambutol gir redusert renal utskilling av urinsyre og økt urinsyremengde i blod med fare for utløsing av klinisk urinsyregikt. Kombineres pyrizinamid og etambutol er der økt risiko for klinisk urinsyregikt. Både rifampicin, isoniazid og pyrizinamid har alle levertoksisitet som bivirkning, og kombineres disse medikamentene med hverandre eller brukes de sammen med andre potensielt levertoksiske medikamenter, er det økt risiko for leverbivirkninger (6, 7).
For å undersøke metaboliseringen av kortison hos pasienten vår ble det gjort en enkel test der man målte verdien av s-kortisol etter tablettinntak av kortison. Testen gjennomføres hos en fastende pasient og det måles s-kortisolnivå før og i regelmessige intervaller etterpå i fem timer etter en standardisert dose kortison som i vårt tilfellet var 50 mg. Hos vår pasient ble det først gjort under pågående rifampicinbehandling og så tre måneder etter seponering av rifampicin for å sammenlikne kortisolabsorbsjonen under og uten samtidig rifampicinbehandling. Kortisolabsorbsjonstest er imidlertid ingen god test til å vurdere om pasienter er adekvat substituert med kortison. Dette gjøres best ved klinisk vurdering.
Den vanligste årsaken i dag til binyrebarksvikt, er den immunologiske formen med antistoffproduksjon, som etter hvert ødelegger binyrene. Da Thomas Addison i 1855 beskrev sykdomstilstanden, var binyrebarksvikten forårsaket av tuberkulose. Tuberkulose gav ødeleggelse og kalkinfiltrat i binyrene, og var tidligere den vanligste årsaken til binyrebarksvikt. Da tuberkulosefrekvensen i dag igjen er økende, bør man nok være oppmerksom på binyrebarkfunksjonen hos disse pasientene.
Pasienthistorien illustrerer konsekvensen av interaksjon mellom livsnødvendig kortisonsubstitusjon og rifampicin hos en pasient med kjent substituert binyrebarksvikt. Rifampicin er en potent og selektiv induktor av leverens cytokrom P-450 enzymsystem, som styrer metaboliseringen av en rekke medikamenter. Introduksjon av kraftige enzyminduktor som rifampicin er, medfører økt metabolisme av kortison i lever, og mengden kortison fritt tilgjengelig blir betydelig redusert. Hos nyretransplanterte pasienter behandlet med prednisolon er det beskrevet problemer med frastøtning av transplantat etter start av rifampicinbehandling pga. minsket effekt av prednisolon (3, 4). I 1980-årene ble det gjort en del studier i Norge av rifampicins interaksjon med prednisolon. Man konkluderte med at steroiddosen måtte justeres opp, pga. økt nedbrytning. Halveringstiden sank med 48 %, og man fant betydelig lavere nivå av fritt prednisolon etter start av rifampicinbehandling (1). Det er tidligere beskrevet rifampicinindusert addisonkrise hos pasienter med binyrebarksvikt (5). I den artikkelen anbefalte man 2 – 3 dobling av kortisondosen i den tiden man behandler med rifampicin, for å få den substitusjonsbehandlingen man hadde før tuberkulosebehandlingen startet. Dersom pasienten i tillegg er klinisk dårlig, med feber og infeksjonstegn, behøves enda kraftigere økning av substitusjonsdosen, da pasienten jo ikke har fungerende binyrer som normalt skulle ha økt sin funksjon under sykdommer og stress. Pasienter som før start av rifampicinbehandling har marginal binyrebarkfunksjon (tuberkulosepasienter med binyreaffeksjon, cancerpasienter med metastaser til binyrene eller pasienter med steroidindusert binyresvekkelse), kan etter start av behandling utvikle symptomer
på binyrebarksvikt. Flere medikamenter, som for eksempel antiepileptika, er leverenzyminduktorer, og kan gi interaksjoner ved behandling med kortison. I tillegg kan det forekomme interaksjoner mellom kortison og medikamenter som endrer absorbsjonen av kortison, som antacida og kolestyramin.
Konklusjon
Addisons sykdom er en kronisk sykdom hvor inadekvat tilførsel av kortison kan gi addisonkrise som er en livstruende tilstand. Rifampicin er en kraftig leverenzyminduktor og kombinert med andre medikamenter kan det oppstå klinisk betydningsfulle interaksjoner, noe vår sykehistorie gir et eksempel på. Pasienter med binyrebarksvikt bør få økt sin kortisonsubstitusjonsdose når rifampicin eller andre kraftige leverenzyminduktorer introduseres.