ßRobert Koch (1843 – 1910) oppdaget tuberkelbasillen, Mycobacterium tuberculosis, i 1882. Det var den andre sykdomsfremkallende mykobakteriarten som ble beskrevet. Gerhard Armauer Hansen (1841 – 1912) gjorde sin oppdagelse av Mycobacterium leprae noen få år tidligere i 1874 (1). Noen få år etter sin oppdagelse, i 1890, trodde Koch at han hadde funnet en kur for tuberkulose, et ”helbredelsesmiddel”, som han kalte det. Han var blitt fascinert av det fenomenet som vi i dag kjenner som forsinket hypersensitivitet, eller type IV-immunreaksjoner, og som fremkalles ved injeksjon av tuberkulin i eller under huden (hos sensibiliserte individer). Allerede året etter, i 1891, ble denne påstanden tilbakevist. Med den teknikken som Koch og hans samtidige anvendte, forårsaket injeksjon av tuberkulin hos mennesker ganske kraftige reaksjoner, og tuberkulintestingen i diagnostisk øyemed fikk ikke betydning før omkring 1910. Frem til da var det først og fremst veterinærene som brukte tuberkulintesting i bekjempelsen av bovin tuberkulose, som forårsakes av Mycobacterium bovis.
Utvikling og standardisering av tuberkulinet
Tuberkulin fremstilles ved å dyrke tuberkelbasiller på overflaten av et flytende medium i flere uker. En mengde komponenter fra basillene frigjøres til kulturmediet i løpet av denne perioden. Når kulturen er moden for høsting, autoklaveres den, basillene filtreres vekk og tuberkulinet prepareres fra supernatanten.
Tuberkulinet som brukes til tuberkulinprøven, er en kompleks blanding av antigener fra kulturmediet og er svært vanskelig, om ikke umulig å karakterisere i detalj ved hjelp av fysikalsk-kjemiske metoder. Autoklavering er en meget tøff behandling, og komplekse kjemiske endringer skjer ved oppvarming av kulturene. Dette er årsaken til at det er vanskelig å karakterisere tuberkulinet. Det er derfor ulike oppfatninger om hva som er den aktive substansen. Mange tror at tuberkulinreaktiviteten utløses av en bestemt komponent, mens andre (inkludert undertegnede) mener at det er mange forskjellige antigener som bidrar til en positiv tuberkulintest.
Foranledningen til at tuberkulinprøven ble mulig i større skala, var at baron Clemens von Pirquet (1874 – 1929) beskrev en ny teknikk (2) som vi i dag kjenner som adrenalinpirquetprøven, etter modifikasjon av Johan Kloster (1901 – 77). Kloster viste at sensitiviteten ble økt ved å tilsette adrenalin. Senere er det kommet flere forskjellige teknikker for tuberkulinprøven, og mest utbredt er Mantoux’ prøve (3), som består i intrakutan injeksjon av tuberkulin. I Norge benytter vi fortsatt adrenalinpirquetprøven, som det eneste land i verden (4).
Frem til i dag har forbedringene av tuberkulinet vært relativt beskjedne. Spesifisitet og sensitivitet i dagens tuberkuliner er noe bedre enn for ”old tuberculin” (OT), som Koch preparerte. ”Old tuberculin” var i essens et autoklavert og inndampet kulturfiltrat. Det inneholdt en meget kompleks blanding av komponenter, både av protein-, karbohydrat- og lipidnatur. Koch benyttet et proteinrikt medium. Ganske snart gikk man over til syntetiske medier for å unngå irrelevante proteiner i tuberkulinpreparatene. I 1930-årene forbedret Florence Seibert (1897 – 1991) tuberkulinet ved å separere ut proteinene ved utfelling (5), fordi man visste at den aktive komponenten først og fremst lå i proteinfraksjonen. Dette tuberkulinet ble kalt PPD (purified protein derivate). Den viktigste forbedringen bestod i at det ble mindre variabilitet i styrken til forskjellige produksjonssatser, noe som ble erkjent som et tiltakende problem utover i 1920-årene. Etter dette skjedde forbedringene først og fremst på standardiseringssiden. Doseringen ble standardisert og man preparerte stadig større satser med PPD for å ha et bedre sammenlikningsgrunnlag. Denne standardiseringen nådde sitt høydepunkt på midten av 1950-tallet, da UNICEF i samarbeid med Statens seruminstitut i København preparerte en storsats med PPD, RT23, som skulle holde til 33 milliarder doser. Denne satsen er fortsatt i utstrakt bruk og har bevart sin potens gjennom mer enn 40 år (6), selv om det har vært noe diskusjon om dette.
Tuberkulinprøvens nytteverdi
Tuberkulinprøven er et svært godt hjelpemiddel for å spore smitte med tuberkelbasiller. For hver person som blir syk av primær tuberkulose, regner man gjennomsnittlig at 10 – 20 personer er blitt smittet. Bare et fåtall av de smittede blir med andre ord syke. Tuberkulinprøven er derfor et sentralt hjelpemiddel ved miljøundersøkelser som iverksettes ved nyoppdaget tuberkulose eller mistanke om tuberkulose i et sosialt miljø. Sensitiviteten er god, men spesifisiteten er ikke optimal, og positive utslag sees ved sensibilisering med atypiske mykobakterier. Etter hvert som tuberkulose er blitt sjeldnere hos oss, utgjør sensibilisering med atypiske mykobakterier en stadig større andel av positive testresultater. For å avklare slike situasjoner kan man benytte hudtesting med sensitiner. Sensitiner prepareres fra atypiske mykobakterier og fremstilles omtrent som tuberkulin. Utslagene blir da som regel kraftigst med sensitin fra den mykobakteriarten som forårsaket sensibiliseringen.
BCG (Bacillus Calmette-Guérin)-vaksinering representerer en annen ulempe, fordi BCG også forårsaker positive tuberkulintester. I USA har dette vært et hovedargument mot BCG-vaksinering. BCG-vaksinerte personer har imidlertid vanligvis et svakere utslag på tuberkulintesten. Ved tuberkulosesmitte hos BCG-vaksinerte vil man ofte få et omslag fra svak til kraftigere positiv reaksjon. Allikevel medfører BCG-vaksineringen problemer for overvåking og monitorering av tuberkulosesmitte i befolkningen. I og med at vi vaksinerer barna først ved 14 års alder, har vi i Norge benyttet muligheten til å overvåke smittesituasjonen ved utstrakt bruk av tuberkulintesting før vaksinering. Men hovedbegrunnelsen for BCG-vaksinering ved 14 års alder var at man så høyest frekvens av nysmitte i slutten av tenårene og ved overgangen til voksen alder, og siden man ikke visste hvor lenge vaksinen gav beskyttelse, valgte man denne praksisen.
En positiv tuberkulinprøve innebærer at pasienten har en immunreaksjon mot tuberkelbasiller. Det er imidlertid ikke noen entydig sammenheng mellom tuberkulinpositivitet og beskyttelse mot tuberkulose. Men man har tradisjonelt sett på konversjonsprosenten etter BCG-vaksinering som et viktig mål på vaksinens effekt, og dette er sannsynligvis en viktig indirekte indikator på vaksinens viabilitet og virulensegenskaper, som er så vesentlige for at den skal kunne gi beskyttelse.
Attenueringen av BCG og opprinnelsen til dens ulike stammer
Figur 1 viser utviklingen av BCG (7). BCG kommer fra M bovis og var opprinnelig isolert fra en tuberkuløs ku. Stammen ble kalt ”lait Nocard”. I 1908 begynte Albert Calmette (1863 – 1933) og Camille Guérin (1872 – 1961) den møysommelige prosessen med å svekke ”lait Nocard”, dette mente de å kunne gjøre ved å passere stammen hver tredje uke på et galle-potet-medium. Stammens virulens ble regelmessig undersøkt ved infisering av forsøksdyr. Til å begynne med observerte de en økning i virulensen, men allerede etter 14 passasjer observerte de en reduksjon. Etter 13 år og 230 passasjer erklærte de at de hadde en svekket stamme som ikke lenger var patogen for mennesker, som hadde bevart de immunstimulerende egenskapene og som de karakteriserte som et ”virus fixé”. Utover i 1920-årene var det heftige diskusjoner rundt BCG og om den kunne reverseres til sin virulente form igjen. Noen mente at det eksisterte en virulent subpopulasjon i BCG, men gradvis ble BCG allment akseptert.
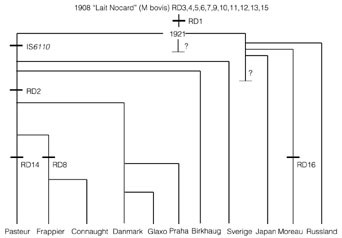
Figur 1 Historisk genealogi for BCG. Figuren viser et sannsynlig scenario for oppsplitting av den originale BCG-stammen. Figuren er basert på opplysninger fra Behr og medarbeidere (7), men er modifisert for å vise at fra 1921 ble BCG vedlikeholdt som tre atskilte stammer på Pasteur-instituttet i Paris. RD1-16 = delesjonsregion 1-16. IS6110 er deletert i BCG Birkhaug og BCG Sverige
I perioden 1924 – 27 ble BCG distribuert til mange forskjellige land og gav opphav til individuelle substammer, som ble vedlikeholdt i nasjonale BCG-laboratorier. Svenskene, russerne og japanerne var tidlig ute med å importere BCG. I Sverige hadde de sitt BCG-laboratorium i Göteborg. Konrad Birkhaug (1892 – 1980) fikk en avlegger av BCG i 1927. I 1930-årene arbeidet Birkhaug en periode på BCG-laboratoriet hos Albert Calmette (1863 – 1933) i Paris. Det ble produsert BCG-vaksine i Bergen i mange år. Denne produksjonen ble lagt ned i begynnelsen av 1970-årene, da man gikk over til å kjøpe vaksine fra Statens Seruminstitut i København. Den danske stammen, som fortsatt brukes til BCG-vaksinen i Norge, kom fra Pasteur-instituttet til København i begynnelsen av 1930-årene.
Etter som man fikk erfaring med BCG, ble man mer og mer bekymret for vaksinens stabilitet. For å motvirke en forringelse tok man i 1950- og 1960-årene i bruk ”seedlot”-systemet med frysetørket vaksine for å sikre at fremtidige produksjonssatser hadde gjennomgått et begrenset antall passasjer. Da dette ble innført, hadde imidlertid flere av BCG-stammene gjennomgått over 1 000 passasjer, og ytterligere delesjoner er påvist i noen av stammene.
Resultater av nyere forskning på BCG
Det genetiske repertoaret til BCG er mangelfullt sammenliknet med det som var opphavet, M bovis. ”Lait Nocard” gikk dessverre tapt under den første verdenskrig, men man kan i dag rekonstruere hva som har skjedd med BCG. Den første indikasjonen på delesjoner i genomet ble oppdaget da genet for MPT64, et viktig utskilt antigen (8), bare kunne påvises i omtrent halvparten av de undersøkte BCG-stammene (9). Denne delesjonen oppstod imidlertid etter attenueringen og er ikke til stede i de stammene som ble utlevert fra Pasteur-instituttet i årene 1924 – 27. Pasteur-stammen selv og senere avleggere fra Pasteur-stammen inneholder alle denne delesjonen. Man kan imidlertid ikke tidfeste delesjonen eksakt, fordi man i perioden 1921 – 32 vedlikeholdt tre atskilte stammer ved Pasteur-instituttet (10), inntil man på et tidspunkt terminerte to av stammene, muligens de to som ble distribuert til svenskene og russerne osv. MPT64-produserende BCG synes ikke å ha eksistert i Paris etter dette tidspunkt.
Den neste delesjonen som ble påvist, omfattet genet for ESAT-6 (11) som kanskje er ett av de aller viktigste antigenene i M tuberculosis (12) og som kan vise seg å bli ett av de antigenene som vi vil få aller størst nytte av i diagnostisk og epidemiologisk sammenheng i fremtiden (13). Genet for ESAT-6 er deletert i alle kjente BCG, og kodes for i en ca. 10 kilobaser stor region som kalles RD1 (delesjonsregion 1). Mahairas og medarbeidere (14) påviste fire delesjonsregioner i BCG ved sammenlikning med M tuberculosis, og med ytterligere påviste delesjonsregioner er det nå påvist til sammen 16 forskjellige delesjonsregioner i BCG (7). Mange omfatter alle BCG, mens noen omfatter bare enkelte av BCG-stammene. Det er imidlertid bare RD1 som er fraværende fra alle BCG-stammene og som samtidig er til stede i M bovis, og er så langt den eneste kjente forklaringen på hvorfor BCG ble svekket. Disse studiene viser at BCG virkelig stammer fra M bovis og at BCG umulig kan reversere til virulent form igjen fordi vesentlig genetisk materiale ikke er til stede. Det er påvist til sammen 70 gener i M tuberculosis som er konsekvent fraværende i BCG. Ni av disse ligger i RD1, og de øvrige er heller ikke til stede i virulent M bovis. På tross av disse forskjellene er de fleste påvisbare antigener i M tuberculosis også til stede i BCG. Noen viktige antigener gikk tapt gjennom delesjonen som ble påført gjennom attenueringen. Calmette & Guérins påstand om at de immunogene egenskapene var bevart, var derfor ikke fullstendig korrekt. Om fraværet av disse antigenene i BCG er vesentlig for å ha en mest mulig effektiv vaksine mot tuberkulose er ikke kjent, men repertoaret av antigener i BCG er meget stort, og det er der
for usannsynlig at fraværet av noen få antigener skal ha betydning for vaksineeffekten. Ikke desto mindre har man i dag en mulighet til å dra nytte av fraværet av visse gode antigener i BCG og M bovis. Dette er en helt ny situasjon som kan utnyttes til å monitorere tuberkulosesmitte i en BCG-vaksinert befolkning.
Utvikling av nytt spesifikt tuberkulin
Utviklingen i dag tilsier at nye tuberkuliner i fremtiden ikke vil bli basert på autoklaverte kulturer som utgangspunkt for produksjonen, men vil ha forankring i moderne bioteknologi. ESAT-6 ble opprinnelig påvist som antigen og renset fra kulturfiltrater som ikke hadde vært utsatt for varmebehandling. Nå kjenner vi sekvensen på genet som koder for proteinet og den eksakte lokaliseringen av genet i M tuberculosis-genomet (15). ESAT-6 er et relativt lite protein, men det har mange T-celleepitoper, og kan presenteres for T-celler ved hjelp av mange forskjellige vevstypeantigener, noe som er en viktig forutsetning for at dette proteinet skal kunne fungere som et tuberkulin i en genetisk heterogen populasjon. ESAT-6 er et spesielt godt antigen fordi personer med forskjellige vevstyper vil kunne gjenkjenne proteinet. Av stor betydning er det også at de fleste atypiske mykobakterier heller ikke har det homologe genet for ESAT-6 (unntakene er M kansasii, M marinum og M szulgai) (12). Nytt spesifikt tuberkulin vil derfor gi en betydelig bedre spesifisitet sammenliknet med tradisjonelt tuberkulin, men på grunn av en forventet lavere sensitivitet vil neppe dette proteinet alene kunne erstatte tradisjonelt tuberkulin, men bli et viktig supplement. Utviklingen av ESAT-6 er nå under klinisk utprøvning, og forventningen er at det vil komme på markedet i løpet av få år, noe som vil få stor betydning for tuberkulosekontrollen. Nytten av ESAT-6 vil være særlig stor i land med lav forekomst av tuberkulose, for å kunne skille mellom sensibilisering med atypiske mykobakterier og tuberkelbasiller, og ikke minst for å eliminere eventuell mistanke om BCG-induserte reaksjoner.
Norge bør gå over til Mantoux’ prøve
Norge er nå det eneste landet som benytter seg av adrenalinpirquetprøven. Forskjellige typer tester benyttes internasjonalt, men mest utbredt er Mantoux’ prøve. I lys av den ventede utviklingen bør Norge allerede nå gjøre de nødvendige forberedelser for å gjennomføre en overgang til ny tuberkulinprøve. Folkehelsa har tidligere i år behandlet spørsmålet om en overgang til Mantoux’ test og tatt saken opp i Smittevernrådet, hvorpå det ble sendt et problemnotat til Sosial- og helsedepartmentet. Der er saken nå til behandling.
Det er mange hensyn som må overveies i dette spørsmålet. Mantoux’ prøve er mer sensitiv og regnes også for å være mer kvantitativ, blant annet fordi man har bedre kontroll over mengde applisert antigen. En overgang innebærer imidlertid at det blir vanskeligere å sammenholde historiske måleresultater med nye måleresultater, og vil kreve sammenliknende undersøkelser og betydelig innsats med opplæring av implisert helsepersonell. På den annen side vil man ved en omlegging lettere kunne sammenlikne tuberkulinprøver utført i Norge med tuberkulinprøver utført i andre land. Med økende internasjonalisering er dette et viktig poeng.
Den tekniske siden bør kunne takles uten store problemer, i og med at injeksjonsteknikken for Mantoux’ prøve er den samme som benyttes ved BCG-vaksinering.
Tuberkulinet som benyttes til adrenalinpirquetprøven produseres i dag på Veterinærinstituttet i Oslo. Det fremstilles ved en metode som likner fremstilllingen av OT (old tuberculin), men med den forskjell at tuberkulinet er konsentrert ved ultrafiltrering istedenfor ved inndamping, noe som har en viss opprensningseffekt. Til Mantoux’ prøve skal man benytte PPD og man kan derfor ikke bruke det samme tuberkulinet som anvendes til adrenalinpirquetprøven. En overgang til Mantoux’ prøve vil derfor også innebære en omlegging av produksjonen ved Veterinærinstituttet.
Nytt spesifikt tuberkulin vil først og fremst bli fremstilt for Mantoux-teknikken og vil ikke bli tilgjengelig for adrenalinpirquetprøven. Siden man nå ser at utviklingen går i retning av at man vil få bedre og mer veldefinerte tuberkuliner, er det svært viktig at man gjør de nødvendige forberedelsene så tidlig som mulig. Realistisk sett kan man ikke forvente at nytt spesifikt tuberkulin vil kunne erstatte tradisjonelt tuberkulin (PPD) med det første, fordi sensitiviteten antakelig ikke blir optimal. Det vil imidlertid kunne bli et viktig supplement til bruk i utredningen av positive tuberkulintester.