Det er en gammel klinisk observasjon at det er interindividuelle og intraindividuelle forskjeller i respons på legemidler. Og, som vist i en tidligere artikkel, årsaken til slike forskjeller kan være betinget i farmakokinetisk og/eller farmakodynamisk variabilitet (1). Det er velkjent at for enkelte legemidler foreligger stor grad av farmakokinetisk variabilitet, dvs. variasjon i absorpsjon, fordeling, metabolisme og utskilling. At det for enkelte legemidler foreligger en større grad av farmakodynamisk variabilitet, er inntil nylig blitt viet mindre oppmerksomhet. Farmakodynamikk er læren om effektene av legemidler på individ, organ, vev, celler og molekyler. Med bruk av molekylærbiologiske metoder blir det stadig oftere mulig å beskrive det molekylære grunnlaget for farmakodynamisk variabilitet (2).
Noen gener som koder for disse angrepsmålproteinene, oppviser genetisk polymorfisme. Genetisk polymorfisme betyr at en monogen egenskap finnes i minst to fenotyper med tilsvarende genotype i en befolkning. Dette kan gi ulik funksjon og ulik sensitivitet for legemidler mellom individer som en vesentlig årsak til interindividuell variasjon (2). Organsykdom og påvirkning av ytre faktorer, herunder legemidler, kan dessuten bidra til intraindividuell variasjon. Figur 1 viser legemiddelangrepsmål som kan gi opphav til både inter- og intraindividuell variasjon i terapeutisk effekt og i bivirkninger.
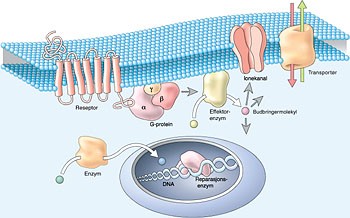
Figur 1 Angrepsmål for legemidler som gir opphav til interindividuell og intraindividuell farmakodynamisk variasjon. Nyere forskning har vist at både membranbundne reseptorer, G-proteiner og transportører oppviser genetisk polymorfisme og påvirkes av eksterne faktorer, slik som legemidler. Membranbundne cytosolære og DNA-bundne enzymer er påvirkelige av eksterne faktorer, mens andre inntil nå bare viser genetisk polymorfisme
Interindividuell variasjon
Når astmatikere har ulik respons på betaagonister, kan dette skyldes genetisk bestemt variasjon i sensitiviteten til betareseptorer (2). Varierende antipsykotisk respons på klozapin kan skyldes genetisk bestemt variasjon i serotoninreseptorer (2). Ulik respons på betablokkere hos pasienter med essensiell hypertensjon kan skyldes varierende uttrykk av G-proteiner (3). Variasjon i genuttrykket for reseptorer kan også ligge til grunn for at noen opplever bivirkninger, f.eks. er dopaminreseptorpolymorfisme koblet til forekomst av legemiddelinduserte tardive dyskinesier hos pasienter som får antipsykotika (2). En sjelden bivirkning, anestesiindusert hypertermi, er knyttet til polymorfisme i ryanodinreseptorgenet (2).
Eksemplene så langt er hentet fra det vi i streng forstand kaller legemiddelreseptorer. Men ulikt genuttrykk kan også gi variasjon i andre legemiddelangrepsmål, som f.eks. i ionekanaler. Arytmier og arytmier som forverres av legemiddelbehandling er knyttet til forekomsten av spesielle typer mutasjoner i gener for ionekanaler. Genet for kaliumkanaler kan ha mutasjoner som gir lang QT-tid, torsades de pointes (4).
Enzymer er en tredje type legemiddelangrepsmål. Disse kan være membranbundne, cytosolære eller kjernelokaliserte. Angiotensinkonverterende enzym (ACE) viser genetisk polymorfisme, og dette kan forklare den ulikhet i responsivitet på ACE-he mmere som er beskrevet i noen arbeider (2). O⁶-metylguanin – DNA-metyltransferase (MGMT) er en nøkkelfaktor i resistens mot alkylerende cytostatika, fordi fjerning av alkylgrupper ved MGMT-aktivitet forhindrer danningen av broer mellom DNA-tråder og dermed irreversibel DNA-skade og celledød. Hvorvidt dette enzymet var uttrykt i tumor eller ikke, viste seg å avgjøre om gliomer svarte på terapi med det alkylerende stoff carmustin (5). Det er også interessant at mekanismen for om genet er uttrykt eller ikke, per definisjon er epigenetisk, i dette eksemplet metylering av promotorregioner for genet for MGMT (5). Den fjerde type legemiddelangrepsmål, transportmolekyler, kan også være knyttet til genetisk polymorfisme. Varierende uttrykk av genet for serotonintransportør er satt i relasjon både til forekomst av depresjon og til respons på selektive serotoninreopptakshemmere (6).
Intraindividuell variasjon
Under pågående legemiddelbehandling sees både reseptordesensitivisering og reseptornedregulering. Behandling med betaagonister kan gi desensitivisering enten ved fosforylering av reseptorkomplekset, men med bibehold av antall reseptorer, eller ved nedregulering av antall betareseptorer. Fosforylering av G-proteinkoblede reseptorer er vist å føre til binding av regulatoriske proteiner, betaarrestiner. Desensitivisering av opioidreseptor ved gjentatt opioiddosering er avhengig av betaarrestin, men adenylatcyklaseaktiviteten oppreguleres også i dyr som mangler betaarrestin (7).
Legemiddelbehandling kan altså både påvirke reseptorenes antall, deres følsomhet gjennom koblingsprotein og det enzym som genererer budbringermolekyl (second messenger). Enzymer påvirkes av legemiddelbehandling. Det kanskje best kjente eksemplet på oppregulering av et cytosolært enzym er økningen av dihydrofolatreduktase under pågående behandling med metotreksat (8).
Praktiske konsekvenser
Den farmakodynamiske variasjon kan være betydelig. Blant pasienter med kroniske kreftsmerter var det en 120-gangers variasjon i oral dose og en 900-gangers variasjon i parenteral dose av morfin (9). Det meste av dette er sannsynligvis farmakodynamisk og ikke farmakokinetisk. Oftere ligger variasjonene på 5 – 20 ganger (9). En erkjennelse av at den farmakodynamiske variabiliteten kan være betydelig større enn den farmakokinetiske variabiliteten, gjør at legemiddelkonsentrasjonsmålinger i serum og terapeutisk område for den enkelte pasient noen ganger ligger langt utenfor det forventede. Tabell 1 gir eksempler på situasjoner der man bør mistenke farmakodynamisk variabilitet.
|
Tabell 1 Når bør man tenke på mekanismer for interindividuell og intraindividuell farmakodynamisk variasjon?
|
|
Ved ikke-forventet effekt på standarddose¹
|
|
Ved ikke-forventet effekt ved terapeutisk serumnivå
|
|
Ved doseavhengig bivirkning på standarddose¹
|
|
Ved doseavhengig bivirkning ved terapeutisk serumnivå¹
|
|
Kan også skyldes farmakokinetisk variasjon
|
Dosejustering basert på kliniske, biokjemiske eller fysiologiske mål er den første anbefaling man kan gi på generelt grunnlag. Seponering ved uakseptabel følsomhet en annen klar strategi. Den gamle kliniske regel å prøve ut ett legemiddel optimalt, før skifte til et tilsynelatende bedre, bør fortsatt gjelde. Veksten i kunnskapen om det humane genom og proteinene som det koder for, vil gi oss både mer kunnskap om molekylære mekanismer for variabilitet og også nye verktøy til laboratoriemessig å undersøke på dette.
En mikromatrise kan gi informasjon om den enkelte pasients uttrykk av gener med hensyn til farmakokinetikk og farmakodynamikk (2).
Det må forventes en strøm av publikasjoner som beskriver fenotypiske og genotypiske forklaringer for farmakodynamisk variabilitet. Dette vil være med og flytte fokus fra rent farmakokinetisk variasjon over til en kombinasjon av de to typer variabilitet. Optimal behandling vil forutsette god kjennskap til begge deler. Når man tenker på hvor tungt det har vært å selge budskapet om farmakokinetisk variabilitet, hvor vi har hatt gode kunnskaper i 30 år, er det da grunn til å tro at dette nye budskapet kommer til å slå igjennom? Ønsker og drivkrefter innen den farmasøytiske industri går vel mer i retning av at legemidlene skal passe for alle, uansett hvilken kinetikk eller dynamikk den individuelle pasient har, og at når optimal terapi ikke opptrer, skal man skifte til et nytt og dyrere medikament?
fakta
Genotype: Et individs genetiske konstitusjon i ett eller flere loci
Fenotype: Det observerbare uttrykket av en genotype – som et morfologisk, biokjemisk eller molekylært trekk
Promotor: Del av DNA-molekylet som er med på å regulere om et gen skal uttrykkes eller ikke
Metylering av promotor: Av-og-på-signal for uttrykk av gen
Spalten er redigert av Olav Spigset i samarbeid med Avdeling for legemidler ved Regionsykehuset i Trondheim og de øvrige klinisk farmakologiske miljøene i Norge