En pasient som ble innlagt i Sentralsykehuset i Akershus (nå Akershus universitetssykehus) i januar 1998 representerte et betydelig diagnostisk og terapeutisk problem. Pasientens sykehistorie ble senere presentert på et kasuistikkmøte ved Johns Hopkins University Hospital. Vi presenterer her sykehistorien og diskusjonen omkring sykdomsbildet.
EAS (E. Astrup Strand): En 35 år gammel aleneboende mann ble innlagt med mistanke om meningitt, etter å ha blitt funnet bevisstløs i sitt hjem med oppkast og diare…. Ved innkomst var han dypt soporøs, men reagerte på sterke smertestimuli. Han var ikke nakkestiv. Blodtrykket var 135/70, pulsen 106, respirasjonsfrekvensen 40/min og temperaturen 37,6 ˚C. Pasienten var ikterisk med lett neseblødning, men hadde ikke petekkier eller annet hudutslett. Han var alvorlig dehydrert med stående hudfolder, for øvrig var organstatus upåfallende. Hvilke tanker vil man som kliniker gjøre seg om denne pasienten?
Dr. R: Pasienten er takykard, men holder foreløpig et adekvat blodtrykk. Han har klinisk en septisk hyperdynamisk sirkulasjon med høyt hjerteminuttvolum, og han er presjokkert. Han hyperventilerer, enten pga. patologiske forhold i luftveiene, eller pga. svær metabolsk acidose med respiratorisk kompensasjon. Han har også symptomer fra flere organsystemer; fra lever/galleveier i form av icterus, men kan icterus også skyldes hemolyse? Han har affeksjon av sentralnervesystemet i form av betydelig redusert bevissthet, og gastrointestinal affeksjon i form av oppkast og diaré. Diabetisk ketoacidose må alltid være med i vurderingen når man har en dehydrert, hyperventilerende, uklar pasient. For å komme nærmere diagnosen trenger vi et bredt utvalg av laboratorieundersøkelser, som inkluderer arteriell syre-base-status og røntgen thorax. Dette er en pasient som må flyttes direkte til intensivavdelingen for væskebehandling og overvåking.
EAS: Arteriell blodgass undersøkt i mottakelsen med 3 l oksygen/min på nesekateter viste følgende verdier (normalområder i parentes).
-
pH 7,19 (7,35 – 7,45)
-
p CO2 2,1 (4,7 – 6,0 kPa)
-
p O₂10,2 (11,0 – 14,0 kPa)
-
HCO3 5,2 (22,0 – 26,0 mmol/l)
-
BE − 21,1 ( − 3,0 – +3,0 mmol/l)
Dr. R: Han har en uttalt metabolsk acidose som han forsøker å kompensere respiratorisk.
EAS: Resultatene fra andre blodprøver tatt i mottakelsen er fremstilt i denne tabellen (tab 1). Er det noen som vil kommentere funnene?
|
Tabell 1 Laboratorieverdier ved innkomst
|
|
Test
|
Verdi ved innkomst
|
Normalverdier
|
|
Hemoglobin
|
11,2
|
12,5 – 16,5 g/l00 ml
|
|
Trombocytter
|
5
|
150 – 450 ⋅ 10⁹/l
|
|
INR¹
|
1,2
|
0,8 – 1,2
|
|
D-dimer
|
8
|
< 0,3 mg/l
|
|
Bilirubin
|
115
|
3 – 25 µ mol/l
|
|
Kreatinin
|
692
|
70 – 125 µ mol/l
|
|
Urinstoff
|
51,5
|
2 – 8 mmol/l
|
|
Na
|
133
|
136 – 146 mmol/l
|
|
K
|
5,3
|
3,5 – 5,0 mmol/l
|
|
ASAT/ALAT
|
135/66
|
< 50 U/l
|
|
LDH
|
2 479
|
150 – 450 U/l
|
|
Amylase
|
481
|
70 – 350 U/l
|
|
Laktat
|
13,2
|
< 1,5 mmol/l
|
|
CRP
|
193
|
< 10 mg/l
|
|
Glukose
|
2,0
|
3,0 – 5,5 mmol/l
|
|
|
Dr. B: Nesten alle prøveresultatene er grovt patologiske. Han har hyperdynamisk sirkulasjon og multiorgansvikt: Det foreligger affeksjon av lunger, nyrer, lever, koagulasjons- og sentralnervesystemet. Sykdomsbildet et ganske typisk for alvorlig sepsis. Utgangspunktet kan vi foreløpig ikke identifisere.
Dr. C: I intensivmedisinen finnes det skåringsystemer som avspeiler hvor syk pasienten er og som sier noe om prognosen. Ble denne pasienten skåret etter noen av disse systemene?
EAS: Simplified Acute Physiology Score II (1) hos vår pasient var 86, svarende til en beregnet forventet dødelighet på 96 % ved maksimal intensiv behandling.
Dr. B: Foreløpig har vi ingen klar formening om hva som feiler denne pasienten. Med utfallene i leverprøvene kan han ha gallesepsis, men han kan også ha en hvilken som helst sepsis. Innleggelsesdiagnosen meningitt virker mindre sannsynlig.
Dr. T: Det kan være leptospirose! Jeg tenker alltid på det, men til dags dato har jeg bare sett én leptospirosepasient. Han kan også ha en fulminant hepatitt, på viralt, autoimmunt eller toksisk grunnlag, for eksempelt utløst av alkohol eller medikamenter.
EAS: Etter å ha fått laboratorieresultatene overveide vi ikke egentlig fulminant hepatitt, og pasienten ble flyttet til intensivavdelingen med diagnosen sepsis med ukjent utgangspunkt. Like før han ble flyttet fra mottakelsen ble han imidlertid kateterisert for 250 ml brunsvart urin, og fra hans husvert fikk vi overraskende opplyst at han hadde vært i Afrika for noen uker siden!
Dr. C: Listen over mulige differensialdiagnoser blir nå plutselig mye lengre, men øverst på listen seiler cerebral malaria med ”blackwater fever” og multiorgansvikt opp som en sannsynlig diagnose. Vi vet ikke hvor i Afrika han har vært, og heller ikke om han har brukt medikamentell malariaprofylakse. Sør for Sahara finnes det malariaparasitter som er resistente mot klorokin og en rekke andre medikamenter. Han kan således godt bli syk selv om han har fulgt alle råd og spist sin profylakse som foreskrevet.
Dr. T: Det kan også dreie seg om tyfoidfeber, viral encefalitt, eller kanskje afrikansk sovesyke, trypanosomiasis. Alle disse kan gi akutte febrile sykdomsbilder med påvirkning av sentralnervesystemet.
Dr. C: Han kan også ha en hemoragisk feber! Både Lassafeber, Rift Valley-feber og Ebola-feber kan gi et slikt bilde selv om icterus ikke er typisk. Han har neseblødning ved innkomst, riktignok har han ikke hatt noen store blødninger, men blodprøvene forteller at han har disseminert intravaskulær koagulasjon (DIC). Trombocyttverdiene er svært lave, og D-dimer, som er et fibrinnedbrytningsprodukt, er over null; dette indikerer fibrinolyse. At INR (International Normalized Ratio)-verdiene er innenfor normalområdet er ikke et argument mot at han har koagulopati. Det kan være at hans DIC er ganske nyoppstått og at INR ved neste prøvesett vil være patologisk lav.
EAS: Vi overveide selvsagt en rekke diagnostiske muligheter, deriblant hemoragisk feber. Det hastet imidlertid svært med å finne frem til riktig diagnose og eventuelt starte behandling. Hva må være neste skritt?
Dr. T: Jeg ville prioritere å undersøke en tykk og tynn dråpe for å se etter malariaparasitter. Blodkulturer er allerede tatt i mottakelsen, og skulle gi oppvekst av bakterier ved sepsis og tyfoidfeber. De virale hemo-ragiske febrene og encefalitt er kliniske eksklusjonsdiagnoser, som kun kan behandles symptomatisk. Trypanosomer kan vi finne i malariautstrykene og selvfølgelig i cerebrospinalvæsken hvis pasienten har sovesyke. Malaria er definitivt den mest sannsynlige diagnosen. Ubehandlet vil denne pasienten være død i løpet av meget kort tid.
EAS: Som foreslått ble det umiddelbart gjort malariadiagnostikk med undersøkelse av tykk og tynn dråpe. Vi fant at 12 % av erytrocyttene var infisert. Figur 1 viser tykk dråpe med mange typiske falciparum”ringer”. I figur 2 sees også en bananformet parasitt dvs. en gametocytt av Plasmodium falciparum. Sier dette noe om hvor lenge pasienten har vært syk?
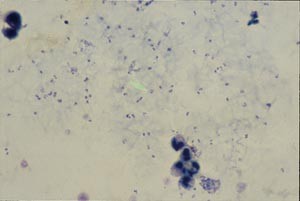
Figur 1 Tykk dråpe som viser stort antall P falciparum-ringer (trofozoitter)
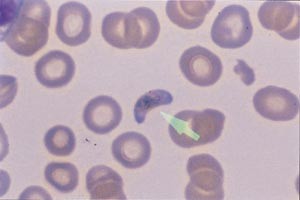
Figur 2 Tynn dråpe som viser bananformet gametocytt, som er diagnostisk for infeksjon med P falciparum
Dr. T: Bananformene opptrer aldri i begynnelsen av sykdomsforløpet. De trenger minst fem dager og oftest vel en uke på å utvikle seg. Pasienten har således mest sannsynlig vært syk i minst en uke forut for innleggelsen.
EAS: Vi fant opptil 5 – 6 ringformer av parasitten i enkelte røde blodceller. I figur 3 og 4 sees noen underlige parasittformer, som ingen av oss tidligere hadde sett ved falciparummalaria.
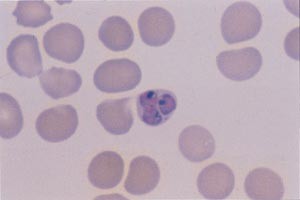
Figur 3 Tynn dråpe som viser erytrocytt infisert med tre trofozoitter. Slik trippelinfeksjon sees meget sjelden ved andre former for malaria. Bildet viser sene trofozoittstadier. Dette sees bare hos alvorlig syke pasienter, fordi erytrocytter med sene trofozoittstadier og schizonter vanligvis er adherente til endotelkapillarer og venuler
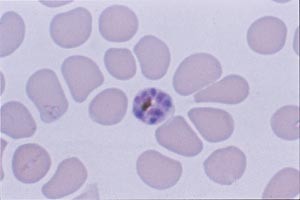
Figur 4 Schizont (eller preschizont) av P falciparum. Ved falciparummalaria ser man sjelden schizonter i perifert blod, og funn av schizonter er assosiert med alvorlig sykdom og dårlig prognose
Dr. C: Disse strukturene er nødt til å være sene trofozoitter (ringer) og schizonter av P falciparum i perifert blod. Schizonten er et resultat av at trofozoittene har formert seg aseksuelt, og opptrer helt i slutten av 48-timers syklus, like før erytrocyttene sprekker. Slike former som vi her ser, finnes ytterst sjelden i perifert blod ved falciparummalaria, da erytrocytter med parasitter som er kommet mer enn 24 timer ut i syklus, vanligvis er adherente til karendotelet i mikrosirkulasjonen. Funnet er prognostisk dårlig (2, 3).
Dr. R: Jeg er veldig nysgjerrig. Denne pasienten har jo en meget alvorlig komplisert malaria etter WHOs kriterier (4). Hva ble gjort med denne pasienten etter at han ble flyttet til intensivavdelingen?
EAS: Han fikk umiddelbart intravenøs behandling med kinin og doksycyklin, men ble raskt dårligere respiratorisk og sirkulatorisk. Han måtte få respiratorbehandling og trengte blodtrykkstøttende behandling i løpet av et par timer. Blodutskiftning ble gjennomført som revers aferese med åtte enheter erytrocyttkonsentrat over to timer ved hjelp av utstyr for plasmaferese. Revers aferese er en slags ”omvendt” plasmaferese, hvor pasientens erytrocytter fjernes og erstattes med friske erytrocytter, samtidig som plasma, blodplater og leukocytter føres tilbake til pasienten. Viktige data fra de første 12 timene i intensivavdelingen er skjematisk fremstilt i denne oversikten (fig 5). Er det noen kommentarer?
Dr. R: Etter initial forverring kommer det en betydelig bedring av hemodynamikk og acidose. Terapitiltakene er typiske for mange intensivpasienter hvor, som det fremgår av figuren, mye må gjøres samtidig. Det er vanskelig å trekke frem en enkel behandlingskomponent som spesielt vesentlig for den bedringen som inntrer i løpet av første behandlingsdøgn. Bedringen kan skyldes den intensive volumbehandlingen med nesten 10 l væske intravenøst det første halve døgnet, bruk av vasoaktive medikamenter og/eller behandlingen med respirator.
Dr. T: Men tilstanden forverres betydelig frem til start av blodutskiftningen, og ut fra figur 5 faller den hemodynamiske bedring tidsmessig sammen med aferesen. Det hadde kanskje vært en fordel om pCO2 hadde vært holdt litt lavere. En viss grad av hyperventilasjon ville kanskje begrenset det betydelige pH-fallet (acidosen) de første timene.
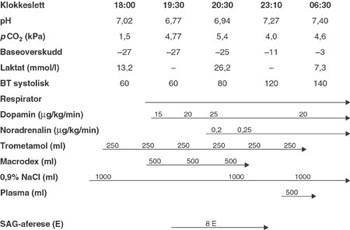
Figur 5 Oversikt over terapeutiske intervensjoner de første 12 timer av intensivbehandlingen. Pilene indikerer starttidspunkt og varighet av de enkelte intervensjoner. Infusjon av 0,9 % NaCl og trometamol var startet før ankomst til intensivavdelingen. Respiratorbehandling og administrasjon av vasoaktive medikamenter ble opprettholdt utover de første 12 timer
EAS: Jeg er enig i at han burde vært hyperventilert for å senke pCO2-nivået. Med hensyn til den øvrige behandlingen, har noen av dere synspunkter på hvilken rolle utskiftningstransfusjon har ved behandling av alvorlig malaria, og bør man gjøre ”full” blodutskiftning eller bare skifte ut erytrocyttene?
Dr. B: Det finnes mye litteratur som taler for at blodutskiftning kan være av betydning i behandlingen av alvorlig falciparummalaria (5, 6). Selv om gode kontrollerte kliniske studier mangler, er det umulig å se bort fra alle rapporter og ukontrollerte studier som indikerer gunstig effekt av utskiftningstransfusjon (7 – 10).
Dr. T: I høyendemiske områder ser vi at barn tolererer høygradig parasittemi godt pga. immunitet, men man må være forsiktig med å generalisere til andre pasientgrupper. Sammenhengen mellom grad av parasittemi og klinisk forløp har vært dokumentert i ca. 50 år (11). Ved klinisk alvorlig malaria vil derfor de fleste vurdere behovet for utskiftningstransfusjon i lys av Whites råd fra 1996 (12). Han anbefaler utskiftningstransfusjon hos pasienter med parasittemi> 15 % og kliniske komplikasjoner. I tillegg anbefales prosedyren til pasienter med parasittemi 5 – 15 % dersom det foreligger andre dårlige prognostiske tegn (tab 2). Parasittemiens grad kan imidlertid ikke være et kriterium alene, og dersom parasittemien er høy uten tegn til alvorlig organdysfunksjon, hypoglykemi eller acidose, kan man trolig avvente utskiftningstransfusjon (12).
|
Tabell 2 Funn assosiert med dårlig prognose ved P falciparum-malaria (3 – 5)
|
|
Klinisk
|
|
Forstyrret bevissthetsnivå
|
|
Gjentatte kramper (>3/24 t)
|
|
Hyperventilering
|
|
Blødning
|
|
Sjokk
|
|
Anuri
|
|
Icterus
|
|
Hypotermi (<36,5 ˚C)
|
|
Vedvarende hypertermi (>39 ˚C)
|
|
Biokjemisk
|
|
Forhøyet verdi av kreatinin (> 265 µ mol/l)
|
|
Forhøyet verdi av totalbilirubin (> 50 µ mol/l)
|
|
Acidose (pH< 7,3)
|
|
P-bikarbonat< 15 mmol/l)
|
|
Hyperlaktatemi (>5 mmol/l)
|
|
Forhøyede leverenzymverdier (> 3 ⋅ normal)
|
|
Hypoglykemi (<2,2 mmol/l)
|
|
Parasitologisk
|
|
> ca. 10 % parasittemi – høy dødelighet
|
|
> 20 % parasittemi – raskt økende dødelighet
|
|
> 20 % pigmentbærende trofozoitter og schizonter
|
|
> 5 % av nøytrofile granulocytter har malariapigment
|
Dr. W: Jeg vil gjerne understreke at ved alvorlig falciparuminfeksjon adhererer infiserte erytrocytter til karendotel, og at den patofysiologiske følgen av dette er redusert kapillær gjennomblødning, generell vevshypoksi og kapillarskade (4, 13 – 15). Dette forklarer mye av multiorgansvikten, den høye dødeligheten og alle ”underlige” symptomer som kan opptre ved alvorlig falciparummalaria. Molekylært skjer tilheftingen ved at falciparumantigener i erytrocyttmembranen interagerer med adhesjonsmolekyler på endotelcellene (13 – 15).
Dr. B: Selve grunntanken ved utskiftningsreaksjon er å fjerne de infiserte cellene som blokkerer mikrosirkulasjonen, men røde blodceller som allerede er adherente til endotel blir neppe fjernet.
Dr. C: Sannsynligvis er det viktig å fjerne både infiserte og uinfiserte røde blodceller ved alvorlig falciparuminfeksjon (12, 16). Også uinfiserte røde blodceller blir mindre deformerbare ved alvorlig falciparummalaria, og får problemer med å presse seg forbi adherente erytrocytter i kapillarer og venuler (16). Ferske erytrocytter vil imidlertid ha større deformerbarhet og bidra til å bedre mikrosirkulasjonen (17). Det virker også logisk å fjerne så mye som mulig av de tidlige parasittstadiene før de passerer over i cytoadherent fase.
EAS: Men hva skal man så velge; fullblodutskiftning eller kun erytrocyttutskiftning? Hos vår pasient oppnådde vi et fall i parasittemi fra 12 % til 2 % i løpet av et par timer ved å gjøre aferese med åtte enheter erytrocyttkonsentrat.
Dr. C: Ingen kan i dag si sikkert hva som er den beste behandlingsmetode. Begge prosedyrer gir oss mulighet for å redusere parasittemien dramatisk i løpet av et par timer, hvilket jo er fantastisk mye raskere enn hva man ser ved medikamentell terapi alene. Ved fullblodutskiftning vil man i tillegg kunne fjerne sirkulerende proinflammatoriske substanser uten at vi vet om dette betyr noe for pasienten.
Dr. T: De aller fleste sentre ville utført en form for blodutskiftning på denne pasienten da han hadde en rekke funn forenlig med dårlig prognose (tab 2). Det er antakelig også viktig at man bruker så ferske blodprodukter som mulig.
Dr. B: Hva skjedde videre med denne pasienten? Hva fikk han av behandling for øvrig? Pasienten har vitterlig et septisk bilde ved innkomst. I tillegg til malaria, kan han også ha en kompliserende bakteriell sepsis f.eks. sekundært til aspirasjon. Fikk han antibiotikabehandling?
EAS: Behandlingen han fikk, er fremstilt i denne tabellen (tab 3). Ressursbruken var omfattende med behov for langvarig respiratorbehandling, kontinuerlig nyrestøttende behandling og bruk av vasoaktive medikamenter. Han ble også behandlet med ceftazidim de første tre døgn inntil blodkulturene kom ut negative. Vi antar derfor at hans sepsistilstand var utløst av endotoksinliknenede substanser som for eksempel glykosyl-fosfatidylinositol fra parasittene (18). Disse kan ha samme patofysiologiske effekter som endotoksin fra meningokokker (18).
|
Tabell 3 Behandlingsoversikt
|
|
Behandling i intensivavdeling
|
30 d
|
|
Kinin + doksycyklin intravenøst
|
7 d
|
|
Aferese med erytrocyttkonsentrat
|
8 enheter
|
|
Kontinuerlig venovenøs hemodiafiltrasjon
|
28 d
|
|
Respirator21 d
|
|
|
Dopamin/noradrenalininfusjon
|
11/7 d
|
|
Transfusjoner med erytrocyttkonsentrat
|
28 enheter
|
|
Transfusjoner med trombocyttkonsentrat
|
8 enheter
|
|
Bredspektrede antibiotika (ceftazidime)
|
3 d
|
|
Sykehusopphold
|
40 d
|
Dr. W: Intravenøs behandling med kinin innebærer fare for hypoglykemi og kardiale arytmier bl.a. relatert til forlengelse av QT-tid og QRS-komplekset. Ved oppstart må metningsdosen reduseres eller unngås dersom pasienten nylig har brukt klorokin eller meflokin, hva valgte dere å gjøre?
EAS: Ved diagnosetidspunktet hadde vi ingen opplysninger om medikamentbruk. På grunn av pasientens kritiske tilstand valgte vi å gi full metningsdose med kinin. EKG var normalt før og under behandling. Vi var usikre på hvordan nyresvikten og hemodialysen/hemofiltrasjonen innvirket på serumkonsentrasjonene av kinin. Vi valgte derfor å gi halve doser fra fjerde døgn. Ut fra fortløpende vurdering av parasittemien var behandlingsresponsen med dette opplegget meget tilfredsstillende. Vi hadde ikke adgang til fortløpende målinger av serumkonsentrasjoner av kinin, men målinger som ble utført i ettertid viste verdier noe over anbefalt terapeutisk nivå.
Dr. T: Nå må vi få høre hvordan det til slutt gikk med pasienten.
EAS: Men først litt mer anamnese! Da pasienten etter 21 døgn kom til bevissthet, kunne han etter hvert fortelle følgende: Han hadde vært på landsbygden i Kenya i en knapp måned. Han hadde brukt klorokin og proguanil som medikamentell malariaprofylakse, men slapp opp for medisiner ti dager før hjemreise. Dagen etter hjemkomst ble han febril med frysninger. Han mente selv det kunne være malaria, som han hadde hatt flere år tidligere. I løpet av første uken etter hjemkomst oppsøkte han to ulike leger. Han angir selv at han gjorde begge legene oppmerksom på Afrika-reisen, at han selv mente det kunne være malaria, og at profylaksen hadde vært mangelfull. Han ble begge ganger hjemsendt med diagnosen influensa. Pasienten ble så funnet tilfeldig av sin husvert niende døgn etter symptomdebut i tilstanden som beskrevet ved innleggelsen. Til tross for den omfattende og i og for seg vellykkede malariabehandlingen, utviklet han betydelig sekvele i form av redusert mental kapasitet, moderat venstresidig hemiparese, blindhet på venstre øye på grunn av iskemisk atrofi av venstre n. opticus, og smertefulle avaskulære nekroser i begge lårbeinshoder. Han ble i 1999 operert med totalprotese i begge hofteledd og er nå 100 % ufør.
Diskusjon
Flere forhold gjorde at denne pasienten utviklet et så dramatisk sykdomsbilde. Han hadde vært i et område av Afrika hvor falciparummalaria er høyendemisk, og han burde under oppholdet selv ha vært mer nøye med å beskytte seg mot malaria. Da han fikk feber og andre symptomer, mistenkte han selv malaria, og det er beklagelig at han ikke tidlig i sykdomsforløpet ble henvist til adekvat diagnostikk. I de aller fleste tilfeller blir pasienter med denne problemstillingen umiddelbart henvist til sykehus, og det er derfor sjelden man ved norske sykehus ser kritisk syke malariapasienter. Den aktuelle sykehistorien er en ubehagelig, dramatisk påminnelse om de viktigste aspektene ved malaria.
Vi vet ikke hvorfor vår pasient ikke ble henvist til malariadiagnostikk de første sykdomsdagene, men vi finner grunn til å minne om at det på verdensbasis dør mange pasienter hvert år fordi leger med urette forventer at malaria alltid skal debutere som feberanfall etterfulgt av feberfrie intervaller av et par døgns varighet. Faktum er imidlertid at mange pasienter med falciparummalaria har helt uregelmessig feber tidlig i forløpet.
Vår pasient hadde ved innkomst et sykdomsbilde preget av sepsis med multiorgansvikt, og det var opplysningen om et nylig Afrika-opphold som førte til at malariadiagnosen raskt ble stilt mikroskopisk. Behandlingen måtte omgående rettes mot infeksjonen, men i tillegg var et omfattende behandlingsopplegg nødvendig (tab 3), i et utstrakt samarbeid mellom infeksjonsmedisinere, anestesiologer, nefrologer og immunhematologer.
Ved medikamentell behandling av alvorlig malaria kan man initialt velge mellom parenteral behandling med kinin (evntuelt kinidin) eller et artemisininderivat. Kinin til parenteralt bruk bør derfor finnes tilgjengelig ved alle sykehus. Artemisininderivater er ikke foreløpig registrert i Norge, men de mest aktuelle i en slik situasjon vil være artesunate intravenøst eller artemether intramuskulært (4). Selv om artemisininbehandling reduserer parasittemien raskere enn kinin, er dette ikke dokumentert å ha klinisk betydning (4).
Bortsett fra lungeødem og generaliserte krampeanfall, hadde vår pasient nesten alle akutte komplikasjoner som kan tilstøte pasienter med alvorlig malaria (4). Den omfattende intensivbehandling han fikk var, med unntak av erytrocyttutskiftningen, ikke vesentlig forskjellig fra behandlingen som blir gitt til mange alvorlig syke sepsispasienter med multiorgansvikt. Hvilken betydning erytrocyttutskiftningen hadde, vet vi ikke, men ut fra nåværende kunnskap om patofysiologien ved alvorlig malaria vil vi anbefale at en form for blodutskiftning blir gjort hos slike pasienter i henhold til publiserte retningslinjer ( 4, 12).
De alvorlige senfølger pasienten fikk, hemiparese, ensidig blindhet og bilateral caputnekrose, er meget sjeldne komplikasjoner og avspeiler pasientens kritiske tilstand ved innkomsten.
For oppdaterte råd mht. til malariaprofylakse og andre nyttige råd ved reiser overalt i verden, og spesielt tropene, anbefales bl.a. disse Internett-adresser:
-
1. www.cdc.govCenters for Disease Control and Prevention (CDC) i Atlanta, USA. Gå til: Health Information for International travel og klikk deg videre. Her finnes meget gode råd vedrørende profylakse, vaksinasjon etc. Oppdateres kontinuerlig og anbefales sterkt.
-
2. www.who.org International Travel and Health Information for råd til reisende.Litteratur
Se også kunnskapsprøve på www.tidsskriftet.no/quiz