Pasienten var en 48 år gammel kvinne med lett hypertensjon og moderate leddplager. Tidligere var hun operert på venstre side med radikal mastoidektomi grunnet kolesteatom. Hun var storrøyker (> 30 sigaretter per dag) med tendens til obstruktive luftveissymptomer.
Uken før innleggelsen ble pasienten forkjølet. Symptomene forverret seg gradvis med heshet, hoste og smerter i halsen, spesielt på venstre side. Hun begynte å få vansker med å svelge og oppsøkte legevakten på hjemstedet.
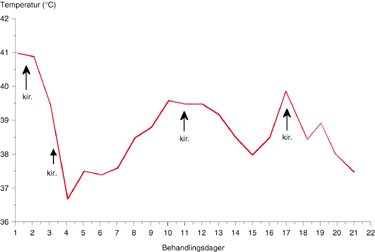
Figur 1 Variasjoner i kroppstemperatur de første tre ukene. Det ble foretatt kirurgisk revisjon (kir.) dag 1, 4, 11 og 17
Primærlegen noterte ingen objektive kliniske funn, og valgte derfor å vente med behandling.
I løpet av de neste to dagene ble tilstanden raskt forverret. Hun kunne ikke lenger svelge sitt eget spytt, og når hun la seg ned, var det vanskelig å puste.
Etter fornyet undersøkelse hos primærlegen ble pasienten henvist videre.
Ved ankomst Rikshospitalet var pasienten sterkt medtatt og presjokkert. Hun hadde svelgevansker med heshet og stridor, som forverret seg i løpet av de første timene i avdelingen. Det forelå en fast, lett erytematøs hevelse fortil på halsen over thyreoidea. Hevelsen strakte seg opp under kjevevinkelen til venstre, hvor hun var palpasjonsøm. Ved laryngoskopi fant man en venstresidig bukende hevelse parafaryngealt samt rubor i aryregionen. Det var nedsatt bevegelighet av stemmebåndet på venstre side. Temperaturen var over 40 oC, CRP 645 mg/ml, leukocytter 14 × 10⁹/l (fig 1, fig 2).
CT collum viste utbredt abscedering på halsen, mest på venstre side. I tonsillnivå bar dette preg av peritonsillær abscess med ødem i retrofaryngealrommet. Ødemet bredte seg langs bakveggen i oropharynx/hypopharynx med engasjement av submukøst rom på innsiden av tungebeinet. Abscederingen strakte seg langs fremkanten av thyreoidea og inn mellom muskellagene foran på halsen (fig 3 a, b, c).
Man mistenkte en begynnende nekrotiserende fasciitt, og pasienten ble operert umiddelbart.
Det ble lagt en bred incisjon over halsen i høyde med thyreoideabrusken. Mellom muskellagene på halsen, på innsiden av tungebein og larynxbrusk og opp mot tonsillosjen var det multiple lokulamenter med tynn, kjøttfarget og illeluktende væske. Store deler av m. sternohyoideus, m. thyrohyoideus og m. omohyoideus på venstre side var nekrotiske og ble fjernet. Det var også rikelig med illeluktende væske subkutant og i muskelvev fortil på brystet, hvor man la en langsgående incisjon til halvveis ned på sternum. Man lot sårområdene ligge åpne og la inn bølgedren. Ved direkte mikroskopi ble det funnet moderate mengder kokkoide bakterier i prøve fra sårvæske.
Dette funnet kunne indikere en infeksjon med streptokokker, men det kliniske bildet med tynn, illeluktende væske passet ikke helt. Mikroskopifunnet ble senere revurdert til kokkoide staver.
Da årsaken til infeksjonen ennå ikke var kjent, startet man med bredspektret antibiotikaterapi, penicillin-G 5 millioner ¥ 4, klindamycin 600 mg ¥ 4 og metronidazol 1 500 mg ¥ 1.
Postoperativt var pasienten septisk med temperatur omkring 41 oC (fig 1). Røntgen thorax viste bilaterale lungefortetninger som ved akutt respirasjonssviktsyndrom (ARDS). Sirkulasjonssvikt og respirasjonssvikt gjorde det nødvendig med vasopressorbehandling og respiratorbehandling med 100 % O₂ og respiratoriske trykk på opptil 39 cm vann med positivt endeekspiratorisk trykk (PEEP) på 10 cm vann. Initialt ble pasienten behandlet med dopamin inntil 10 g/kg/min i kombinasjon med noradrenalin i doser opptil 0,4 g/kg/min. Senere ble dopamin erstattet med adrenalin, og vasopressorbehandlingen kunne etter hvert reduseres. Pasienten fikk 15 l væske det første døgnet. Kreatininnivået var 204 ved ankomst og steg ytterligere. Da det oppstod anuri startet man opp med kontinuerlig hemodiafiltrasjon (PRISMA), som igjen kunne avsluttes etter tre døgns behandling. CRP falt første døgnet fra 625 til 329 mg/ml, men steg igjen til over 400 mg/ml (fig 2). Enzymverdiene steg de nærmeste dagene og hadde et muskelnekrosemønster, med CK på over 13 000 U/l og ASAT på 2 650 U/l (fig 2). ALAT, gamma-GT og bilirubin var stort sett normale.
Bakteriologisk dyrking fra sårvæske viste vekst av anaerobe bakterier, og ingen vekst av aerobe bakterier.
På bakgrunn av dette funnet og i påvente av videre identifisering og resistensbestemmelse ble antibiotikaregimet forandret.
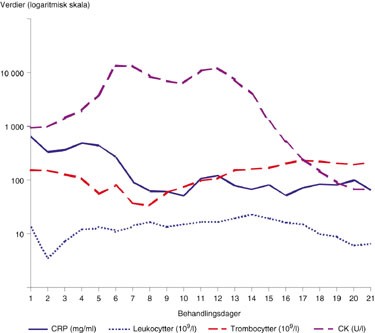
Figur 2 Variasjoner i CRP, leukocytter, trombocytter og CK de første tre ukene (logaritmisk y-skala)
Man startet opp behandling med antibiotikakombinasjonen meropenem, klindamycin og metronidazol. Det var oppvekst av anaerobe bakterier i sårsekret fra dag 1, men endelig identifisering av bakteriene lot seg ikke gjøre ved tradisjonelle biokjemiske tester.
Man avventet nå resultatet av DNA-DNA-hybridisering og 16S rRNA-sekvensering.
Røntgen thorax viste etter noen dager bilaterale basale lungefortetninger med pleuravæske. Det ble initialt tappet ca. 500 ml strågul aseptisk væske fra begge sider. På grunn av residiv av pleuravæske måtte man senere utføre ny tapping flere ganger i løpet av behandlingstiden.
Man lot sårene på halsen ligge åpne og skiftet kompresser daglig. Det var fallende temperatur (fig 1), men fortsatt høye CRP-nivåer, mellom 350 og 450 mg/ml, og svingende leukocyttverdier. Etter tre dager utviklet det seg nekrose i huden over brystet, og man gjorde derfor en omfattende eksisjon av affisert hud (fig 4). Etter dette falt CRP til under 100 mg/ml, og CK-verdiene gikk også ned. Leukocyttnivåene var imidlertid fortsatt høye og trombocyttverdiene fallende (fig 2).
Etter noen dager begynte pasienten å få stigende temperatur og økende CK-verdier, fra 6 000 til 10 600 U/l (fig 1, fig 2). CT-bilder tatt 11. behandlingsdag viste vedvarende inflammatoriske forandringer i tonsill/munngulv, og det var økende kontrastoppladning i m. sternocleidomastoideus på venstre side.
Kontrastoppladningen i vevet på halsen ble oppfattet som en indikasjon på aktiv infeksjon i området.
Det ble igjen foretatt kirurgisk opprensing, og venstre m. sternocleidomastoideus og venstre glandula submandibularis ble fjernet. Flere små pusslokulamenter ble funnet opp mot processus mastoideus og bakover på halsen mot m. trapezius. Etter inngrepet falt CRP til under 80 mg/ml.
Ved hjelp av DNA-DNA-hybridisering og 16S-rRNA-sekvensering var det blitt påvist Fusobacterium necrophorum og Peptostreptococcus micros i sårsekret fra dag 1. Begge bakterieartene var følsomme for penicillin, klindamycin, kloramfenikol og metronidazol, med lave MIC-verdier for alle medikamentene.
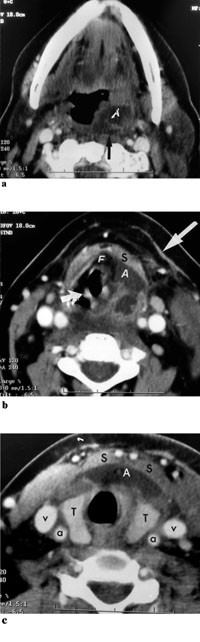
Figur 3 Kontrastforsterket CT hals gjort dag 1. a) Snitt i tonsillnivå viser abscedering submukøst på venstre side, og med utbredelse til retrofaryngeale rom (sort pil). Høyre tonsill er upåfallende. b) Snitt så vidt kaudalt for tungebeinet viser abscessutbredelse til larynx og hypopharynx (A). Fortil begrenses abscessen av strapmuskulaturen (m. sternohyoideus og m. thyrohyoideus) (S). Fettsjiktene preepiglottisk fylles ut av abscessen, og plica aryepiglottica er svært fortykket. Normalt preepiglottisk fett (F) fortil og på høyre side, og normal plica aryepiglottica (kort pil) på høyre side. Platysma er fortykket (lang pil), og det er ødem i fettvevet dypt for platysma. c) Snitt i nivå med skjoldkjertelen. Abscessutbredelse (A) ventralt for skjoldkjertelen (T) umiddelbart dypt for strapmuskulatur (S). Vena jugularis (v) og arteria carotis (a) er upåfallende. Ødem i venstre m. sternocleidomasteoideus (m)
Det stod nå klart at dette var en primær anaerob infeksjon, og man modifiserte antibiotikabehandlingen.
Man seponerte øvrige antibiotika og fortsatte kun med metronidazol. Etter totalt 16 dagers behandling begynte imidlertid pasienten igjen å bli dårligere, med stigende temperatur og forverret allmenntilstand (fig 1, fig 2). CT viste patologisk oppladning i muskelrester på halsen og bak i nakken fra processus mastoideus.
Mistanken om at det skulle være pasientens opererte øre som var infeksjonsfokus, ble avkreftet ved otomikroskopi.
Det ble for fjerde gang gjort kirurgisk opprensing. Man fjernet en del muskelrester og eksplorerte parafaryngealt og nedover mot thoraxaperturen langs rester av m. omohyoideus. Noen mindre pusslommer ble identifisert og drenert.
Etter 17 dager var pasienten fremdeles avhengig av respiratorstøtte, men klar og våken. Infeksjonen på halsen var begynt å bli bedre, og som ett ledd i mobiliseringen gjorde man nå trakeostomi slik at oraltuben kunne avvikles (fig 4).
Den første tiden avstod man fra å gjøre trakeostomi gjennom det sterkt infiserte vevet fortil på halsen for å unngå spedning av infeksjonen til mediastinum.
Etter 26 dager begynte eksponert vev å se normalt ut, og man kunne sekundærsuturere sårene. Defekter etter tidligere reseksjon ble dekket med delhudstransplantat fra låret. Det ble i denne sammenheng oppdaget at pasienten til tross for Fragmin og fysikalsk behandling hadde utviklet en dyp venetrombose i venstre underekstremitet. Fragmin-dosen ble økt til 200 IE per kg samtidig som man startet opp behandling med warfarin.
Pasienten var ved dette tidspunkt så svak at hun ikke kunne løfte armer eller bein. Man mistenkte først nevropati forårsaket av sykdommen, men dette kunne utelukkes ved nevrofysiologisk undersøkelse. Tilstanden ble oppfattet som muskelsvakhet og stivhet som følge av langvarig immobilisering. Pasienten fikk intensifiert fysikalsk behandling, og etter hvert ble det klart at hun også hadde innskrenket bevegelighet i store ledd, spesielt skuldre og hofter.
Innskrenkningen i bevegelighet var sannsynlig et sekvele etter septisk engasjement av leddkapslene.
Etter 30 dager begynte man respiratoravvenning og etter 35 dager kunne pasienten flyttes over til vanlig sengepost i øre-nese-hals-avdelingen. Ytterligere noen dager senere ble hun dekanylert. Pasienten ble senere overflyttet til rehabiliteringsavdeling, hvor man fortsatte med fysikalsk behandling i flere uker.
På bakgrunn av at sykdommen hadde vært såpass langvarig og fluktuerende i sitt forløp valgte man å fortsette med antibiotikabehandling over lengre tid.
Under hele mobiliseringen hadde pasienten en gjenstående væskende fistel på den siden av halsen der infeksjonen startet. Antibiotikabehandling med metronidazol ble seponert etter totalt tre måneder. Det var da fremdeles en liten tørr fistelåpning som lukket seg spontant etter enda noen uker. Pasienten fortsatte med fysioterapi i flere måneder etter at hun ble utskrevet fra øre-nese-hals-avdelingen.
Diskusjon
Anaerobe gramnegative bakterier inngår i vanlig human bakterieflora i rikelige mengder på slimhinner i munnhule, svelg, øvre luftveier, gastrointestinalkanal og vagina. Bakteriene er klinisk betydningsfulle som opportunister i forbindelse med kirurgi, traume og blandede infeksjoner (1). Mange anaerobe bakterier er imidlertid sterkt følsomme for oksygen og overlever derfor ikke transporten til laboratoriet. Det er således grunn til å mistenke betydelig underdiagnostikk av anaerobe infeksjoner, ikke minst i øre-nese-hals-området.
Klassifikasjonen av obligat anaerobe gramnegative staver har historisk sett vært både vanskelig og kontroversiell. De stavformede bakteriene, basiller, ble fra første halvdel av 1900-tallet inndelt i to genus: De fusiforme (spindelformede staver som smalner av mot endene, av latin fusus: spindel, tein), kalt Fusobacterium (2) og de ikke-fusiforme, kalt Bacteroides (gresk bacterion: stav; gresk idus: form) (3). Den opprinnelige klassifikasjonen var basert på morfologi, men i den senere tid har moderne laboratorieteknikker som DNA-DNA-hybridisering og 16S rRNA-sekvensering modifisert inndelingen. Grovt sett regner man i dag fire genus av obligat anaerobe gramnegative staver: Fusobacterium, Bacteroides, Prevotella og Porphyromonas. Alle fire slektene inngår i familien Bacteroidaceae (4).
En av de mest virulente bakterieartene i familien Bacteroidaceae er Fusobacterium necrophorum subsp. funduliforme (synonyme navn: Schmorls bacillus, Bacillus funduliformis, Sphaerophorus fundiliformis, Bacteroides fundiliformis, Bacillus thetoides, Bacteroides diphteriae vitulorum, Actinomyces necrophorus).
F necrophorum er strikt anaerob, ikke-motil og ikke sporedannende. Den ble først kjent for å forårsake nekrotiske infeksjoner hos dyr, f.eks. kalvedifteri (5). Ved en spontan epidemi med F necrophorum blant kaniner i et forsøkslaboratorium kunne den tyske patologen Schmorl i 1891 i detalj karakterisere sykdomsforløpet, som viser likhetstrekk med det vi ser hos mennesker. Samme år ble bakteriene beskrevet som årsak til leverabscesser hos dyr i Danmark (6).
Det ble i begynnelsen av det 20. århundre rapportert om alvorlige tilfeller av infeksjon med anaerobe bakterier hos mennesker (7). Flere forfattere beskrev anaerobe abscesser som utviklet seg til septikemi med høy mortalitet. I Lægebog for norske hjem (8) advarte professor M. Greve ved Rikshospitalet: «Overladt til sig selv vil den [anaerobe abscessen] kunne udbrede sig i de omgivende løse Bindevævslag og, idet den følger disse, finde Vei til at aabne sig indad og derved bli farlig.» Akkurat som i dag var halsinfeksjoner ofte et utgangspunkt. Et av de større pasientmaterialer som ble publisert i engelskspråklig faglitteratur kom i Lancet i 1936 (1). Forfatteren, franskmannen André Alfred Lemierre (1875 – 1956), var professor i bakteriologi og infeksjonssykdommer ved Hôpital Claude Bernard i Paris, hvorfra han beskrev 20 tilfeller med abscederende septisk anaerob sykdom. De fleste av pasientene hadde oppvekst av B funduliformis (F necrophorum) alene eller i kombinasjon med andre anaerober, særlig anaerobe streptokokker. Etter publikasjonen i 1936 har infeksjoner med F necrophorum vært knyttet spesielt til Lemierres navn (9 – 14).
Fusobacterium necrophorum subsp. funduliforme produserer flere virulensfaktorer, så som hemagglutinin, hemolysin, leukocidin og lipase og forårsaker aggregering av trombocytter (fig 2), hemolyse, intravaskulær koagulasjon, vevsnekrose og nedsatt leukocyttmigrasjon. Det oppstår ofte en tromboflebitt i affisert område, og tromboseringen kan spre seg til større vener, som v. jugularis interna. Bakgrunnen for hvorfor necrobacillose oppstår i det enkelte tilfellet er fremdeles ikke klarlagt.
I den preantibiotiske æraen rammet necrobacillose ofte unge voksne. Den kunne av og til opptre som en lokal epidemi, men var oftest en septisk komplikasjon til andre infeksjoner. I sin artikkel skrev Lemierre (1): «Such septicæmias tend to arise
-
From inflammatory lesions of the nasofarynx
-
From similar lesions of the mouth and jaws
-
In connection with otitis media or mastoiditis
-
From purulent endometritis following parturition
-
From appendicitis
-
From infections of the urinary passages…»
Lemierre rapporterte en letalitet på 90 %. Typisk for det kliniske bildet var at pasienten etter noen dager med svelginfeksjon fikk økende hevelse lateralt på halsen og stigende temperatur med frysninger og uttalt leukocytose. Septisk embolisering til luftveiene med infarkt av lunger og pleuraeksudat var vanlig. Det var også vanlig med embolisering til store ledd, med septisk artritt som følge. Mange pasienter døde i løpet av 1 – 2 uker, men det ble også beskrevet tilfeller med protrahert og fluktuerende forløp. Noen av pasientene i Lemierres materiale døde først etter 4 – 6 ukers sykdom.
Behandlingen ved nekrobacillose er langvarig intravenøs antibiotika rettet mot anaerobe bakterier. F necrophorum er følsom for penicillin, klindamycin, metronidazol og kloramfenikol. Effekten av cefalosporiner, erytromycin og tetrasykliner er usikker.
I vårt tilfelle så det ut til at kirurgisk debridement hadde stor betydning for den kliniske tilstanden (fig 1, fig 2). Det skal i denne sammenheng nevnes at trombosering av v. jugularis interna ofte blir beskrevet som en del av Lemierres syndrom. I Lemierres artikkel blir det nevnt at man ved å ligere v. jugularis interna i noen tilfeller kunne forhindre spredning av infeksjonen fra det peritonsillære rommet. Vi avstod fra dette, da det i vårt tilfelle ikke var radiologiske tegn til trombosering av venen (fig 3).
Analogt med hva som opprinnelig ble beskrevet av Lemierre, hadde vår pasient kliniske symptomer som kunne passe med septisk sykdom med metastasering til lunger og store ledd. Det faktum at det var oppvekst av F necrophorum og P micros i sårvæske, men ikke i blodkulturer, er sannsynligvis en følge av at behandling med antibiotika i store doser ble startet på et relativt tidlig tidspunkt. Det var heller ikke oppvekst av bakterier i pleuravæske. Det er interessant at vår pasient var operert med radikal mastoidektomi på samme side hvor hun senere utviklet fokus for anaerob abscedering. Det var imidlertid ingen forandringer på CT eller kliniske tegn som kunne tale for at infeksjonen i dette tilfellet skulle ha utgått fra øret, noe som ellers er blitt rapportert (1, 15, 16).

Figur 4 Dag 19. Bildet viser hudreseksjonens omfatning foran på brystet. Et dren er lagt inn under gjenværende m. sternocleidomastoideus på høyre side. Venstre sides muskel er fjernet. Pasienten har en forlenget Portex nr. 8 med justerbar krage, for å avlaste omkringliggende vev
Konklusjon
Nekrobacillose eller postanginal sepsis er en alvorlig komplikasjon til infeksjoner innen øre-nese-hals-området. Sykdomsbildet karakteriseres av anaerob abscedering med vedvarende høy feber og multiple metastatiske abscesser, først og fremst til lungene. F. necrophorum er den mest aggressive av de kausale agenser, alene eller i kombinasjon med andre anaerobe bakterier. Når nekrobacillose-infeksjonen fører til trombosering av større vener, f.eks. v. jugularis interna, benevnes dette Lemierres syndrom (1). Det er sannsynlig at tidlig innsettende behandling med antibiotika kan begrense den anaerobe infeksjonen og dermed forhindre utvikling av tromboser. Som det fremgår kan det kliniske bildet være meget dramatisk, og historisk sett har nekrobacillose en høy letalitet. Det er viktig med langvarig antibiotikabehandling, og indikasjonen for ev. kirurgi må vurderes i hvert enkelt tilfelle.