Pyridoksinavhengige krampar er ein autosomalt recessiv arveleg stoffskiftesjukdom som fører til alvorlege, langvarige krampar som ikkje kan kontrollerast med konvensjonelle antiepileptika. Tilførsel av pyridoksin (vitamin B₆) i farmakologiske dosar er einaste måten å stoppe krampane på. Sjukdomen vart først beskriven i 1954 (1). Sidan er omkring 100 tilfelle beskrivne (2). Diagnosen vert ofte stilt seint, noko som kan føre til død eller utvikling av hjerneskade.
Pasienten. Jente, fødd i Noreg i 1993 av friske, ubeslekta foreldre av kosovoalbansk opphav. Ein to år eldre bror er frisk og normalt utvikla. Mor var frisk i svangerskapet. Ukomplisert fødsel etter 34 vekers svangerskap. Fødselsvekt 2 060 g, lengde 43 cm, hovudomfang 30 cm. Apgarskåre 9 etter eitt og fem minutt. 15 minutt etter fødselen fekk ho rykkingar i armar og bein og avgang av tyntflytande mekonium. Det var ingen ytre misdanningar og normal organstatus elles. Rykkingane stoppa etter diazepam rektalt. Supplerande undersøkingar viste ingen teikn til bakanforliggjande tilstand som kunne forklåre krampane. EEG var normalt. Ho fekk krampeprofylakse med fenemal i fire dagar og heldt seg krampefri.
Ho heldt seg krampefri fram til knapt tre månaders alder, då ho fekk eit generalisert krampeanfall. Dette var innleiinga til sju månader med hyppige, til dels intraktable krampar, både generaliserte tonisk-kloniske og infantile spasmar. Ho vart behandla for infantile spasmar med ACTH og prednison etter vanlege retningsliner og fekk seinare antiepileptisk medikasjon med valproat, klonazepam og vigabatrin i adekvate dosar, utan effekt. Ho hadde sju episodar med status epilepticus og var i periodar innlagd i intensivavdeling, der ho fekk krampestoppande middel som infusjon i inntil 12 døgn samanhangande. Situasjonen var livstrugande og desperat.
Vel ti månader gamal vart ho overflytta til Rikshospitalet. Ho var komatøs ved innlegginga. EEG var markert patologisk. Cerebral MR viste auka væske over båe frontal- og temporallappane. Det supratentorielle ventrikkelsystemet var litt markert. Corpus callosum var utvikla i heile lengda, men var tynnare enn forventa for alderen. Myeliniseringsgraden var normal (fig 1). Under eit langvarig krampeanfall fekk ho pyridoksin 100 mg intravenøst, og krampane stoppa etter 20 – 30 minutt. Ho vart sett på pyridoksin 100 mg dagleg i tillegg til valproat, klonazepam og vigabatrin.
Ho har seinare stått på pyridoksin fast, og andre antiepileptika vart etter kvart seponerte. Pyridoksindosen har vorte auka stegvis. Viktigaste grunn til doseauke har vore anfall, både generaliserte og partielle. Det har vore naudsynt med høge pyridoksindosar, opptil 23,5 mg/kg/døgn. Ho får no 560 mg/døgn eller 12,7 mg/kg/døgn, er anfallsfri, og EEG er normalt. Det er ikkje funne kliniske eller elektrofysiologiske teikn på nevropati. Foreldra har ikkje våga å prøveseponere pyridoksin.
Etter start av pyridoksintilførsel byrja ei rask motorisk og mental utvikling. Ho kunne gå ved 18 månaders alder. Ved 16 månaders alder hadde ho enkeltord, 37 månader gamal 5 – 6 ords setningar. Frå 3 1/2 års alder vart det observert problem med balanse og grovmotorikk. Ho vart reinsleg og tørr i fireårsalderen. Hovudomkrinsen låg i seks månaders alder 1 cm under 2,5-percentilen, under pyridoksinbehandling auka han gradvis til 25-percentilen. Cerebral MR var normal ved vel åtte års alder (fig 2). Fem år og åtte månader gamal viste ein ikkje-verbal evnetest samsvar mellom kronologisk alder og mental utvikling. Ho går no i vanleg skule og fylgjer klassetrinnet sitt. Men ho har slite med språklege og matematiske omgrep – lese-, tal- og mengdeforståing.
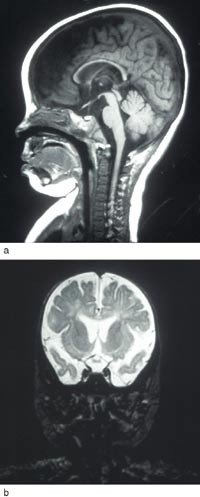
Figur 1 a) Sagittal T1-vekta sekvens ved vel ti månaders alder. Corpus callosum er tynn, men er utvikla i heile lengda. b) Koronal T2-vekta sekvens. Det er auka væske over frontal- og temporallappane bilateralt, dessutan markerte supratentorielle ventriklar
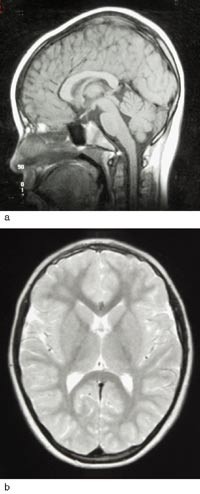
Figur 2 a) Sagittal T1-vekta sekvens ved vel åtte års alder. Corpus callosum er heilt normal. b) Aksial T2-vekta sekvens. Normalt ventrikkelsystem, overflaterelieff, grå og kvit substans
Definisjonar og klassifikasjonar
Diagnosen pyridoksinavhengige krampar kan stillast sikkert hjå nyfødde, sped- og småborn med residiverande krampeanfall som stoppar innan 30 minutt etter intravenøs tilførsel av ein adekvat pyridoksindose. Krampane residiverer etter seponering, men stoppar etter ny pyridoksintilførsel. Som sannsynlege tilfelle reknar ein dei med pyridoksinresponsive krampar som har affiserte sysken. Til same gruppe høyrer tilfelle av neonatale krampar der pasienten har respondert på ein enkeltdose pyridoksin og får krampar igjen, og der pyridoksin er effektivt enda ein gong. Mogelege tilfelle vert definert som ovanfor, men utan formelt seponeringsforsøk (3). Dersom foreldra nektar seponering, som hjå vår pasient, vert det hevda at diagnosen likevel kan stillast (4).
Epidemiologi
I Storbritannia og Irland er det med ovanståande klassifikasjon funne ein prevalens av sikre og sannsynlege tilfelle under 16 år på omkring 1 : 700 000. Tidlegare var det i Nord-England påvist ein prevalens av sikre tilfelle på minst 1 : 100 000. Forfattaren kunne ikkje forklåre den høgare prevalensen i dette området (5). Ved eit tysk senter der pyridoksin er ein del av rutineprotokollen for behandling av neonatale krampar, er frekvensen av sannsynlege tilfelle funnen til å vere 1 : 20 000 nyfødde (6). Dette kan tale for at tilstanden kan vere underdiagnostisert i område der leitinga etter denne sjukdomen er mindre systematisk.
Kliniske symptom
Kardinalsymptomet er krampar som ikkje kan stoppast med konvensjonelle antiepileptika. Likevel kan det kliniske biletet vere ganske variabelt, slik at ein talar om klassiske og atypiske tilfelle. Epidemiologiske studiar i Storbritannia og Irland viste at to tredelar kunne klassifiserast som klassiske (5), medan andre hevdar at atypiske tilfelle kan vere vanlegare (4). Den klassiske typen debuterer med tidlege krampar, intrauterint eller i nyføddperioden, og responderer raskt på intravenøs pyridoksintilførsel med krampestopp og EEG-normalisering under eller kort tid etter injeksjonen. Bortimot ein tredel av pasientane med debut i nyføddperioden hadde kliniske teikn på fødselsasfyksi eller hypoksisk-iskemisk encefalopati (5). I atypiske tilfelle kan debuten kome seinare, inntil tre års alder (2), og initialt kan det vere effekt av konvensjonelle antiepileptika (4, 7). Tilstanden kan manifestere seg i mange ulike krampetypar, som myoklone og atoniske anfall, partielle og generaliserte krampeanfall eller infantile spasmar, som hjå vår pasient. Ofte oppstår periodar med anfallsopphoping eller status epilepticus. Mange har før anfall ein periode med oppkast, uro og irritabilitet, særleg for lydstimuli. Det er stort samsvar i debutalder hjå affiserte sysken i same familie.
Diagnostikk
Pyridoksinavhengige krampar er ein klinisk diagnose basert på responsen på pyridoksintilførsel. Det mest vanlege er å gje 50 – 100 mg intravenøst under pågåande krampar, ein svært påliteleg og reproduserbar test (7). Krampane kan då gå over på 2 – 4 minutt, medan EEG kan normaliserast på 2 – 6 minutt. Men unormalt EEG 48 timar etter testdosen er beskrive (4). Hjå vår pasient gjekk det 11 veker etter pyridoksinstart før EEG var normalisert. Dersom det etter ti minutt ikkje kjem betring klinisk eller i EEG, kan det gjevast tillegg på 100 mg pyridoksin om gongen inntil 500 mg (7).
Det beste tidspunktet for seponeringsforsøk for å stadfeste diagnosen er truleg omkring fire års alder (3). Krampane kan i dei fleste tilfelle residivere mindre enn fire dagar etter seponering. Hjå pasientar med sein debut kan det gå opptil seks veker før residiv (3).
Vår pasient er oppfatta som eit atypisk tilfelle på grunn av initialt god effekt av diazepam. Dessutan var ho krampefri i ein relativt lang periode utan antiepileptika, og EEG vart normalisert først etter 11 vekers pyridoksinbehandling. Ho har hatt periodar med afebrile krampar som har gått over etter auke av pyridoksindosen. Det har vore naudsynt med høgare pyridoksindosar enn det som vert tilrådd (8, 9).
Det finst ingen diagnostiske laboratorietestar. EEG kan vise teikn på diffus og fokal cerebral dysfunksjon, men ingen spesifikke mønster (4). Cerebral CT og MR har vist uventa høg prevalens av strukturelle defektar i sentralnervesystemet, men ingen typiske abnormitetar. Det er funne varierande grad av atrofi av grå og kvit susbstans og tynn corpus callosum, som hjå vår pasient, likeins cerebellar hypoplasi og mega cisterna magna (8, 10). Inadekvat pyridoksinbehandling synest å kunne medføre progredierande atrofi av grå og kvit substans (10).
Behandling
Når diagnosen pyridoksinavhengige krampar er stilt, må pasienten ha livslang peroral pyridoksinbehandling. Konvensjonelle antiepileptika bør seponerast gradvis. Det er stor variasjon i minste effektive pyridoksindose. Det er beskrive ein pasient som vart krampefri på 0,5 mg/døgn i form av eit multivitaminpreparat (11), men dose over 500 mg/døgn er beskrive (2), som hjå vår pasient. Normalt dagsbehov for spedborn er 0,5 mg, for vaksne 2 mg (2). Det er observert assosiasjon mellom døgndose i mg/kg og intellektuell utvikling. Det har difor vorte tilrådd å dosere pyridoksin etter resultat av IQ-testing (9). Under akutte tilstandar med gastroenteritt eller feber kan behovet auke og krampar oppstå, noko som skjedde med vår pasient. Det vert tilrådd å auke pyridoksindosen til den akutte perioden er over (3, 7). Gravide kvinner som tidlegare har født eit barn med pyridoksinavhengige krampar, bør få tilskot av pyridoksin i siste halvpart av svangerskapet (12).
Biverknader
I samband med pyridoksininjeksjon under krampeanfall kan det i enkelte tilfelle oppstå depresjon av cerebral aktivitet og respirasjon som kan krevje akutt behandling (2, 4). Etter inntak av store pyridoksindosar gjennom lengre tid kan det oppstå sensorisk nevropati på hender og føter. Inntak av 15 mg/kg/døgn er truleg trygt for pasientar som veg 30 kg og mindre (2). Pasienten må difor fylgjast nøye med tanke på slike biverknader. Vår pasient har ikkje utvikla symptom eller teikn på nevropati, sjølv om ho har fått dosar på over 15 mg/kg/døgn i seks år.
Prognose
Ubehandla døyr pasienten i ein alvorleg krampetilstand. Alderen ved dødstidspunktet hjå 31 ubehandla pasientar varierte mellom to dagar og 16 månader, gjennomsnittleg 3 1/2 månad (13). Prognosen ser ut til å vere betre hjå dei som debuterer etter ein månads alder (3). Det synest å vere ein viss samanheng mellom prognosen og tidsromet frå krampedebut til behandlingsstart. Ved tidleg krampedebut er meir enn ei vekes behandlingsutsetjing assosiert med aukande fare for utvikling av lærevanskar og cerebral parese. Vår pasient illustrerer at prognosen kan vere god når pyridoksindoseringa er adekvat, sjølv om behandling vart starta relativt seint. I eit nordengelsk materiale med seks pasientar lærde borna å gå då dei var mellom 12 og 40 månader gamle, og dei byrja å tale då dei var mellom 12 og 36 månader. Ingen utvikla cerebral parese, men dei fleste hadde ekspressive språkvanskar, men relativt intakt språkforståing. IQ varierte frå under 50 til 90 (8). Dersom pyridoksintilførselen er for låg eller uregelmessig, kan det oppstå hjerneatrofi og forseinka utvikling av alvorleg grad (10). Utviklinga hjå vår pasient kan tyde på at høg pyridoksindose kan føre til ei positiv utvikling, bedømt både klinisk og etter cerebral MR (fig 1, fig 2).
Biokjemi og genetikk
Den genetiske feilen og dei biokjemiske mekanismane som fører til krampar, er ukjende. Det er gjort mange observasjonar og eksperimentelle undersøkingar som tyder på nedsett aktivitet av enzymet glutaminsyredekarboksylase, GAD, der pyridoksin i den aktive forma pyridoksalfosfat fungerer som koenzym (2). Enzymet finst i to isoformer: GAD65, koda av genet GAD1, og GAD67, koda av genet GAD2. GAD katalyserer danninga av gammaaminosmørsyre (GABA), ein hemmande transmitter, frå glutamat, som er ein eksitatorisk transmitter. Resultatet av nedsett GAD-aktivitet skulle då verte nedsett konsentrasjon av GABA og auka konsentrasjon av glutamat, og dermed auka eksitabilitet og krampetendens. Dei biokjemiske reaksjonsvegane med involverte enzym er skisserte i figur 3.
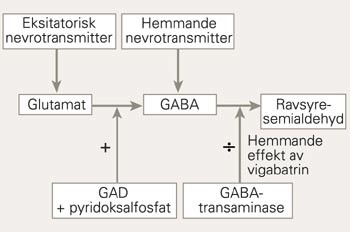
Reaksjonsvegen for danning av gammaaminosmørsyre (GABA) frå glutamat, katalysert av glutaminsyredekarboksylase (GAD) med pyridoksalfosfat som koenzym. GABA vert omdanna til ravsyresemialdehyd av GABA-transaminase, som vert irreversibelt hemma av vigabatrin
Det antiepileptiske midlet vigabatrin verkar ved å hemme enzymet GABA-transaminase og dermed nedbrytinga av GABA, slik at konsentrasjonen av GABA i hjernen aukar (14). Teoretisk skulle dette kunne redusere krampetendensen ved pyridoksinavhengige krampar. Men vigabatrin var utan effekt hjå vår pasient. Dette kan tale for at nedsett GABA-konsentrasjon i hjernen ikkje er heile forklåringa på krampetendensen ved denne tilstanden.
Nyare genetiske studiar har heller ikkje vist kopling mellom GAD og pyridoksinavhengige krampar (15). Derimot er det vist at eit gen som er kopla til pyridoksinavhengige krampar, er lokalisert til kromosom 5q31. Genet og genproduktet er enno ukjende. Genet GAD1 er lokalisert til kromosom 2q31 og GAD2 til kromosom 10p23 (16).
Konklusjon
Pyridoksinavhengige krampar er ein sjeldan tilstand. Ved krampar hjå sped- og småborn bør det likevel gjevast pyridoksin på liberal indikasjon, slik at alle tilfelle vert diagnostiserte.