Som en del av en bredere revisjonsprosess arbeider Statens legemiddelverk med å oppdatere og tydeliggjøre regelverket for blåreseptordningen. Målet er bedre etterlevelse av refusjonsvilkårene og bedre kvalitet på forskrivningen samt frigjøring av offentlige midler. Men hva er egentlig galt med dagens system – og hvilke grep må gjøres for å få til forbedringer?
Svaret avhenger til en viss grad av hvem man spør. Refusjonssystemet for legemidler har mange ulike brukere og interessenter. Det ligger i skjæringspunktet mellom pasienter, leger og helsevesen, apotek, legemiddelindustri, helse- og legemiddeløkonomer, kontrollmyndigheter og bevilgende myndigheter. Det er vanskelig å lage et system som ivaretar alles interesser, men felles kjøreregler for å forvalte regelverket må det være enighet om.
Stortingsmelding nr. 18 (2004 – 2005) Rett kurs mot riktigere legemiddelbruk (legemiddelmeldingen) redegjør for prioriteringer og satsingsområder i norsk legemiddelpolitikk (1). I alt 80 tiltak er foreslått for å nå hovedmålene, herunder en gjennomgang av blåreseptordningen.
Statens legemiddelverk har fått i oppdrag å videreutvikle refusjonssystemet og presisere refusjonsvilkårene (2, 3). Høsten 2005 etablerte Legemiddelverket det såkalte Blårev-prosjektet (4). Prosjektets mandat var å foreslå konkrete endringer i blåreseptforskriften og blåreseptordningen for å tydeliggjøre de rettslige vilkårene for godkjenning og forskrivning av refusjonsberettigede legemidler. Det er anslått at revisjonsarbeidet sammen med tiltak for bedre informasjons- og kontrollrutiner knyttet til blåreseptordningen vil frigjøre midler tilsvarende minst 5 % av de offentlige legemiddelutgiftene, eller 450 millioner kroner årlig (2).
Dyrt, men nødvendig
Blåreseptordningen, som er hjemlet i folketrygdloven, blåreseptforskriften og legemiddelforskriften, er den mest omfattende ordningen innen det offentlige refusjonssystemet for legemidler. Legemiddelprodusenter søker om opptak i ordningen og Statens legemiddelverk vurderer om søknadene fyller kravene i regelverket. Sentrale krav i blåreseptforskriften er at legemidlet har markedsføringstillatelse for bruksområdet det søkes refusjon for, og at godkjent bruksområde er dekket av minst ett av sykdomspunktene i § 9. Av legemiddelforskriften fremgår de faglige kriteriene for at et legemiddel kan godkjennes for pliktmessig refusjon: At behandlingen gjelder alvorlig sykdom eller risikofaktorer som med stor sannsynlighet vil medføre eller forverre alvorlig sykdom, at det er behov for langvarig behandling, at legemidlet har dokumentert klinisk effekt og at legemiddelkostnadene står i et rimelig forhold til den behandlingsmessige effekten.
Vedtak om å godkjenne et legemiddel for forskrivning på blåresept kan være mer eller mindre begrenset i forhold til midlets godkjente bruksområde (fig 1). Legemidler som godkjennes for refusjon, føres opp på listen over refusjonsberettigede legemidler. Så er det opp til den enkelte lege å vurdere om refusjonsvilkårene er oppfylt og pasienten har rett til blåresept. Dersom et legemiddel ikke godkjennes for refusjon, kan pasientens medikamentkostnader søkes dekket via andre ordninger, som blåreseptforskriftens § 2, § 10a eller folketrygdloven § 5-22.

Forholdet mellom sykdomspunkt og refusjonsberettiget bruk for legemidler opptatt i blåreseptordningen
Helt siden blåreseptordningen ble etablert i 1950-årene, har den tjent flere formål. Fremfor alt er den et velferdsgode og en pasientrettighet, men den er også et offentlig virkemiddel for å fremme hensiktsmessig og kostnadseffektiv legemiddelbruk i befolkningen (5). Hensynet til kostnadseffektivitet har fått større oppmerksomhet i takt med utviklingen av nyere og dyrere medikamenter og med veksten i legemiddelutgifter for det offentlige.
Det omsettes legemidler i Norge for over 16 milliarder kroner årlig (6). 70 % av legemiddelforbruket er offentlig finansiert – i første rekke gjennom blåreseptordningen – 30 % finansieres privat gjennom egenandeler, legemidler på hvit resept og reseptfrie medikamenter. Utgiftene til legemidler på blåresept, inkludert refusjon av egenandeler gjennom frikortordningen, gikk opp fra 3,8 milliarder kroner i 1995 til over 9 milliarder kroner i 2005. Den årlige realutgiftsveksten i 1990 – 2003 var gjennomsnittlig 8 % – det er høyere enn veksten i helsevesenets totalutgifter.
I Norge er det et helsepolitisk mål å sikre pasienter viktige legemidler uavhengig av betalingsevne, samtidig som medikamentene bør ha lavest mulig pris (1). Pris er imidlertid bare én av flere faktorer som legges til grunn ved vurderinger av legemidlers kostnadseffektivitet. Kostnadseffektivitetsvurderinger får stadig større betydning i land med refusjonssystemer fordi helsemyndighetene søker etter virkemidler for å bremse utgiftsveksten på legemiddelområdet (7 – 9). I Norge ble det i 2002 innført krav om kostnadseffektivitetsanalyser fra legemiddelprodusenter ved søknad om refusjon.
De siste årene har norske helsemyndigheter prøvd ut ulike tiltak for prisregulering av legemidler. Dette er blant annet en konsekvens av at apotekloven i 2001 åpnet for generisk bytte av legemidler. For ytterligere å utnytte konkurransen på det generiske markedet innførte myndighetene i 2005 det såkalte trinnprissystemet for et utvalg av virkestoffer (10). Trinnprissystemet medfører prisreduksjoner på 50 – 70 %. I løpet av det første året har det gitt en samlet prisreduksjon på ca. 450 millioner kroner, ifølge beregninger gjort av Legemiddelverket. Et annet prisregulerende tiltak er ordningen med foretrukket legemiddel for kolesterolsenkende midler fra juni 2005. Ordningen forventes å frigjøre ca. 200 millioner kroner de første 12 månedene.
Hva mener legene?
Legeforeningen har uttalt at blåreseptordningen er uoversiktlig, byråkratisk, kostbar og lite forutsigbar, og foreningen etterlyser konkrete grep for å forenkle systemet (11). Dette er i tråd med konklusjonen i en rapport fra Statskonsult i 2004, der det fremgår at ordningen har svakheter som disponerer for feiltolking av reglene og dårlig forskrivningskvalitet (12). Her påpekes det at informasjon om blåreseptordningen fremkommer fragmentarisk i ulike lover og forskrifter, i preparatlisten og hos ulike forvaltningsinstanser. Ifølge rapporten mener legene at foreldede vilkår og krav om spesialistforskrivning er sterkt medvirkende faktorer til reseptfeil. Apotekansatte på sin side mener at legene i stor grad forskriver dyrere legemidler enn det som er nødvendig. Rapporten pekte også på mangler i forskrivningskontrollen fra trygdeetatens side.
En MMI-undersøkelse, nylig gjennomført på oppdrag fra Statens legemiddelverk, bekrefter at blåreseptordningen er i skrøpelig forfatning (13). 1 500 leger i og utenfor sykehus ble spurt om holdninger til og kunnskaper om ordningen. Av de 725 respondentene var bare 37 % enig i påstanden om at det er enkelt å følge regelverket, samme antall som sa seg enig i at forskrivningsvilkårene er relevante og oppdaterte. Under halvparten av respondentene anså sykdomslisten som relevant og faglig oppdatert. En av tre mente at informasjonen om ordningen var utilstrekkelig, og en av fem fant den utilgjengelig. Bare 11 % av legene mente at pasientene har fått tilstrekkelig informasjon om blåreseptordningen.
Struktursvakheter
Et vesentlig problem med dagens sykdomsliste i blåreseptforskriftens § 9 er at den ikke gir adekvat informasjon om hvilken bruk av legemidlet som er godkjent for refusjonsberettiget forskrivning. Dette betyr at legen ikke blir gjort oppmerksom på hvilket bruksområde produsenten – gjennom sin søknad om opptak i blåreseptordningen – har dokumentert som kostnadseffektivt. Sykdomspunktenes generelle utforming bidrar dermed til at legemidler forskrives utenfor refusjonsberettiget bruksområde og i strid med de vilkår som gjelder for forskrivning.
En undersøkelse fra Institutt for apotekforskning har vist at forskrivningsfeil knyttet til refusjonsvilkår utgjør 15 % av feilene på resepter innlevert til norske apotek (14). Rikstrygdeverket har gjennom sine blåreseptkontroller avdekket til dels store forskrivningsfeil for enkelte legemidler (1). Skrekkeksemplet gjelder epilepsimidlet gabapentin, der over 60 % av forskrivningene ikke oppfylte refusjonsvilkårene (§ 9 pkt. 7). Det hyppigste regelbruddet var at pasienten hadde en annen lidelse enn den som var godkjent for refusjon. Feiltolking av refusjonsvilkår forekommer særlig når refusjonsvedtaket er begrenset til deler av legemidlets medisinske bruksområde. Da vil informasjonen knyttet til sykdomspunktet være forvirrende og villedende. Et velkjent eksempel er knyttet til diskusjonen om refusjonsstatus for kombinasjonspreparater som inneholder langtidsvirkende beta-2-agonister og kortikosteroider. Det godkjente bruksområdet for disse midlene er astma og alvorlig kronisk obstruktiv lungesykdom, men Legemiddelverkets refusjonsvedtak gjelder bare bruksområdet astma.
Noen vil mene at legemiddelgruppene og sykdomslisten i § 9 bør ha en generell utforming, slik at legene gis adgang til å forskrive ut fra skjønn. Fra et helseøkonomisk ståsted er det imidlertid klart at utstrakt skjønnsmessig forskrivning fører til feilforskrivning av legemidler på blåresept – og i neste omgang til utgiftsvekst.
Refusjonslisten – informasjon på ett sted
Et målrettet refusjonssystem som bidrar til etterlevelse av forskrivningsreglene stiller kvalitetskrav til informasjonen om refusjonsvilkårene. I dag finnes mye av denne informasjonen spredt på ulike kilder, i første rekke Norsk legemiddelhåndbok, Felleskatalogen og på Legemiddelverkets nettsider.
Tidligere i år presenterte Statens legemiddelverk et foreløpig forslag til strukturelle endringer i blåreseptordningen (15). Hovedprinsippet er å samle og synliggjøre informasjon om legemidlenes refusjonsstatus på ett sted, slik at forskrivningsreglene blir tydeligere og lettere å overholde. Enkelt sagt skal det bli lettere å forskrive riktig. Dette skal skje ved at dagens informasjon som tilligger sykdomslisten (fig 2) og preparatlisten (fig 3) samles i en ny og utvidet refusjonsliste (fig 4). Refusjonslisten vil spesifisere virkestoffer og preparatnavn samt ATC-koder, ICPC-2-koder, ICD-10-koder, refusjonsvilkår og indikasjonstekster. Det innføres altså ingen nye sykdomspunkter, men en refusjonsliste med en struktur som medfører at dagens sykdomspunkter i § 9 bortfaller. Videre legges det opp til at § 3 og § 4 kan integreres i refusjonslisten.

Figur 2 Utdrag av informasjon om sykdomspunkt og legemiddelgrupper fra dagens blåreseptforskrift
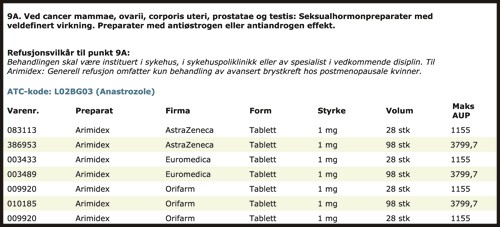
Figur 3 Utdrag av informasjon om refusjonsberettigede legemidler fra dagens preparatliste

Figur 4 Prinsipp for sammenstilling av legemiddelinformasjon i en ny refusjonsliste
Listen utvikles med utgangspunkt i en elektronisk løsning (refusjonsdatabase) med en rekke søkefunksjoner, i første rekke via virkestoff, preparat og diagnose. Løsningen utarbeides i samsvar med myndighetenes målsetting om elektronisk samarbeid innen helsesektoren (16) og i dialog med KITH (Kompetansesenter for IT i helse- og sosialsektoren), leverandører av elektroniske journalsystemer samt eResept-prosjektet. Den endelige refusjonslisten vil bli oppdatert kontinuerlig og være nedlastbar fra Legemiddelverkets nettsider. Det arbeides også med en bokversjon av refusjonslisten, hvor legemidlene primært vil bli sortert etter virkestoff, supplert med informasjon om preparatnavn.
Bruk av ICPC- og ICD-koder på blåresept utredes med henblikk på farmakoepidemiologiske formål (17, 18) så vel som forskrivningskontroll. Kodene vil dermed tjene som spesifikke refusjonskoder for refusjonsberettiget forskrivning. Opptak av legemidler på den nye refusjonslisten vil fortsatt skje etter dagens prosedyrer, i samsvar med vilkårene i folketrygdloven, blåreseptforskriften og legemiddelforskriften. Revisjonen av blåreseptordningen pågår parallelt med andre tiltak for å forbedre refusjonssystemet, herunder en gjennomgang av prosedyrene for revurdering av refusjonsstatus for legemidler.