En 54 år gammel tidligere frisk mann ble innlagt ved Rikshospitalet med diagnosen ustabil angina pectoris, etter førstegangsanfall med brystsmerter. Innleggelseskvelden hadde pasienten vært ute på byen og danset. Han drakk 2 – 3 glass vin, og fikk ved midnattstider lette retrosternale smerter av klemmende karakter med utstråling til begge overarmer. Pasienten hadde god nytte av glyseroltrinitrat og 5 mg morfin i ambulansen og var nærmest smertefri ved ankomst til Rikshospitalet, to og en halv time etter smertedebut.
Pasienten var fysisk aktiv, jobbet mye og røykte ca. ti sigaretter daglig. Han brukte ingen faste medikamenter og hadde ingen kjente allergier. Moren fikk hjerteinfarkt i 60 års alder, ellers var det ingen familiære sykdommer. I forbindelsen med en rutinemessig undersøkelse hos bedriftslegen var det nylig foretatt belastnings-EKG, som var normalt.
Brystsmerter er et symptom som kan ha en rekke årsaker, både kardiale og ikke-kardiale. Koronar hjertesykdom er en av flere differensialdiagnoser som alltid skal overveies hos slike pasienter. Pasienten var i en typisk alder for debut av koronarsykdom. I tillegg har menn generelt høyere risiko for koronarsykdom enn kvinner. Det var koronarsykdom i familien, pasienten var røyker og hadde en stressende jobb, men det forelå ingen andre risikofaktorer som hypertensjon, hyperkolesterolemi, diabetes eller redusert glukosetoleranse. Noe som talte imot mistanken om koronarsykdom, var de negative resultatene fra nylig gjennomført belastnings-EKG. Belastnings-EKG har imidlertid lav sensitivitet hos personer med liten pretestsannsynlighet for koronarsykdom.
Ved undersøkelse i akuttmottaket hadde pasienten blodtrykk 120/70 mm Hg, regelmessig puls med frekvens 60 per minutt, normal respirasjon og god allmenntilstand. Klinisk undersøkelse var uten spesifikke funn. EKG viste sinusrytme med ST-depresjoner i avledningene aVF og III, samt høye T-takker i fremrevegg, dog ingen ST-elevasjoner (fig 1). Orienterende ekkokardiografi viste lett hypokinesi i nedrevegg, ellers normale forhold. Blodprøvestatus fire timer etter smertedebut var normal, inkludert CRP og myokardskademarkører (troponin-I, myoglobin og CK-MB masse).
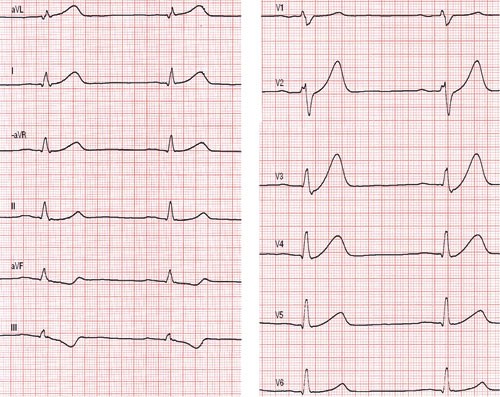
Figur 1 EKG ved innkomst viste normofrekvent sinusrytme med ST-depresjon og dels T-inversjon i aVF og III, høye T-takker i fremrevegg og lett intraventrikulært ledningshinder
EKG-forandringene var uspesifikke, men vel forenlige med akutt koronarsyndrom sett i sammenheng med pasientens symptomer. ST-senkning i EKG er lite egnet for lokalisering av iskemi, i motsetning til ST-hevning. Man mistenkte ut fra ekkokardiografi at det var iskemi i hjertets nedrevegg. Blodprøvene ved innkomst viste ingen tegn til infarkt, men det må tas blodprøver minst 12 timer etter smertedebut for å avklare hvorvidt det har vært utslipp av myokardskademarkører. Hvor raskt disse stiger, varierer med infarktets størrelse (1). Man startet behandling på klinisk mistanke samt EKG-forandringer.
Pasienten fikk acetylsalisylsyre, klopidogrel og nitroinfusjon etter prosedyre for akutt koronarsyndrom. Blodprøver tatt etter ni timer viste forhøyede nivåer av myokardskademarkører. Troponin-I var da 2,5 µg/l (normalt < 0,05 µg/l) og CK-MB masse 115 µg/l (normalt < 5 µg/l). Koronar angiografi ble utført 12 timer etter smertedebut. Denne viste nærmest totalt okkludert midtre del av ramus interventricularis anterior (LAD) og trombedanning, i tillegg til generelle veggforandringer. Stenosen ble behandlet med perkutan koronar intervensjon (PCI) med stentinnleggelse, med godt angiografisk resultat (fig 2). Etter prosedyren steg verdiene for troponin-I til 9,8 og CK-MB masse til 133 µg/l. Telemetriovervåking registrerte to løp med kortvarig ventrikulær takykardi. Pasienten var ikke hemodynamisk påvirket av dette.
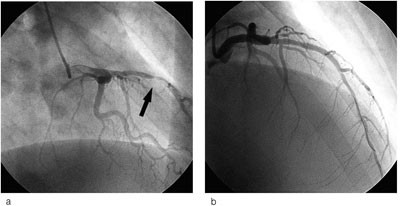
Figur 2 a) Koronar angiografi viste generelle veggforandringer samt 90 % stenose i midtre LAD. b) Denne ble PCI-behandlet med innlegging av stent, med godt angiografisk resultat
Troponinstigning hos pasienter med akutt koronarsyndrom er assosiert med økt mortalitet og morbiditet (2). På grunn av forhøyede nivåer av myokardskademarkører i to påfølgende blodprøver, fikk pasienten diagnosen akutt hjerteinfarkt. Reperfusjonsarytmier etter hjerteinfarkt er relativt vanlig, og korte løp med ventrikkeltakykardi de første par døgnene etter infarktet anses ikke som behandlingstrengende. Ventrikkeltakykardi og ventrikkelflimmer som oppstår mer enn to døgn etter et infarkt, innebærer derimot svært høy mortalitet på kort og lang sikt, og disse bør utredes nærmere (3).
Pasienten ble overflyttet til lokalsykehus etter ett døgn ved Rikshospitalet med følgende medisinering: acetylsalisylsyre 75 mg x 1, klopidogrel 75 mg x 1, metoprolol 25 mg x 2 og atorvastatin 80 mg x 1. Pasienten ble utskrevet i god form fra lokalsykehus til hjemmet dag 5. En pårørende hadde telefonkontakt med pasienten på formiddagen dag 6. Samme ettermiddag ble pasienten funnet død i sitt hjem. Det ble begjært rettsmedisinsk obduksjon på grunn av plutselig og uventet dødsfall.
Siden pasienten nylig hadde vært i kontakt med helsevesenet, var det vesentlig å avklare hvorvidt dødsfallet kunne skyldes komplikasjoner til behandling eller oversett alvorlig sykdom.
Den rettsmedisinske undersøkelsen konkluderte med at det ikke var ytre tegn til vold. Hjertet hadde normal vekt, størrelse og form. Man påviste kun en lett til moderat grad av åreforkalkning i hjertets kranspulsårer. Stenten var tilfredsstillende plassert og åpen, og det var ingen tegn til skader på åren. Det var ateromatøse plakk under stenten. Det var grågul misfarging av hjertemuskulaturen i fremre vegg av venstre hjertekammer og i fremre halvdel av hjerteskilleveggen. Makroskopisk ga dette mistanke om et akutt hjerteinfarkt, men ved mikroskopi viste det seg å være en utbredt myokarditt (fig 3). I enkelte av snittene var store deler av hjertemuskulaturen erstattet av et løsmasket bindevev med en til dels massiv infiltrasjon av kroniske betennelsesceller, vesentlig små lymfoide celler. Det ble også sett en del makrofager, og flere av disse inneholdt gulbrunt pigment, formentlig hemosiderin. Hjertemuskelfibrene mellom disse infiltratene var fullstendig uaffisert, med godt bevarte kjerner og tverrstriping. Myokardittforandringene var synlige i fem av totalt ni snitt. Det var normale forhold i snitt fra høyre ventrikkel. Det var ingen tegn til perikarditt, verken makroskopisk eller mikroskopisk. Det ble ikke påvist affeksjon av hjertets impulsledningssystem. Lungene var blod- og væskerike. Dødsårsaken ble ansett å være akutt hjertesvikt pga. utbredt hjertemuskelbetennelse, noe som også kan ha medført akutt hjerterytmeforstyrrelse. Vevsprøver ble sendt til virusundersøkelse. Enterovirus (coxsackie og ECHO) PCR var negativ.
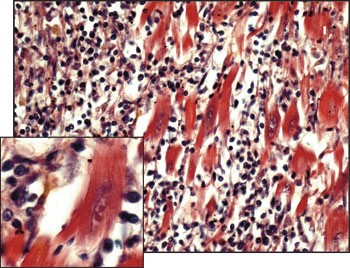
Figur 3 Histologisk preparat fra vår pasient viser myokarditt. Infiltratet består av tallrike mononukleære celler, som stort sett er lymfocytter. Myokardfibrene mellom betennelsescellene er godt bevart, med intakte kjerner
Diskusjon
Denne sykehistorien illustrerer vanskelighetene i differensialdiagnostikken mellom akutt myokarditt og akutt hjerteinfarkt. Med typiske kliniske manifestasjoner, EKG-forandringer og nivåstigning av myokardskademarkører i to blodprøver, er kriteriene for akutt hjerteinfarkt oppfylt hos vår pasient. I tillegg ble diagnosen understøttet av angiografisk påvist stenose i LAD. Obduksjonsfunnet var derfor uventet. Det histologiske bildet var lite preget av fibrose, noe som taler for at det var en relativt akutt inflammasjon. Den fokale opptreden av massiv infiltrasjon av mononukleære celler (fig 3) er typisk for myokarditt med viralt agens. Det typiske bildet ved akutt infarkt er infiltrasjon av polynukleære celler og myocytolyse (4) (fig 4). Infiltrasjon av polynukleære celler som nøytrofile granulocytter er også karakteristisk etter vellykket reperfusjon av iskemisk myokardskade (5), slik at dette neppe kan forklare det histologiske bildet. Nivåstigningen i troponin-I og CK-MB masse var såpass stor at man ville forvente infarktforandringer ved obduksjonen dersom disse var uttrykk for iskemisk myokardskade (1). Dyrestudier har vist at troponinnivåene ved myokarditt når sitt topppunkt etter 3 – 7 dager, og normaliserer seg etter 14 dager (6). Troponinnivåene korrelerer også godt med virustiter i hjertet. Samlet taler derfor funnene for en akutt inflammasjon. Obduksjonen viste også at pasienten hadde mild til moderat aterosklerose, men den hadde ikke tidligere vært symptomgivende. Det er nærmest umulig å si ut fra obduksjon hvor trang en stenose har vært, når den er vellykket dilatert og stentet. Det er rapportert liknende tilfeller hvor myokarditt gir symptomgivende koronarspasme (7). Således kan spasmetendens ha fremprovosert smerteanfallet, i tillegg til at myokarditten bidro til høyere oksygenkrav og arytmitendens i det inflammerte området.
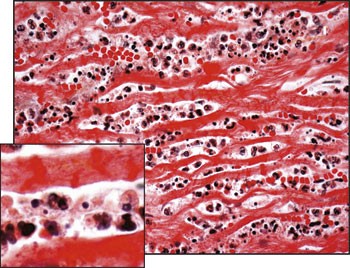
Figur 4 Histologisk preparat som til sammenlikning viser akutt hjerteinfarkt. Det er rikelig infiltrasjon av granulocytter mellom myokardfibrene, som stort sett er nekrotiske og mangler kjerner. Midt på bildet ses kontraksjonsbåndnekrose og i både øvre og nedre del ses «wavy fibres» (iskemiskade)
Myokarditt er assosiert med nedsatt pumpekapasitet og klassifiseres da som inflammatorisk kardiomyopati (8). Virale infeksjoner er den hyppigste årsaken til myokarditt, deretter bakteriell infeksjon. Sopp, protozoer og helminter er sjeldne årsaker til infeksiøs myokarditt. Ved steril myokarditt kan årsaken være immunmedierte reaksjoner i forbindelse med systemsykdommer, medikamentreaksjoner eller transplantatrejeksjon (e-tab 1) (9). Myokarditt kan gi akutt pumpesvikt og alvorlige arytmier. Akutt myokarditt er oftest reversibel, men kan gå over i en kronisk fase selv etter at utløsende agens er forsvunnet. Kronisk myokarditt kan føre til dilatert kardiomyopati, hvor pasientene utvikler progredierende symptomer på hjertesvikt over flere år.
|
Tabell 1 Årsaker til myokarditt, etter Willerson & Cohn (9)
|
|
Vanlige årsaker
|
Noen sjeldne årsaker
|
|
Infeksiøse
|
|
|
|
Virus
|
Adenovirus
|
ECHO-virus
|
|
Coxsackievirus
|
Hepatitt B-virus
|
|
Cytomegalovirus
|
Herpesvirus
|
|
Epstein-Barr-virus
|
Influensavirus
|
|
Humant immunsviktvirus
|
RS-virus
|
|
|
|
|
Bakterier
|
Borrelia burgdorferi
|
Chlamydia trachomatis
|
|
|
Corynebacterium diphtheriae
|
|
|
Haemophilus
|
|
|
Legionella
|
|
|
Mycoplasma
|
|
|
Meningokokker
|
|
|
Pneumokokker
|
|
|
Stafylokokker
|
|
|
Streptokokker
|
|
|
Mykobakterier
|
|
|
|
|
Andre
|
Toxoplasma gondii
|
Sopp
|
|
|
Rickettsia
|
|
|
Protozoer
|
|
|
Helminter
|
|
|
|
|
Ikke-infeksiøse
|
|
|
|
Systemiske sykdommer
|
Crohns sykdom
|
Temporalisarteritt
|
|
Sarkoidose
|
Churg-Strauss’ syndrom
|
|
Systemisk lupus erythematosus
|
Diabetes mellitus
|
|
Ulcerøs kolitt
|
Hashimotos tyreoiditt
|
|
Kjempecellemyokarditt
|
Myasthenia gravis
|
|
Peripartummyokarditt
|
Revmatoid artritt
|
|
Kawasakis sykdom
|
Sklerodermi
|
|
|
Wegeners granulomatose
|
|
|
|
|
Medikamenter
|
Antrasykliner
|
Klorokin
|
|
Katekolaminer
|
Fluorouracil
|
|
Cyklofosfamid
|
Litium
|
|
|
Paracetamol
|
|
|
|
|
Hypersensitivitetsreaksjoner
|
Hydroklortiazid
|
Allopurinol
|
|
Metyldopa
|
Diklofenak
|
|
Penicillin
|
Furosemid
|
|
Sulfadiasin
|
Lidokain
|
|
Sulfametoksasol
|
Fenytoin
|
|
|
Spironolakton
|
|
|
Tetrasyklin
|
De kliniske symptomene kan variere fra lymfadenopati og uspesifikke influensaliknende symptomer, til akutt hjertesvikt med lungeødem eller plutselig død, som i dette tilfellet. Forløpet kan også være subklinisk, derfor er prevalensen av myokarditt usikker og sannsynligvis underestimert (10). Andre kliniske manifestasjoner er uforklarlig hjertesvikt og arytmier som ev. kan gi synkope (11). Myokarditt kan gi brystsmerter og derfor imitere akutt hjerteinfarkt (12). Opplysninger om forutgående luftveisplager, gastrointestinale symptomer eller febersykdom kan være til hjelp for å anslå tidsaspektet fra virusinfeksjon til myokarditten manifesterer seg.
Ved klinisk undersøkelse kan man finne klassiske hjertesvikttegn som halsvenestuving og knatrelyder over lungene, samt gnidningslyd og galopprytme over hjertet. Røntgen thorax kan vise uskarp hjerteskygge og lungestuvning. Skade av kardiomyocytter gir nivåstigning av myokardskademarkører i blodprøver. Ekkokardiografi kan bedømme hjertets pumpefunksjon og regional veggbevegelighet. Annen bildediagnostikk er vanligvis ikke til hjelp ved mistanke om akutt myokarditt, men MR med kontrastforsterkning kan vise patologisk kontrastopptak i myokard ved virusmyokarditter (13). Viremi kan påvises ved PCR, og blodkulturer kan dyrkes med tanke på bakteriemi. Definitiv diagnose stilles ved endomyokardial biopsi, hvor man kan påvise typiske infiltrater. Et problem er den lave sensitiviteten ved denne typen biopsi, siden forandringene ved myokarditt ofte er fokale. Flere og større biopsier øker sensitiviteten. Med rundt 4 – 5 biopsier oppnår man en sensitivitet på ca. 50 % (10).
Ved autopsi av pasienter etter antatt plutselig hjertedød er myokarditt et hyppig og ofte uventet funn, i enkelte studier hos opptil 40 % blant unge mennesker (11). Formalinfiksert vev er lite egnet for påvisning av enterovirus RNA ved PCR, og et negativt resultat er derfor svært usikkert. På mistanke om myokarditt bør det derfor tas ut minimum fem vevsprøver for histologisk undersøkelse. Vevsprøver fra de samme områdene og en blodprøve fryses ned på –20 °C. Dersom den histologiske undersøkelsen viser myokardittforandringer, kan de oppbevarte prøvene sendes til virusundersøkelse. Det er derimot sjelden at viral myokarditt gir utslag ved serologisk undersøkelse (4).
Pasienten ble håndtert korrekt ut fra gjeldende retningslinjer for akutt koronarsyndrom og det var lite som på forhånd skulle tilsi at pasienten hadde myokarditt. Vi vil aldri få vite om myokarditten ville forårsaket brystsmerter uten ledsagende koronarsykdom.
Saken ble meldt som plutselig uventet dødsfall i henhold til helsepersonelloven § 36 med forskrifter, og rettsmedisinsk obduksjon ble rekvirert i henhold til straffeloven § 228 med forskrifter. Obduksjonsfunnet var uventet og rett diagnose ville ikke blitt stilt dersom obduksjon ikke var blitt utført.
Konklusjon
Sykehistorien illustrerer vanskelighetene vedrørende differensialdiagnostikk hos pasienter med akutte brystsmerter. Myokarditt er en meget aktuell differensialdiagnose hos unge pasienter med brystsmerter, EKG-forandringer, nivåøkning av myokardskademarkører og negativ angiografi. Endomyokardial biopsi er da en verdifull undersøkelse. Funnet av en relevant koronarstenose gjorde det lite aktuelt å gå videre med slik biopsi hos vår pasient. Dette er også et eksempel som understreker viktigheten av en høy obduksjonsfrekvens – av hensyn til en korrekt dødsårsaksstatistikk, forskning og tilbakemelding til klinikere.