I 1907 beskrev George Whipple en pasient som døde av en inntil da ukjent sykdom med vekttap, kronisk diaré, hoste og artritt (1). Autopsi viste ansamling av lipidholdig materiale i intestinal mucosa og i mesenterielle lymfeknuter. Sykdommen ble derfor oppfattet som en mulig lipidsykdom og fikk betegnelsen intestinal lipodystrofi. Ved hjelp av PAS-farging, som ble utviklet i 1949, ble det dokumentert at det intracellulære materialet i makrofagene består av glykoproteiner (2). Sykdommen fikk samme år navn etter Whipple. PAS-farging av vevsmateriale har frem til i dag hatt en sentral plass i diagnostikken.
Materiale og metode
Artikkelen er basert på ikke-systematiske litteratursøk i PubMed (fra januar 2007 og uten tidsbegrensning bakover i tid) på søkeordene «Whipple’s disease», som kombinert med «Tropheryma whippelii» ga 118 treff og kombinert med «Tropheryma whipplei» 65 treff. På bakgrunn av tittel og sammendrag ble de mest relevante artiklene selektert ut fra forfatternes skjønnsmessige vurdering. Disse danner grunnlaget for denne presentasjonen.
Etiologi
I sin presentasjon beskrev George Whipple stavformede organismer i sølvfarget materiale fra lymfeknuter. De ble oppfattet som forurensning og ble derfor ikke tillagt etiologisk betydning. Bakteriell infeksjon ble likevel lenge mistenkt, ikke minst på bakgrunn av lys- og elektronmikroskopiske studier i 1961 (1), der man påviste stavformede bakterier under basalmembranen. I 1952 ble det dessuten for første gang beskrevet vellykket antibiotisk behandling hos en pasient som fikk kloramfenikol.
I 1991 ble det ved hjelp av polymerasekjedereaksjon påvist genmateriale fra en grampositiv bakterie som fikk navnet Tropheryma whippelii (1). Navnet stammer fra gresk «trophe» (ernæring) og «eryma» (barriere) og skulle beskrive malabsorpsjonen som er typisk ved sykdommen. Bakterienavnet ble senere endret til Tropheryma whipplei. Elektronmikroskopiske studier (1) har vist at bakterien lever ekstracellulært under tynntarmens basalmembran. Studier av bakteriens rRNA i vevsprøver fra pasienter viser også at den vokser ekstracellulært (3). PAS-positive inklusjoner er således uttrykk for ansamling av nedbrytningsprodukter fra drepte bakterier inne i makrofagene (1).
Patogenese
T whipplei smitter sannsynligvis oralt. Tynntarmen er det primære infeksjonsfokuset, selv om ikke alle pasientene har symptomer fra tarmen. Bakterien spres via mesenterielle lymfekar til andre deler av kroppen og kan smitte alle organsystemer. Selv om Whipples sykdom er sjelden, er T whipplei trolig en hyppig forekommende bakterie i våre omgivelser (4). Den tilhører familien Actinomycetes, som er vanlig i blant annet jord. Dette kan forklare at det er en overhyppighet av sykdommen blant jordbrukere og bygningsarbeidere (1). Bakteriens DNA er imidlertid også påvist i prøvemateriale fra tannkjøtt (35 %), i magesaft (11,4 %) og i duodenalbiopsi (4,8 %) hos friske forsøkspersoner (4 – 6). Den kan derfor være en del av munnhulens naturlige bakterieflora (5). Spørsmålet blir da hvorfor kun noen få utvikler sykdommen, mens de fleste aldri blir syke. Genetiske faktorer kan tenkes å forklare at sykdommen nesten bare blir registrert hos hvite og at 80 % av tilfellene er menn.
Det ser ut til at sykdommen kun manifesterer seg hos personer med nedsatt makrofagfunksjon. Makrofagene har bevart evnen til fagocytose og bakteriedrap, men klarer ikke å bryte ned bakteriene slik de normalt skal gjøre. Nedbrytningsprodukter hoper seg dermed opp intracellulært i lysosomene og forklarer det karakteristiske funnet ved PAS-fargingen (2).
Produksjonen av interleukin-12 er redusert hos pasienter med Whipples sykdom (2). Interleukin-12 produseres hovedsakelig av monocytter, makrofager og dendrittiske celler, og stimulerer naturlige drepeceller og T-lymfocytter til produksjon av gammainterferon og til økt produksjon av T1-hjelpeceller. Svekket stimulering av gammainterferon vil i sin tur også bremse stimuleringen av andre makrofager. Hos pasienter med Whipples sykdom finner man redusert T4-T8-ratio i perifert blod der nivået av T1-hjelpeceller er redusert. Det er påfallende lite betennelsesceller i submucosa hos disse pasientene, på tross av aktiv sykdom. Det ses heller ikke cytotoksisk påvirkning på cellene i det infiserte vevet. Det vites ikke om bakterien i seg selv kan ha en immundempende effekt eller om sykdommen primært dreier seg om en immundefekt hos enkelte, som så blir mottakelige for sykdommen. Den svært lave insidensen taler for at den primære årsaken ligger hos verten, ikke hos bakterien. Pasienter med andre sykdommer som gir lave verdier av interleukin-12 har ofte opportunistiske infeksjoner, men dette er ikke tilfellet ved Whipples sykdom. Det tyder på at immundefekten er spesifikk for denne sykdommen (2).
Epidemiologi
Whipples sykdom er kun påvist hos mennesker, og det er ikke påvist eller mistenkt interhuman smitte (1). Sykdommen opptrer sporadisk, med en insidens på omtrent 0,4 per million per år. På verdensbasis er det estimert en årlig insidens på mellom 12 og 30. Fra George Whipples observasjon i 1907 og frem til 1987 ble det kun beskrevet 696 tilfeller. Frem til i dag er det ca. 1 000, de aller fleste er hvite menn. I Norge er det tidligere kun beskrevet to personer med denne sykdommen, en i 1966 og en i 1985 (7). Whipples sykdom kan opptre i alle aldersgrupper, men er svært sjelden hos personer under 30 år. Gjennomsnittsalder ved diagnosetidspunktet er ca. 50 år, og de fleste har hatt symptomer i måneder eller år før diagnosen blir stilt. Det er funnet økt prevalens av vevstypen HLA-B27, men det er likevel ikke påvist noen årsakssammenheng mellom denne vevstypen og sykdommen (2).
Symptomer
Whipples sykdom kan manifestere seg med en rekke ulike symptomer, noe som gjenspeiler at den kan affisere ulike organer (tab 1). Den trenger slik sett ikke være isolert til tynntarmen, selv om tynntarmen alltid er involvert. Mest vanlig er vekttap, diaré, artralgi og magesmerter, og pasientene kan ha symptomer i flere år før diagnosen blir stilt. Sentralnervesystemet kan være affisert hos opptil halvparten av pasientene, også der det er lite symptomer fra tarmen (8). I tabell 1 blir symptomer og funn oppsummert.
|
Tabell 1 Kliniske symptomer og funn samt prosentvise organmanifestasjoner ved Whipples sykdom
|
|
Prosent
|
|
Hovedsymptomer
|
|
|
Vekttap
|
90
|
|
Artralgi
|
85
|
|
Diaré
|
75
|
|
Magesmerter
|
60
|
|
Andre symptomer og funn
|
|
|
Anemi
|
75 – 90
|
|
Artritt
|
70 – 90
|
|
Feber og nattesvette
|
45
|
|
Lymfadenopati
|
40 – 50
|
|
Hyperpigmentering
|
40 – 60
|
|
Kardiale manifestasjoner
|
35 – 65
|
|
Lungeaffeksjoner
|
35 – 60
|
|
Affeksjoner i sentralnervesystemet
|
20 – 30
|
|
Øyeaffeksjoner
|
5 – 15
|
|
Splenomegali
|
5 – 10
|
Kasuistikk
Pasienten. En 62 år gammel kvinne med kjent HLA-positiv Bekhterevs sykdom ble henvist til poliklinisk gastroskopi på grunn av økende plager med kvalme, meteorisme, smerter i epigastriet og tidlig metthetsfølelse ved måltidene. Hun hadde hatt abdominalplager og vedvarende forhøyede CRP-verdier – mellom 30 mg/l og 60 mg/l – i flere år, men symptomene var betraktelig forverret i etterkant av perkutan koronar intervensjon på en koronararterie få uker tidligere. På grunn av koronarsykdom brukte hun acetylsalisylsyre (Albyl-E) 160 mg daglig, etter stentingen ble hun i tillegg satt på klopidogrelhydrogensulfat (Plavix) 75 mg daglig. Gastroskopi viste imidlertid normale forhold, og det ble ikke tatt tynntarmsbiopsi.
Fem måneder senere ble hun innlagt grunnet nyoppstått mikrocytær anemi og ufrivillig vekttap på 12 kg siden forrige undersøkelse. Blodprøvene viste Hb 9,5 g/100 ml, CRP 61 mg/l og SR 57 mm/t. Gastroskopiundersøkelsen ble igjen beskrevet som normal, og det ble heller ikke denne gang tatt tynntarmsbiopsi. Ved CT abdomen bemerket man markerte væskefylte tynntarmsslynger og multiple glandler i tynntarmskrøset av usikker etiologi. Det var normale resultater ved hemofecprøver av avføring, Meckels scintigrafi, koloskopi, cristabiopsi og gynekologisk undersøkelse. Under oppholdet fikk hun residivangina med verifiserte ST-depresjoner på iskemiovervåking, det ble derfor gitt blodoverføring med to enheter SAGMAN. Man mistenkte ulcerasjoner i tynntarmen sekundært til bruk av ikke-steroide antiinflammatoriske midler, acetylsalisylsyre og klopidogrelhydrogensulfat, og seponerte derfor ibuprofen (Brufen Retard), som hun brukte for ankyloserende spondylitt. Da vårt sykehus på dette tidspunkt ikke disponerte utstyr til kapselendoskopi av tynntarmen, ble hun søkt til dette ved St. Olavs Hospital og skrevet ut i påvente av undersøkelsen.
Kapselendoskopi få uker senere viste forsinket ventrikkeltømming og utbredte forandringer i tynntarmen, med utseende vel forenlig med Whipples sykdom (fig 1a). Hun ble derfor innkalt til snarlig ny gastroskopi, hvor man nå påviste inflammasjon i duodenum med multiple ødematøse hvitaktige flekker i slimhinnen (fig 1b). Biopsi fra pars descendens duodeni viste et stort antall makrofager med rikelig PAS-positivt materiale, forenlig med Whipples sykdom (fig 2a).
Kvinnen var på dette tidspunkt dehydrert og kakektisk, hun hadde gått ytterligere seks kilo ned i vekt og ble lagt inn i avdelingen for oppstart med antibiotika, ernæring og korreksjon av elektrolyttforstyrrelser. Hun følte seg konstant uvel i buken, hadde stadig diaré og en ekkel metallsmak i munnen. Ved innleggelsen viste blodprøvene CRP 79 mg/l, Hb 9,0 g/100 ml, K 2,9 mmol/l, Mg 0,49 mmol/l og albumin 23 g/l. Det ble ikke tatt spinalvæskeundersøkelse til analyse med polymerasekjedereaksjon. MR cerebrum var normal. CT abdomen viste uendrede funn. Ved hjelp av transabdominal ultrasonografi ble veggtykkelsen i tynntarmen målt til 4,7 mm, og det var økt ekkogenisitet i mucosa og submucosa, redusert tarmmotilitet, mural hyperemi samt multiple reaktive glandler i tarmkrøset (fig 3).
Initialt fikk pasienten total parenteral ernæring via sentralvenøst kateter og intravenøs rehydrering med korreksjon av kalium- og magnesiumnivået. Samtidig startet man med ceftriakson intravenøst 2 g en gang om dagen i 14 dager. Deretter gikk hun over til peroral vedlikeholdsbehandling med trimetoprim-sulfa, to tabletter to ganger daglig i de neste 12 måneder. Den første uken var hun subfebril, senere afebril. Metallsmaken i munnen forsvant, og matlysten og allmenntilstanden ble bedre i løpet av sykehusoppholdet.
Biopsiene tatt fra pars descendens duodeni ble sendt til St. Olavs Hospital for videre analyse. Polymerasekjedereaksjon med bruk av beskrevne primere for 16S rRNA-genet i T whipplei var positiv. Ved DNA-sekvensering av polymerasekjedereaksjonsproduktet var det 100 % sekvenshomologi med multiple T whipplei-sekvenser i GenBank.
Ved kontroll ti måneder senere følte pasienten seg frisk. Hun hadde lagt på seg over 10 kg siden hun startet med antibiotika og hadde mindre leddbesvær enn før. Blodprøvene var blitt normalisert, inkludert CRP-nivået, som var < 3 mg/l. Ultralydundersøkelse viste fremdeles en lett fortykket vegg i tynntarmen, men det var nå normal ekkogenisitet i tarmveggen og ikke lenger synlige lymfeknuter i krøset. Gastroskopien var normal (fig 1c), mens tynntarmsbiopsi fremdeles viste makrofager med PAS-positive inklusjoner (fig 2b). Kapselendoskopi av tynntarmen seks uker etter avsluttet antibiotikabehandling viste normale funn (fig 1d).
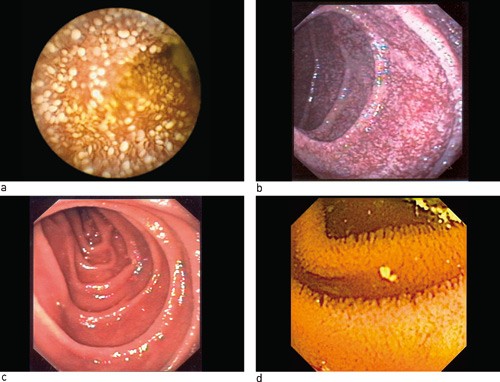
Figur 1 Endoskopibilder fra tynntarmen hos vår pasient. a) Kapselendoskopi (Given PillCam) og b) duodenoskopi før antibiotikabehandling. Tarmslimhinnen virker ødematøs med multiple hvitaktige flekker. Forandringene er utbredt i hele tynntarmen. c) Duodenoskopi etter ti måneders behandling og d) kapselendoskopi (Olympus PillCam SB) seks uker etter avsluttet behandling viser normale funn
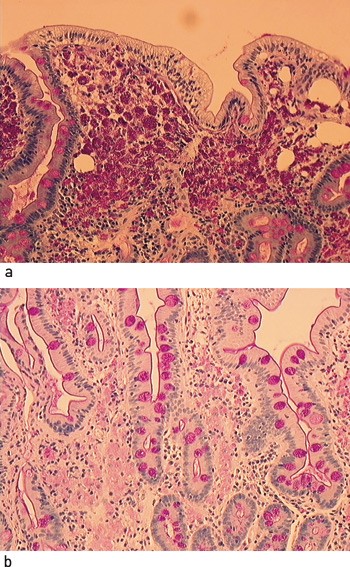
Figur 2 a) Tynntarmsbiopsi ved diagnosetidspunktet. Et stort antall makrofager med rikelig PAS-positive inklusjoner ses i submucosa. Tottene er avflatede og kryptene lett hyperplastiske, men det er ikke inflammasjon i vevet. b) Ti måneder etter behandlingen startet. Antall PAS-positive inklusjoner er redusert, og fargeintensiteten er svekket sammenliknet med diagnosetidspunktet
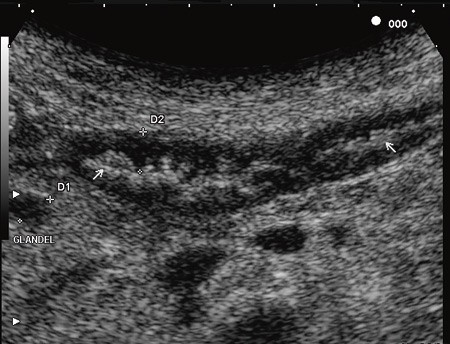
Figur 3 Transabdominal ultralyd av tynntarmen før behandlingen startet. Tarmveggen måles til 4,7 mm, mucosa og submucosa er hyperekkoiske (piler). Dorsalt for tarmen ses en reaktiv 4,4 mm stor mesenteriell lymfeknute
Diagnostikk
Endoskopi
Ved duodenoskopi er det karakteristisk å finne inflammasjon med multiple hvitaktige ødematøse lesjoner, lettblødende slimhinne, erosjoner og ulcerasjoner. Kapselendoskopi viser i prinsippet de samme forandringene, og demonstrerer samtidig sykdommens utbredelse gjennom tynntarmen (9, 10).
Histologi
På overflaten ses villøs atrofi. Det påvises rikelig med PAS-positive inklusjoner, lokalisert intracellulært i de submukøse makrofagene (PAS-positivitet er likevel ikke spesifikt for Whipples sykdom). Det er ikke inflammasjon eller ødelagte celler i preparatet, til tross for aktiv infeksjon (1). Man finner dilaterte submukøse lymfekar som uttrykk for lymfestase. Dette oppfattes å være sekundært til at PAS-positive makrofager akkumuleres i de mesenterielle lymfeknutene og slik forårsaker en relativ obstruksjon av dem. I lymfekarene samler det seg lipidholdig materiale, noe som forklarer Whipples observasjon da han beskrev sykdommen som intestinal lipodystrofi. Lipidet vaskes imidlertid bort i prepareringen av vevsprøvene og ses derfor ikke lysmikroskopisk.
Elektonmikroskopi
Bakterien har trilaminær cellevegg, med glykoproteiner i det innerste laget. Levende bakterier finnes ekstracellulært under basalmembranen, mens bakteriefragmenter og nedbrytningsprodukter ses intracellulært i de submukøse makrofagene (1).
Dyrking
Bakterien har lang delingstid, og man lyktes først i 2000 å dyrke den i stabile kulturer (2). Metoden er komplisert og vil neppe få noen rutinemessig utbredelse.
Radiologisk undersøkelse
CT abdomen viser hypodense mesenterielle lymfeknuter, noe som forklares av lipidavleiringen i lymfeknutene. Den affiserte tynntarmen har økt veggtykkelse. Ved røntgen tynntarm med bariumkontrast ses grovere folder i tynntarmen enn normalt. MR cerebrum er som regel normal, selv der polymerasekjedereaksjon av spinalvæske viser positive funn. Hos enkelte pasienter er det likevel beskrevet fokale lesjoner, cerebral atrofi og hydrocephalus (8).
Ved transabdominal ultrasonografi av tynntarmen ses økt veggtykkelse (normal tarmvegg er 2 – 3 mm tykk) med hyperekkoisk mucosa og submucosa («hvit tarm»). I tillegg ses forstørrede mesenterielle lymfeknuter med økt ekkogenisitet. Man antar at lipidansamlingen sekundært til stase av lymfekarene kan forklare den økte ekkogenisiteten i tarmveggen og i lymfeknutene (11).
Blodprøver
Det er ennå ikke utviklet gode nok serologiske tester til klinisk bruk. IgG-antistoffer mot T whipplei påvises hyppig hos både friske kontrollpersoner og pasienter. Det er beskrevet overhyppighet av vevstypen HLA-B27 (1, 2). Man kan påvise økt antall CD8-positive T-celler i perifert blod, med redusert forholdstall mellom CD4 og CD8 (1, 2). Dessuten kan man finne jernmangelanemi, mangel på vitaminer og mineraler, elektrolyttforstyrrelser og forhøyet CRP-nivå.
Polymerasekjedereaksjon
Metoden er sensitiv for å påvise at T whipplei er til stede i vevsprøver (12). Laboratoriet ved St. Olavs Hospital har de siste ni år hatt mulighet til å diagnostisere Whipples sykdom ved hjelp av denne teknikken. Så vidt vi kjenner til er imidlertid vår pasient den første i Norge der man har kunnet bekrefte diagnosen på denne måten.
Metoden beskrives som en test som med 100 % spesifisitet og 96,6 % sensitivitet kan påvise genfragmenter fra bakterien i vevsprøver (12), både levende og drepte bakterier. Positiv polymerasekjedereaksjon finnes dessuten også hos friske personer (4 – 6). Polymerasekjedereaksjon er derfor ikke tilstrekkelig til å stille diagnosen, men brukes heller til å bekrefte den der kliniske og histologiske funn gir mistanke om sykdommen. Positiv polymerasekjedereaksjon i prøvemateriale fra vev som normalt skal være sterilt (f.eks. blodprøver, spinalvæske, ascitesvæske eller hjerteklaffer) oppfattes imidlertid som uttrykk for reell infeksjon.
Man kan finne PAS-positive makrofager flere år etter at behandlingen er avsluttet, noe som gjør tynntarmsbiopsi lite egnet til å avgjøre behandlingslengden eller prognosen for den enkelte pasient. Bortfall av positiv polymerasekjedereaksjon etter igangsatt behandling tyder på behandlingseffekt, men er ingen garanti for at bakterien er blitt borte fra kroppen. Metoden anbefales brukt dersom det er klinisk mistanke om residiv etter avsluttet behandling. Spinalvæske til bestemmelse av polymerasekjedereaksjon anbefales tatt før start av antibiotikabehandling, da cerebral affeksjon kan påvises hos opptil 50 % av pasientene (8).
Behandling
Behandlingen ved Whipples sykdom er empirisk (1). Det anbefales induksjonsterapi de første 10 – 14 dagene med intravenøs behandling med antibiotika som har god penetrasjon til sentralnervesystemet, enten ceftriakson 2 g daglig som monoterapi eller kombinasjonen penicillin G og streptomycin. Deretter anbefales vedlikeholdsbehandling med peroral trimetoprim-sulfa – to tabletter to ganger daglig i ett år. Dette regimet gir høy suksessrate med liten fare for residiv (1, 8). Alternativ vedlikeholdsbehandling kan være tetrasykliner i like lang tid, men slike preparater har noe dårligere penetrasjon av blod-hjerne-barrieren. Uten antibiotikabehandling er sykdommen dødelig. Med adekvat behandling er prognosen god, selv om det er beskrevet tilbakefall. Residiv i sentralnervesystemet innebærer dårlig prognose, da sykdommen i slike tilfeller kan være refraktær mot fornyet antibiotisk behandling. Ved residiv anbefales ceftriakson 2 g daglig i fire uker, etterfulgt av trimetoprim-sulfa peroralt i ett år. Alternativt til trimetoprim-sulfa kan man gi kombinasjonen doksysyklin 100 mg to ganger daglig og hydroksyklorokin 200 mg tre ganger daglig.
Konklusjon
Whipples sykdom er en sjelden infeksjon med snikende symptomdebut, noe som gjør diagnosen vanskelig å stille. Dysfunksjon i makrofagene anses i dag som en sannsynlig forklaring på at så få blir syke til tross for at T whipplei er en hyppig forekommende bakterie i våre omgivelser. Diagnosen bygger på klinikk, polymerasekjedereaksjon og PAS-positive makrofager i vevsprøver. Man bør være liberal med å ta tynntarmsbiopsi der det er klinisk mistanke om malabsorpsjon.