Den norske vaksinen mot gruppe B-meningokokksykdom og utprøvingen av den er blitt kritisert i mediene og av det offentlige granskingsutvalget. Kritikken er dels feil, dels ensidig. Vaksinen er sikker. Vaksineforsøket ble stort sett gjennomført på betryggende måte. Vaksinen er etter vår mening en norsk forskningsbragd og er den eneste i verden med dokumentert effekt på gruppe B-meningokokksykdom.
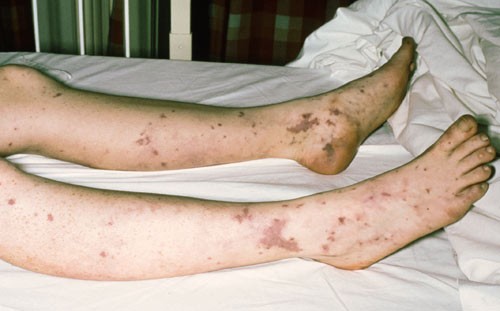
Petekkier – et karakteristisk funn ved meningokokksepsis. Foto Science Photo Library/GV-Press/NordicPhotos
I oktober 1988 ble 171 800 ungdomsskoleelever innrullert i et forsøk som var planlagt som et dobbeltblindt, placebokontrollert beskyttelsesforsøk (fase 3-forsøk). Resultatene ble publisert i en artikkel i The Lancet i 1991 (1) (fig 1). Vaksinen ga 57,2 % beskyttelse (p = 0,012), men den beskyttende effekten var ikke god nok til å inkludere vaksinen i det norske vaksinasjonsprogrammet.

Figur 1 Faksimile fra artikkelen i The Lancet (1)
Høsten 2006 ble vaksinen og vaksineforsøket sterkt kritisert i et program på TV 2 (2) og i to artikler i Dagens Medisin (3, 4). To forhold ble kritisert, dels en «nasjonal» kritikk av gjennomføringen av vaksineforsøket 1988 – 91, dels en «internasjonal» kritikk av Folkehelseinstituttets salg av vaksinen til Frankrike og New Zealand. Kritikken ble forsterket ved at Statens legemiddelverk i august 2006 fant flere avvik ved Folkehelseinstituttets produksjon og kontroll av vaksinen (5).
Den «nasjonale» kritikken
TV 2-programmet tok utgangspunktet i sykehistorien til en pasient som hevdet å ha blitt påført nevrologisk skade etter deltakelse i vaksinasjonsforsøket (2). Det ble særlig satt søkelys på manglende informasjon om muligheten for alvorlige bivirkninger av vaksinen. Professor i medisinsk etikk, Jan Helge Solbakk, som hadde arbeidet med de etiske sidene ved vaksineforsøket, kritiserte prosjektledelsen for at de visste at flere av forsøkspersonene statistisk sett kunne få alvorlige bivirkninger uten at dette ble opplyst til forsøkspersonene eller de pårørende. Ifølge Solbakk ble prosjektledelsen oppfordret til å gi bedre informasjon uten at dette ble gjort. I programmet ble prosjektledelsen også kritisert av professor Hans Cato Guldberg som hadde vært medlem av den uavhengige monitorgruppen for vaksineforsøket. Guldberg hevdet at prosjektledelsen tonte ned betydningen av det han mente var et relativt høyt antall meldte bivirkninger. Etter programmet kom det mer enn 50 henvendelser til TV 2-redaksjonen (6). Ifølge programlederen kunne mange av disse fortelle om alvorlig skadede, pleietrengende eller døde barn. Noen år tidligere hadde Norges Myalgisk Encefalopati Forening (ME- foreningen) fått henvendelser om økt hyppighet av myalgisk encefalopati (kronisk tretthetssyndrom) blant vaksinerte (7).
Den «internasjonale» kritikken
TV 2-programmet og Dagens Medisin kritiserte Folkehelseinstituttet for at det i 2004 hadde sendt 9 000 doser av gruppe B-vaksinen til Frankrike i et forsøk på å stanse en meningokokkepidemi i Normandie. En inspeksjon av produksjonsfasilitetene foretatt av Statens legemiddelverk sammen med representanter for franske myndigheter i august 2006 viste flere alvorlige produksjons- og analyseavvik (5). Direktøren ved Folkehelseinstituttet beklaget alle avvikene, og produksjonen av meningokokk gruppe B-vaksinen ble stanset (3). Folkehelseinstituttet ble også kritisert for å ha solgt en modifikasjon av den norske vaksinen til New Zealand, skreddersydd til å bekjempe det store utbruddet av gruppe B-meningokokksykdom der. Folkehelseinstituttet hadde riktignok inngått avtale med legemiddelselskapet Chiron (senere overtatt av Novartis) som overtok rettighetene til produksjon, markedsføring og salg av vaksinen. Likevel mente professor Solbakk i TV 2-programmet at det var brudd på internasjonal forskningsetikk at Folkehelseinstituttet ikke selv hadde gjennomført en fase 3- utprøving av den gruppe B-vaksinen som ble solgt til New Zealand. I stedet hadde Folkehelseinstituttet brukt resultatene fra forsøket med den norske gruppe B-vaksinen som en garanti overfor myndighetene på New Zealand.
Reaksjon på kritikken
På bakgrunn av kritikken ba Helse- og omsorgsdepartementet om en redegjørelse fra Folkehelseinstituttet om det norske vaksinasjonsforsøket med vekt på organiseringen, informasjonen som ble gitt til de vaksinerte og andre involverte, meldingssystemet for bivirkninger og komplikasjoner, samt opplysninger om undersøkelser for å kartlegge mulig overhyppighet av kronisk utmattelsessyndrom hos de vaksinerte (8 – 10). Folkehelseinstituttet svarte at organisering og gjennomføring av forsøket var i henhold til godkjent protokoll og Helsinkideklarasjonen. Ut fra de begrensede midler som sto til disposisjon, måtte vaksinasjonsforsøket gjennomføres som en «nasjonal dugnad» der skolehelsetjenesten i stor grad ble pålagt vaksinasjonsoppgaver. Instituttet erkjente at man i ettertid kunne se at den stramme organiseringen medførte at forsøkspersonene ble dårligere fulgt opp enn ønskelig. Før forsøket tok til, var det blitt oppnevnt en uavhengig monitorgruppe til å overvåke hele forsøket inkludert meldte bivirkninger.
Monitorgruppen hadde myndighet til å stanse forsøket. Folkehelseinstituttet mente informasjonen som ble gitt til forsøkspersonene, var fyldig og dekkende, men at man i dag i mindre grad ville ha direkte oppfordret elevene til å delta. I dag ville man også ha gitt tydeligere informasjon om at det var usikkerhet knyttet til forekomsten av mulige alvorlige bivirkninger. I forbindelse med senere innrapporterte meldinger om økt forekomst av myalgisk encefalopati hos forsøkspersoner var Folkehelseinstituttet blitt enig med ME-foreningen og Norsk pasientskadeerstatning om å gjennomføre studier for å klarlegge mulige årsaksforhold. Folkehelseinstituttet gjennomgikk også avtalen med Chiron om produksjon og salg av vaksinen, bl.a. til New Zealand. Kontrakt om produksjon ble inngått mellom New Zealand og Chiron. Folkehelseinstituttet var ikke kontraktspartner. All tilgjengelig og relevant informasjon om vaksinen var stilt til disposisjon for de impliserte parter.
Departementet oppnevnte i februar 2007 et granskingsutvalg under ledelse av professor Olaf Gjerløw Aasland og med to jurister som øvrige medlemmer. I utvalget var det ingen personer med kompetanse i infeksjonsmedisin, mikrobiologi eller vaksinespørsmål. Utvalget fikk som mandat å vurdere om relevant informasjon ble gitt fra Folkehelseinstituttet til Chiron før produksjon av vaksine til spedbarn på New Zealand og å gjennomgå vaksinasjonsforsøket 1988 – 92 med hovedvekt på vaksinasjonen av ungdomsskoleelever og militære rekrutter. Svaret på det første punktet forelå i en delrapport i august 2007 (11). Utvalget kom enstemmig til at Folkehelseinstituttet hadde gitt all relevant informasjon til Chiron, og at den var tilgjengelig for alle impliserte parter og enkeltpersoner. Ingen kritikk ble reist.
Meningokokkutvalgets hovedrapport
Hovedrapporten om det norske vaksinasjonsforsøket forelå i oktober 2007 (12). Utvalget konkluderte med at forsøket var et stort prosjekt med begrensede midler og stor innsatsvilje fra mange enkeltpersoner for å avverge en epidemi med store konsekvenser for befolkningen. Utvalget kritiserte Folkehelseinstituttet sterkt for at klare anbefalinger og pålegg fra andre myndigheter om utforming av risikoinformasjon ble neglisjert, at rekrutter ble inkludert i forsøket, at skolehelsetjenesten og kommunehelsetjenesten fikk betydelige oppgaver i forsøket, at informasjon om mulige alvorlige bivirkninger ikke ble gitt til placebogruppen før de senere ble tilbudt vaksinen, at oppfølgingen av forsøkspersonene sviktet, og at erstatningssakene tok lang tid. Mediene grep takknemlig tak i saken (13).
Egne vurderinger
Allmennheten sitter igjen med et inntrykk av at vaksineforsøket var dårlig gjennomført og mislykket, og at vaksinen var farlig. Det er synd om dette inntrykket skal bli stående, fordi det er galt. Vaksinen er god og sikker og teknologien Folkehelseinstituttet har utviklet, kan benyttes til å skreddersy vaksine mot alle varianter av gruppe B-meningokokkbakterien. Vi som skriver denne artikkelen, var alle sterkt involvert i den helt spesielle meningokokkepidemien som rammet Norge fra 1975 til utover i 1990-årene. Vi var vitne til et stort antall tragiske dødsfall, oftest blant barn, et stort antall kritisk syke pasienter, alle komplikasjonene som oppsto og ikke minst den betydelige angsten som rammet en hel bygd eller by i kjølvannet av sykdommen. I perioden fra 1975 til vaksinasjonsforsøket ble påbegynt 1988 var det mer enn 300 personer med meningokokksykdom per år hvorav ca. 30 døde – flest barn. Fra epidemien begynte til vaksineforsøket kom i gang tok gruppe B-meningokokker flere hundre menneskeliv i vårt land. Med dette som bakgrunn mener vi det var prisverdig og etisk forsvarlig at norske helsemyndigheter prøvde å bekjempe en infeksjon med så høy dødelighet og skadefrekvens ved hjelp av en ny vaksine.
I 1980-årene fantes det beskyttende vaksiner mot serogruppe A, C, Y og W135 for barn over to år og voksne. Ingen hadde klart å fremstille en vaksine mot serogruppe B. I motsetning til de andre serogruppene induserer ikke serogruppe B kapselpolysakkaridet beskyttende antistoffer. Gruppe B-vaksinen som Folkehelseinstituttet fremstilte, bygde på et helt nytt prinsipp. Man brukte proteiner i bakteriens yttermembran som immunogen. Siden disse proteinene kan variere fra utbrudd til utbrudd, må eventuelt en ny gruppe B-vaksine konstrueres for hvert nytt utbrudd. Ved utviklingen av gruppe B-vaksinen for New Zealand ble Folkehelseinstituttets teknologi anvendt, men med en annen gruppe B-bakterie som utgangspunkt. Resultater av vaksinasjonsforsøket på New Zealand viste en klar statistisk sannsynlighet for beskyttende effekt (14). Uvaksinerte hadde 3,7 ganger høyere forekomst av sykdom enn vaksinerte (p < 0,0001) og beskyttende effekt var 73 % (95 % KI 52 – 85 %). I løpet av den toårige vaksineperioden viste beregninger at 54 sykdomstilfeller ble forhindret. Forskere fra Folkehelseinstituttet samarbeidet aktivt med forskere fra New Zealand om utprøving av ulike vaksinekandidater. Hvor var pressen, inkludert Tidsskriftet og Dagens Medisin, da disse oppløftende resultatene ble publisert og kjent?
Rapporten fra Meningokokkutvalget og oppslag i mediene har skapt inntrykk av at antall alvorlige bivirkninger og hendelser, var stort. I vaksineprosjektet ble bivirkninger og hendelser som inntrådte innen 30 dager etter vaksinasjonen medregnet. Denne tidsrammen vil ikke fange opp myalgisk encefalopati. Ifølge rapporten ble det kun meldt sju alvorlige hendelser hos de vaksinerte. Utvalget drøfter overhodet ikke antall bivirkninger i forhold til avvergede sykdomstilfeller og mulige dødsfall som følge av vaksineforsøket. Om de bivirkninger som monitorgruppen vurderte som mulig eller sannsynlig relatert til meningokokk B-vaksinasjonen, faktisk skulle være det, ville etter vår oppfatning bivirkningsbelastningen ved denne vaksinen være akseptabel tatt i betraktning antallet som ble vaksinert, og den høye forutgående insidensen av meningokokksykdom i de aktuelle aldersgruppene. Etter en nøyaktig gjennomgang av dokumentasjonen på dette området fant WHOs bivirkningskomité (GACVS) høsten 2007 intet belegg for alvorlige bivirkninger som følge av eksisterende meningokokk B-vaksiner. I vurderingen refererte komiteen spesielt til utredningene i New Zealand og Norge (15).
Hva så med sammenhengen med myalgisk encefalopati og vaksinen? Foreløpige studier i Norge som er publisert av WHO (15) og nylig i tidsskriftet Vaccine (16), viser ingen slik sammenheng. Det var i april 2008 kommet inn 280 krav om erstatning til Norsk pasientskadeerstatning fra personer som mener de er blitt påført myalgisk encefalopati gjennom vaksinasjonsforsøket (17). Av disse er 134 blitt avslått, 52 er henlagt og 92 er fortsatt under utredning.
Konklusjon
Folkehelseinstituttet har utviklet en teknologi for å fremstille en effektiv og sikker vaksine mot ulike varianter av gruppe B-meningokokker. Denne teknologien har hatt og kan fortsatt få stor betydning for bekjempelsen av denne sykdommen. Beslutningen om å påbegynne utviklingen av en slik vaksine var høyst påkrevd tatt i betraktning den høye dødelighet og sykelighet gruppe B-meningokokker påførte befolkningen fra epidemien begynte i 1975. Med vaksineforsøket som pågikk 1988 – 91, har Folkehelseinstituttet og helsevesenet i Norge bidratt med verdifull ny kunnskap for å bekjempe meningokokkepidemier. Grunnet knappe ressurser ble vaksinasjonsforsøket gjennomført som en nasjonal dugnad, men på en etisk og organisatorisk god måte med alle protokoller godkjent av Statens legemiddelkontroll, Datatilsynet og Etisk råd. Informasjonen til forsøkspersonene kunne vært bedre. Det er en svakhet ved vaksineforsøket som Folkehelseinstituttet har erkjent og beklaget.