En nyretransplantert mann i 50-årene utviklet et B-cellelymfom og startet cellegiftbehandling mot dette. Etter fjerde kur fikk han produktiv hoste og det ble målt svingende temperatur. Utredningen avdekket en noe uvanlig årsak.
En mann i 50-årene ble overflyttet til vårt sykehus fra et annet sykehus etter at han i ti dager hadde hatt nedsatt allmenntilstand, produktiv hoste, dyspné og svingende temperatur. Før overflyttingen hadde han vært behandlet i fem dager med fenoksymetylpenicillin 1 g × 4 peroralt, uten sikker bedring. Pasienten hadde to måneder tidligere fått påvist et abdominalt diffust storcellet B-cellelymfom. Han hadde blitt behandlet med Vorfase (fem dager med cyklofosfamid og prednisolon) etterfulgt av et cytostatikaregime bestående av rituximab, cyklofosfamid, doksorubicin, vinkristin og prednisolon gitt med 14 dagers intervaller (R-CHOP-14). Da han ble overflyttet til vårt sykehus, var det gått 12 dager etter den fjerde runden med R-CHOP.
Fire år tidligere hadde pasienten blitt nyre- og pancreastransplantert etter å ha utviklet terminal nyresvikt på bakgrunn av diabetes mellitus type 1. I tillegg hadde han hatt hypertensjon i flere år og kronisk hepatitt B. Mindre enn et år etter transplantasjonen tilkom behandlingskrevende aktivering av cytomegalovirus (CMV). I tilslutning til dette fikk pasienten en akutt avstøtningsreaksjon som ble behandlet med metylprednisolon intravenøst. Kort tid etter ble en ny avstøtning påvist, og han ble da behandlet med antitymocyttglobulin (ATG) i tillegg til intravenøse steroider. Han var født og oppvokst i et afrikansk land, men hadde bodd i Norge i nærmere 20 år.
Siden pasienten var immunsupprimert etter kombinert nyre- og pancreastransplantasjon, og i tillegg behandlet med cellegift, hadde han en høy risiko for å pådra seg infeksjoner med potensielt alvorlig forløp. Dessuten var det ønskelig å få avklart og behandlet en eventuell infeksjon raskt, slik at han kunne få neste runde med cellegift.
Da han ble tatt imot hos oss var temperaturen 38 °C på morgenen, senere målt til 36,5 °C. Blodtrykket var på 82/49 mm Hg og pulsen var regelmessig på 86 slag/minutt. Blodprøver viste anemi med Hb på 9,8 g/dl (13,4 –17,0), leukocytose med hvite blodceller på 10,6 · 10⁹/l (3,5 – 8,8), men med normalt nivå av nøytrofile granulocytter. Imidlertid så man lett forhøyet monocyttall på 0,9 · 10⁹/l (0,2 – 0,7) og en betydelig eosinofili: 2,71 · 10⁹/l (0,03 – 0,50). CRP var på 26 mg/l (0 – 5). Kreatinin var på 121 μmol/l (60 – 105), hvilket var høyere enn hans normalnivå på 80 – 90 μmol/l.
Eosinofili kan ses ved parasittsykdommer (1). Dette bør man være spesielt oppmerksom på hos pasienter fra for eksempel Asia eller Afrika. Videre kan eosinofili ses ved allergi, medikamentreaksjoner, eosinofil pneumoni (Löfflers syndrom), Löfflers endokarditt, eosinofil leukemi (1), ved Churg-Strauss’ syndrom (2), filariasis, bronkopulmonal aspergillose og Wegeners granulomatose (3).
I tillegg til insulin og blodtrykkssenkende medikamenter brukte pasienten takrolimus, prednisolon, acetylsalisylsyre og emtricitabin (sistnevnte medikament mot hepatitt B). Han tok også trimetoprim-sulfametoksazol profylaktisk i forbindelse med CHOP-kurene. Han hadde brukt mykofenolatmofetil tidligere, men medikamentet var seponert mens han fikk cytostatikabehandling. Fire dager før innleggelsen hos oss ble det tatt polymerasekjedereaksjonstest for cytomegalovirus (CMV-PCR), som var på 157 DNA-kopier/ml, det vil si et beskjedent forhøyet kopitall. Røntgen thorax samme dag hadde vist lett økte tegninger basomedialt på høyre side, men dette ble ikke vurdert som et sikkert infiltrat.
CT thorax (high resolution) tatt overflyttingsdagen viste økende interstitielle, retikulære forandringer, mest basalt og lateralt på begge lunger. Man så ingen mattglassfortetninger, og funnet kunne gi mistanke om fibrose. På en CT-undersøkelse tatt på det henvisende sykehuset 25 dager tidligere ble disse forandringene også sett, men var mindre tydelige. Auskultatorisk var det løse krepitasjoner på begge lunger bilateralt, men mest på høyre side.
Hoste, feber og røntgenverifiserte forandringer hos pasienter med supprimert immunforsvar bør utredes tilfredsstillende, og behandling bør vanligvis startes raskt (4). Ved mistanke om bakterielle infeksjoner i luftveiene bør antibiotikabehandling velges empirisk ut ifra symptomer, kliniske funn og biokjemiske markører som CRP. Organtransplanterte pasienter som innlegges i sykehus med pneumoni bør få intravenøs behandling med bredspektret antibiotika (4). Det er ikke uvanlig at slike pasienter kun opplever feber og nedsatt allmenntilstand, og at fokale symptomer er fraværende (4).
Det ble vurdert at pasienten sannsynligvis ikke hadde en bakteriell pneumoni på grunn av at han ikke hadde produktiv hoste, fordi typiske røntgen- og auskultasjonsfunn manglet og fordi hvite blodceller og CRP kun var lett forhøyede. Videre ga hans eosinofili mistanke om annen årsak, for eksempel parasittsykdom. Penicillinbehandlingen ble derfor ikke videreført, men vi kontinuerte den profylaktiske behandlingen med trimetoprim-sulfametoksazol. Cytomegalovirus-kopitallet var kun lett forhøyet, og det forelå derfor ikke indikasjon for oppstart av antiviral behandling. Status for cytomegalovirus ble monitorert hyppig i den perioden pasienten lå inne.
Lungelege vurderte også pasienten, og bronkoskopi ble gjennomført andre liggedøgn. Denne viste en liten polypp på høyre stemmebånd, som ble biopsert, i tillegg til noe slim i begge overlapper, men ellers viste undersøkelsen normale funn. Skylleprøver fra begge overlapper ble sikret til mikrobiologisk diagnostikk. Polymerasekjedereaksjonstest (PCR) for influensa, parainfluensa, RS-virus, Mycoplasma pneumoniae, Chlamydophila, Bordetella pertussis og humant metapneumovirus var negativ. Imidlertid var det funn av rhinovirus i dyp neseprøve. Dyrkning fra halsen viste normal flora, ingen vekst av muggsopp, men ved mikroskopisk undersøkelse ble det påvist grampositive kokker i kjeder. Direkte mikroskopi (Ziehl-Neelsen-farging) påviste ingen syrefaste staver. Videre var legionelladyrkning og Pneumocystis jiroveci-immunfluorescens negative. Biopsien fra stemmebåndet viste et lite fragment av irregulær plateepitelmetaplasi.
Det ble konferert med infeksjonslege, som mente at alvorlig bakteriell eller opportunistisk infeksjon var lite sannsynlig, så også cytomegaloviruspneumonitt og eosinofil pneumoni. Pasienten hadde ca. tre måneder tidligere også hatt eosinofili, men mer lavgradig. Siden pasienten var fra Afrika, kunne demaskering av okkult parasittsykdom i forbindelse med immunsuppresjonen være en mulighet. Man tok derfor avføringsprøver for ormer og parasitter, og serologisk prøve for strongyloides ble sendt til Smittskyddsinstitutet i Stockholm. Strongyloides ble vurdert å være den mest relevante og fryktede parasitten i dette tilfellet, på grunn av at alvorlig strongyloidiasis har høy mortalitet hvis den ikke behandles, og fordi strongyloides kan gi asymptomatisk sykdom i flere tiår (5). Vår pasient hadde ikke vært i endemiske områder på minst ni år.
Immunsupprimerte pasienter med uavklarte tilstander, der infeksjon kan mistenkes, bør utredes med tanke på mindre vanlige mikrober. Nyretransplanterte pasienter får etter protokoll seks måneders profylakse mot Pneumocystis jiroveci (6), tidligere kalt Pneumocystis carini (jamfør den mye brukte forkortelsen PCP, det vil si P. carini-pneumoni). Vår pasient fikk profylakse (trimetoprim-sulfametoksazol) i forbindelse med cytostatikabehandlingen.
Femte liggedøgn ble det tatt et nytt røntgen thorax, og dette viste normale funn. Samme dag ble ny polymerasekjedereaksjonstest for cytomegalovirus besvart, og antall kopier hadde nå steget til 924. Man startet derfor behandling med valganciklovir 450 mg × 2, dosert ut ifra estimert glomerulær filtrasjon (eGFR). Klinisk var pasienten fortsatt slapp og oppga at han ofte frøs. Eosinofile granulocytter fortsatte å stige, og tallet var på det høyeste 7,31 · 10⁹/l. CRP falt til 7 mg/l. Serologi for filariasis, schistosomiasis og toxocara canis ble etterrekvirert. Sistnevnte ble raskt ferdig analysert, med negativt funn.
Ti dager etter innkomst ble det påvist store mengder orm av typen Strongyloides stercoralis i avføringsprøve analysert ved vår mikrobiologiske avdeling (fig 1). Andre parasitter, cyster, egg eller larver ble ikke påvist. Samme dag ble CMV-PCR-kontrollprøve besvart, og virusmengden var nå så lav at den ikke lot seg kvantitere. Det ble så startet med ivermectin peroralt. Siden både dette medikamentet og takrolimus metabliseres via CYP3A4-systemet (7), ble konsentrasjonen av takrolimus i blodet monitorert hyppig.
Pasienten ble forbigående noe verre respiratorisk før han ble klinisk bedre etter omtrent en uke. Etter to dagers behandling kunne strongyloides ikke lenger påvises i avføringen. Ved behandlingsstart var nivået av eosinofile graulocytter på 3,26, men falt til en normal verdi på 0,33 etter seks dagers behandling. Man vurderte da at infeksjonen var så godt behandlet at han fikk sin neste R-CHOP-kur etter åtte dager med ivermectin. Fire dager senere ble han utskrevet til sitt eget hjem med god allmenntilstand. Serologisk prøve for strongyloides ble besvart rett før utskrivning, og var positiv. Endelig svar på dyrkning av mykobakterier var negativ.
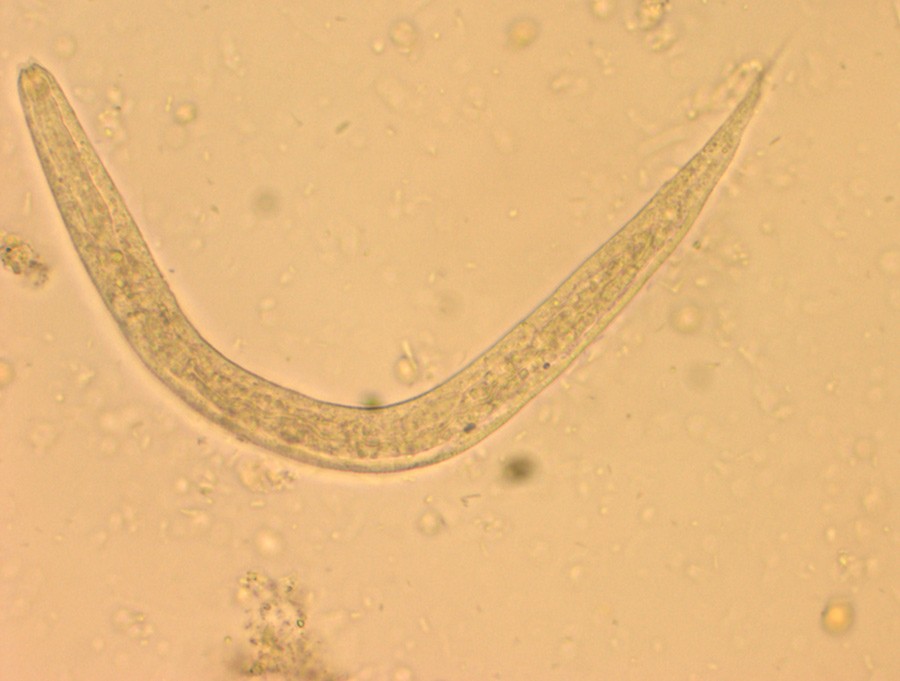
Figur 1Strongyloides stercoralis i avføringsprøven. Foto: Avdeling for mikrobiologi og smittevern, Akershus universitetssykehus
Diskusjon
Pasientens symptomer og funn talte for en parasittsykdom snarere enn en vanlig bakteriell lungebetennelse. Vår pasient hadde fått omfattende immunsuppressiv behandling med bakgrunn i sin kombinerte nyre- og pancreastransplantasjon. I tillegg fikk han metylprednisolon og antitymocyttglobulin på grunn av to akutte avstøtningsreaksjoner, og deretter cytostatika. Mindre enn to måneder etter oppstart av cytostatika fikk han symptomgivende reaktivering av Strongyloides, en alvorlig tilstand som er kjent for å kunne oppstå ved immunsuppresjon på grunn av nettopp lymfombehandling og/eller organtransplantasjon (8).
Malignitet, infeksjoner og reaktivering av latente mikrober er kjente komplikasjoner som kan oppstå etter langvarig eller intensiv immundempende medisinering. Vanlige bakterielle infeksjoner i lunger og urinveier samt virusinfeksjoner forårsaket av polyomavirus og cytomegalovirus er tilstander som bør utelukkes eller påvises tidlig i denne pasientgruppen (9), når symptomene taler for det.
Sykdom forårsaket av S. stercoralis hos sterkt immunsupprimerte er imidlertid ikke ukjent (10), men relativt uvanlig i Norge. Imidlertid antas omtrent 100 millioner mennesker å være infisert på verdensbasis. S. stercoralis er en intestinal nematode, og hovedsakelig ses den i tropiske og subtropiske strøk. Kronisk, asymptomatisk sykdom er det vanligste. Livssyklusen til nematoden er kompleks (fig 2) og har både en intern (parasittstadiet) og en ekstern (frittlevende) seksuell syklus (8). En infeksiøs larve penetrerer huden (for eksempel fotsålen) og migrerer til kutane blodårer. Den tar seg videre til lungene og ut i alveolene og bronkienes epitel, hvilket kan gi symptomer som ved en bronkopneumoni (8). Larvene hostes opp og svelges, og i tarmen modnes de til voksne ormer, formerer seg og legger egg (11). Herfra kan de enten følge avføringen ut, penetrere perianal hud og gi en autoinfeksjon eller penetrere tarmens mucosa og migrere til lungene og starte syklusen igjen (8).
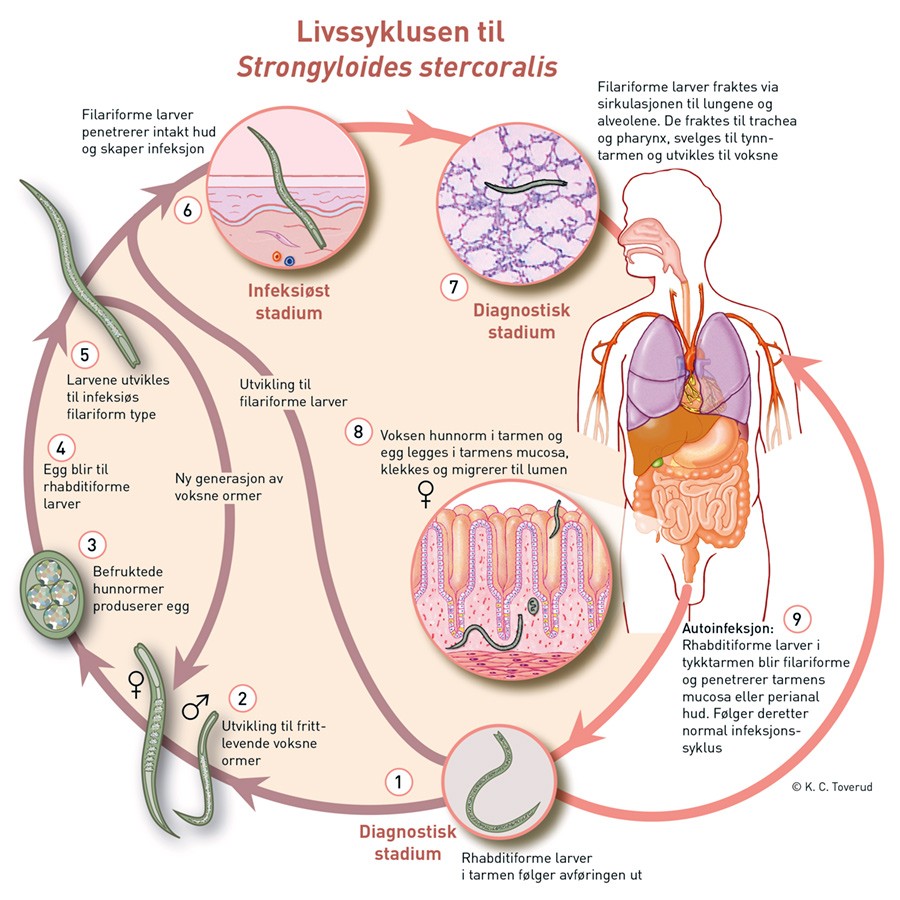
Figur 2 Livssyklusen til parasitten Strongyloides stercoralis. Bearbeidet og gjengitt med tillatelse fra Centers for Disease Control and Prevention
På grunn av denne autoinfeksjonssyklusen kan en person forbli infisert med Strongyloides i flere tiår (11, 12).
Hos immunsupprimerte kan parasittmengden øke dramatisk, og ved disseminert sykdom er mortaliteten høy, spesielt når diagnosen ikke gjenkjennes. Spesielt er bruk av kortikosteroider assosiert med hyperinfeksjonssyndromet, det vil si funn og symptomer forenlig med økt larvemigrasjon (11). Forskjellen mellom autoinfeksjon og hyperinfeksjon er ikke definert, men ved hyperinfeksjon ses utvikling eller forverring av gastrointestinale og pulmonale funn sammen med økt antall larver i avføring og sputum (11). Funn og symptomer fra luftveiene hos pasienter fra endemiske områder bør utredes med tanke på Strongyloides. Hyperinfeksjonssyndrom er beskrevet å kunne oppstå over 60 år etter at pasienten forlot et endemisk område (11).
Av lungemanifestasjoner er heshet og dyspné vanlig, og radiologisk ses oftest fokale eller bilaterale interstitielle infiltrater (11). Vår pasient hadde disse symptomene, og CT-bildene av lungene viste funn som kan være forenlige med diagnosen.
Disseminert sykdom oppstår hvis larvene migrerer fra lungene og gastrointestinalkanalen inn i andre organer og tar med seg mikrober inn i blodbanen. Sepsis kan da oppstå på grunn av bakteriemi med streptokokker, Candida, Escherichia coli, Klebsiella pneumoniae, Pseudomonas, Enterococcus faecalis, Proteus mirabilis med flere. Risikoen for å utvikle sepsis er økt hvis pasienten allerede er immunsupprimert, for eksempel hos nyretransplanterte (11). Stamcelletransplanterte pasienter har høyest insidens av fatal disseminert strongyloidiasis og høyere mortalitet enn andre transplanterte (11). Hivpasienter har imidlertid sjelden alvorlige strongyloidesinfeksjoner (13). En forklaring kan være økt TH2-respons og redusert TH1-cytokinprofil som kan ses ved aids (12).
Anbefalt behandling av latent eller kronisk aktiv strongyloidiasis er ivermectin peroralt 200 μg/kg/dag i to dager (11, 12). Ivermectin er et bredspektret middel mot helminter og ektoparasitter, som hemmer deres nevrotransmisjon (14). Alternativt gis tiabendazol 25 mg/kg/dag i tre dager, som sanerer infeksjonen hos omtrent 91 %, mens albendazol er lite effektivt mot strongyloides (8, 11, 12). Ved hyperinfeksjon og disseminert sykdom gis ivermectin 200 μg/kg/dag peroralt frem til avføringen har vært fri for parasitter i to uker. Om mulig bør den immunsuppressive medisineringen reduseres. Ivermectin kan ved behov gis subkutant eller rektalt (11).
Gjentatte målinger av B-takrolimus hos vår pasient viste høye verdier mens han var inneliggende (10,4 – 10,9 – 6,6 – 9,7 μg/l). Anbefalt nivå hos de fleste nyretransplanterte ligger i området 3 – 7 μg/l (6). Han kunne derfor med fordel ha brukt noe lavere doser med takrolimus mens han ble behandlet med ivermectin.
ELISA-tester kan måle IgG-respons på S. stercoralis i serum, men metoden tar minst fire uker og kan være falskt negativ ved akutte infeksjoner (11). Videre kan den forbli positiv i lang tid etter behandling. Hos pasienter med aktiv filariasis kan serologisk kryssreaktivitet oppstå (11).
Testing av pasienter fra endemiske områder blir anbefalt før organtransplantasjoner, spesielt før stamcelletransplantasjoner. Dette gjelder også asymptomatiske pasienter (8, 12). Så vidt vi vet gjøres ikke dette rutinemessig i Norge. Hos pasienter fra endemiske områder med eosinofili, hudlesjoner og/eller pulmonale eller gastrointestinale symptomer (smerter i epigastriet, diaré, duodenal obstruksjon) kan empirisk behandling med ivermectin være riktig (12). Fravær av eosinofili utelukker ikke strongyloidiasis og skal ikke brukes som screening (12).
