Symptomene på hjertesvikt er redusert utholdenhet, tungpustenhet og deklive ødemer. Dette skyldes nedsatt pumpefunksjon i hjertet (1). Pumpefunksjonen er avhengig av både adekvat kontraksjonskraft (systolisk funksjon) og effektiv fylling mellom hver kontraksjon (diastolisk funksjon).
Ved den best erkjente formen for hjertesvikt er kontraksjonskraften til venstre ventrikkel vesentlig redusert, noe som ledsages av ventrikkeldilatasjon og redusert ejeksjonsfraksjon (1). Denne formen for hjertesvikt betegnes derfor som «hjertesvikt med redusert ejeksjonsfraksjon» (1). Tilstanden regnes som et kardialt syndrom drevet av remodellering av venstre ventrikkel, med nekrose, fibrose og dysfunksjon av gjenværende hjertemuskelvev (2). Remodelleringen drives av kronisk sympatikusaktivering og aktivering av renin-angiotensin-aldosteron-systemet. Nevrohumoral blokade gir bedre prognose og er effektiv behandling av disse pasientene (2).
En rekke epidemiologiske studier etter årtusenskiftet har imidlertid vist at rundt 50 % av hjertesviktpasientene har normal ejeksjonsfraksjon (3, 4). Dette klassifiseres som «hjertesvikt med bevart ejeksjonsfraksjon», tidligere kalt «diastolisk hjertesvikt» (1).
Kriteriene for å stille denne diagnosen har vært endret flere ganger. I ramme 1 angis diagnosekriteriene fra retningslinjene til European Society of Cardiology fra 2016 (1).
Ramme 1 Kriteriene for å stille diagnosen hjertesvikt med bevart ejeksjonsfraksjon etter European Society of Cardiology, 2016 (1)
I grenseoppgangen mellom bevart og redusert ejeksjonsfraksjon er det flere gråsoner, noe begrepet «hjertesvikt med middels redusert ejeksjonsfraksjon» for pasienter med ejeksjonsfraksjon mellom 40 % og 50 % illustrerer (1). Ved enkelte sjeldne årsaker til hjertesvikt, som restriktiv perikardsykdom, avleiringssykdommer og hypertrofisk kardiomyopati, er ejeksjonsfraksjonen i en del tilfeller normal (1). Tradisjonelt er imidlertid betegnelsen hjertesvikt med bevart ejeksjonsfraksjon forbeholdt det multifaktorielle syndromet som omtales senere. De nevnte spesialtilfellene holdes utenfor.
Hjertesvikt med bevart ejeksjonsfraksjon er en heterogen tilstand. Sammenlignet med hjertesviktpasienter med redusert ejeksjonsfraksjon har disse pasientene høyere alder, er oftere kvinner, er preget av en lang rekke ikke-kardiale komorbiditeter, men har sjeldnere manifest koronar hjertesykdom (4).
Hjertesvikt med bevart ejeksjonsfraksjon omfatter dermed mange etiologiske undergrupper og bør oppfattes som et klinisk syndrom, men med felles patofysiologiske trekk. Hyppigheten av tilstanden øker i takt med en aldrende befolkning. Mortaliteten er marginalt lavere enn hos dem med hjertesvikt med redusert ejeksjonsfraksjon (3, 4), men i store randomiserte studier har betablokkere, hemmere av renin-angiotension-aldosteron-systemet og andre behandlingsstrategier vist seg å ha minimal eller ingen effekt på prognosen (5). Utover symptomatisk behandling med diuretika finnes det per i dag derfor ingen dokumentert virkningsfull farmakologisk behandling å tilby disse pasientene (1).
Forskjellene i epidemiologi og behandlingsrespons indikerer at hjertesvikt med redusert og hjertesvikt med bevart ejeksjonsfraksjon er to forskjellige tilstander med ulik patofysiologi (tab 1). En bedre forståelse av mekanismene bak hjertesvikt med bevart ejeksjonsfraksjon er viktig, og i denne oversiktsartikkelen presenteres oppdatert kunnskap om patofysiologien bak denne typen hjertesvikt.
Tabell 1
Oversikt over behandlingsrespons med redusert og bevart ejeksjonsfraksjon ved hjertesvikt
|
|
Bevart ejeksjonsfraksjon
|
Redusert ejeksjonsfraksjon
|
|
Kjønn
|
Kvinner > menn
|
Menn > kvinner
|
|
Alder
|
Eldre
|
«Yngre»
|
|
Hovedårsaker
|
Komobiditeter
|
Iskemi
|
|
Patofysiologi
|
Inflammasjon
|
Nevrohumoral aktivering
|
|
Terapi
|
Ingen effektiv
|
Veletablert
|
|
Venstre ventrikkels makrostruktur og -funksjon
|
|
|
|
Remodelering
|
Konsentrisk
|
Eksentrisk
|
|
Endediastolisk volum
|
↔
|
↑
|
|
Ejeksjonsfraksjon
|
↔
|
↓
|
|
Diastolisk stivhet
|
↑
|
↓
|
|
Venstre ventrikkels mikrostruktur og -funksjon
|
|
|
|
Kardiomyocytthypertrofi
|
Fortykket (konsentrisk)
|
Forlenget (eksentrisk)
|
|
Kardiomyocyttstivhet
|
↑
|
↓
|
|
Kardiomyocyttkontraktilitet
|
?
|
↓
|
Kunnskapsgrunnlag
Vi søkte i PubMed med kombinasjonen (“heart failure with preserved ejection fraction” OR “HFpEF” OR “diastolic heart failure”) AND (“mechanisms” OR “hypertrophy” OR “inflammation”). Dette ga per 6.4.2017 603 treff.
Ut fra tittelen plukket vi ut 132 engelskspråklige original- og oversiktsartikler som omhandlet årsaksmekanismer. En ytterligere seleksjon ble gjort på bakgrunn av sammendraget. 64 artikler, fortrinnsvis basert på humane data, ble lest i sin helhet, og av disse ble 15 brukt i artikkelen. I tillegg ble 13 referanser vurdert som relevante.
Patofysiologi
Et sentralt kjennetegn ved hjertesvikt med bevart ejeksjonsfraksjon er konsentrisk hypertrofi av venstre ventrikkel. Økningen i den relative veggtykkelsen i forhold til ventrikkelvolumet bidrar til bevart ejeksjonsfraksjon (lavt endediastolisk volum), men fører til et mindre elastisk hjerte og diastolisk dysfunksjon (6).
Diastolisk dysfunksjon kjennetegnes av økt motstand mot diastolisk fylling av venstre ventrikkel og dermed høye endediastoliske fyllingstrykk, noe som fører til lungestuvning og hjertesviktsymptomer (7). Hjertesvikt med bevart ejeksjonsfraksjon ble tidligere oppfattet som et resultat av nettopp diastolisk dysfunksjon og var av samme grunn kjent som diastolisk hjertesvikt. Imidlertid har det vist seg at diastolisk dysfunksjon er vanlig også ved hjertesvikt med redusert ejeksjonsfraksjon (8).
Videre er ikke konsentrisk hypertrofi og diastolisk dysfunksjon like uttalt hos alle med hjertesvikt med bevart ejeksjonsfraksjon (9). Det har derfor vært nødvendig å nyansere oppfatningen av de to typene hjertesvikt som rene henholdsvis diastoliske og systoliske fenomener. Ny forskning har avdekket en rekke andre forhold som bidrar til hjertesvikt med bevart ejeksjonsfraksjon – inkludert systolisk dysfunksjon, unormal hjerterytmeregulering, patologisk vaskulær stivhet, autonom dysfunksjon og perifer vaskulopati (10) (fig 1).
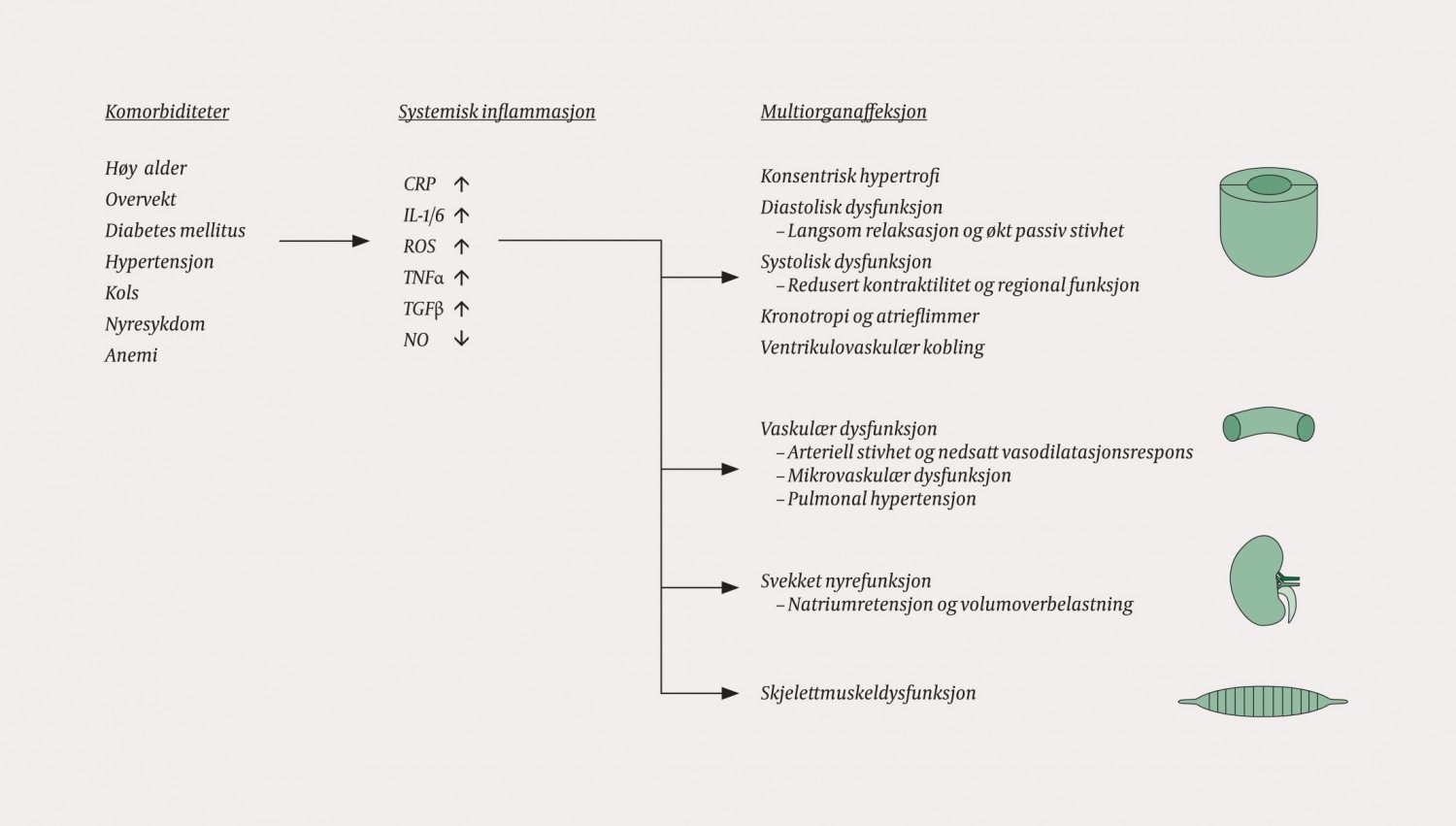
Figur 1 Forhold som bidrar til hjertesvikt med bevart ejeksjonsfraksjon, inkludert systolisk dysfunksjon, unormal hjerterytmeregulering, patologisk vaskulær stivhet, autonom dysfunksjon og perifer vaskulopati. CRP = C-reaktivt protein, IL = interleukin, NO = nitrogenmonoksid, ROS = reaktive oksygenradikaler, TGFβ = transformerende vekstfaktor β, TNFα = tumornekrosefaktor α
Diastolisk dysfunksjon
Diastolisk dysfunksjon anses fortsatt som et sentralt kjennetegn ved hjertesvikt med bevart ejeksjonsfraksjon. Diastolisk dysfunksjon diagnostiseres ekkokardiografisk på bakgrunn av avvikende fyllingsmønstre og reduserte diastoliske vevshastigheter, men gullstandarden er påvisning av langsom relaksasjon og forhøyede endediastoliske trykk ved invasiv hjertekateterisering (11).
Normal diastolisk funksjon er avhengig av to konseptuelle egenskaper ved hjertet. Disse er den aktive relaksasjonen, som inntrer ved diastolens begynnelse, og hjertets passive stivhet. Langsom relaksasjon og økt passiv stivhet begrenser den diastoliske fyllingen ved hjertesvikt med bevart ejeksjonsfraksjon (11).
Aktiv relaksasjon er avhengig av den energikrevende kalsiumhåndteringen i hjertemuskelcellene (kardiomyocyttene). Kardiomyocyttkontraksjonen trigges av kalsiuminnstrømming, og relaksasjonen er derfor avhengig av at kalsium i løpet av diastolen enten transporteres ut av cellen eller pumpes inn i det sarkoplasmatiske retikulum (12).
Den viktigste ionebytteren som transporterer kalsium ut av cellen er natrium-kalsium-bytteren, mens sarkoplasmatisk retikulum kalsium-ATPasen (SERCA) pumper kalsium tilbake til det sarkoplasmatiske retikulumet. Ved hjertesvikt med redusert ejeksjonsfraksjon er forstyrret natrium-kalsium-bytter og SERCA-funksjon, med påfølgende forstyrrelser i kalsiumhomøostasen, en viktig årsak til svekket kontraksjonskraft (2).
De få studiene der man har undersøkt tilsvarende i hjertesvikt med bevart ejeksjonsfraksjon indikerer at redusert natrium-kalsium-bytter-funksjon bidrar til langsommere og ufullstendig relaksasjon i denne tilstanden (13). Vi har imidlertid i en nylig publisert studie vist at forstyrret kalsiumhomøostase ikke er en forutsetning for diastolisk dysfunksjon (14). Økningen i venstre ventrikkels passive stivhet er derfor sannsynligvis av større betydning (14).
Hjertets passive stivhet er avhengig både av dets geometriske konfigurasjon og myokardvevets egenskaper (6). Hjertesvikt med bevart ejeksjonsfraksjon kjennetegnes geometrisk ofte av konsentrisk hypertrofi, og økningen i veggtykkelse sammenliknet med venstre ventrikkels volum gjør ventrikkelen mindre elastisk.
Også myokardvevets iboende stivhet er økt, noe som i hovedsak skyldes to forhold: økt deponering av ekstracellulære kollagenfibre (fibrose) og økt stivhet i det intracellulære proteinet titin (15). Titin utgjør en viktig del av kardiomyocyttens celleskjelett og regulerer cellens stivhet. Redusert fosforylering av titin fremstår som en sentral mekanisme når det gjelder økt passiv stivhet og diastolisk dysfunksjon i hjertesvikt med bevart ejeksjonsfraksjon (15).
Systolisk dysfunksjon
Systolisk og diastolisk funksjon er gjensidig avhengige funksjoner, og diastolisk dysfunksjon ledsages av redusert systolisk funksjon. Venstre ventrikkels ejeksjonsfraksjon er ofte blitt brukt som et mål på systolisk funksjon, men ejeksjonsfraksjonen er et hemodynamisk mål og et grovt estimat på funksjonen til selve myokardvevet.
På tross av normal ejeksjonsfraksjon viser mer sensitive ekkokardiografiske teknikker at pasienter med hjertesvikt med bevart ejeksjonsfraksjon har global og regional systolisk dysfunksjon (16–18). Spesielt er langaksemyokardforkortingen målt med strain-baserte teknikker redusert (7, 16, 18).
Den systolisk dysfunksjonen blir mer fremtredende under fysisk belastning, slik til at anstrengelse ikke gir normal økning i ejeksjonsfraksjon (19). Redusert hjertemuskelkontraktilitet ved hjertesvikt med bevart ejeksjonsfraksjon korrelerer med økende mortalitet, og dette indikerer at systolisk dysfunksjon bidrar til sykdomsprogrediering (17).
Kronotropi og atrieflimmer
Mange hjertesviktpasienter med bevart ejeksjonsfraksjon lider under manglende pulsøkning ved fysisk belastning (svekket kronotropirespons) og dermed redusert fysisk yteevne (19). Dette er uavhengig av bruk av negativt kronotrope medikamenter (slik som betablokkere). Fenomenet er antagelig et uttrykk for enten lokal desensitivisering av betaadrenoreseptorer i sinusknuten eller global autonom dysfunksjon (7, 19).
Vedvarende høye fyllingstrykk fører også til strukturell og elektrisk remodelering i atriene, og en stor andel av hjertesviktpasientene med bevart ejeksjonsfraksjon utvikler atrieflimmer (20). Bortfall av den synkrone atriekontraksjonen vil ytterligere forverre de diastoliske fyllingsproblemene, og atrieflimmer ved hjertesvikt med bevart ejeksjonsfraksjon er dermed assosiert med økt morbiditet og mortalitet (20).
Vaskulær dysfunksjon og ventrikulovaskulær kobling
Den perifere vaskulære funksjonen er kompromittert hos hjertesviktpasienter med bevart ejeksjonsfraksjon (7). Mikrovaskulær dysfunksjon rammer de små karene både i koronarsirkulasjonen og i perifere organer. Dette ledsages av iskemi, inflammasjon og dysfunksjon i disse organene (fig 1). I tillegg rammes de større karene av økt stivhet og svekket vasodilatasjonsrespons (10).
Ventriklenes dynamiske funksjon er avhengig av karstivheten (betegnet ventrikulovaskulær kobling). Økt vaskulær stivhet ved hjertesvikt med bevart ejeksjonsfraksjon leder til venstre ventrikkel-dysfunksjon og kraftige blodtrykkssvingninger ved endringer i fyllingstrykk og arterietrykk.
Vaskulær dysfunksjon rammer ikke bare den systemiske sirkulasjonen. Også pulmonal hypertensjon er vanlig (21) og antagelig et resultat av forhøyede venstresidige fyllingstrykk kombinert med pulmonal endoteldysfunksjon. Pulmonal hypertensjon bidrar til høyre ventrikkel-dysfunksjon ved hjertesvikt med bevart ejeksjonsfraksjon (21).
Andre faktorer
I tillegg til de kardiovaskulære faktorene omtalt over bidrar en rekke perifere forstyrrelser til symptombildet hos hjertesviktpasienter med bevart ejeksjonsfraksjon (7). Dette inkluderer særlig metabolske og vaskulære endringer i skjelettmuskulatur og manifesterer seg som redusert arteriovenøs O2-differanse (22).
Nylig er også kronisk nyresykdom blitt foreslått som en patofysiologisk mekanisme. Svekket nyrefunksjon med avvikende salt- og væskeregulering kan bidra til hemodynamisk volumoverbelastning ved hjertesvikt med bevart ejeksjonsfraksjon (23).
Komorbiditeter og systemisk inflammasjon
Hjertesviktpasienter med bevart ejeksjonsfraksjon har høy prevalens av ikke-kardiale komorbiditeter. De viktigste er overvekt, diabetes mellitus, kronisk obstruktiv lungesykdom, kronisk nyresykdom, arteriell og/eller pulmonal hypertensjon og anemi (3, 4). Det multifaktorielle bildet indikerer at tilstanden er mer å regne som et systemisk syndrom enn som en ren hjertesykdom.
Mens nevrohumoral aktivering er sentralt for utviklingen av hjertesvikt med redusert ejeksjonsfraksjon, har det vært utfordrende å identifisere tilsvarende årsaksmekanismer når det gjelder utviklingen av hjertesvikt med bevart ejeksjonsfraksjon. I 2013 ble en ny teori om de underliggende mekanismene lansert (10). Denne fremhever nettopp betydningen av komorbiditeter.
I grove trekk antar man at årsakskjeden bak hjertesvikt med bevart ejeksjonsfraksjon er som følger: høy forekomst av komorbiditeter resulterer i en systemisk proinflammatorisk respons, systemisk inflammasjon leder til endotelinflammasjon og mikrovaskulær angiopati, mikrovaskulær inflammasjon induserer danning av skadelige mediatorer og reduserer biotilgjengeligheten av blant annet nitrogenmonoksid i en rekke organer og inflammatoriske mediatorer aktiverer patologisk signalering som fører til multiorgandysfunksjon.
For eksempel forklarer redusert biotilgjengelighet av nitrogenmonoksid den svekkede vasodilatasjonsresponsen og den økte karstivheten. Lave nivåer av syklisk guanosinmonofosfat med redusert aktivering av proteinkinase G er involvert i utviklingen av venstre ventrikkel-hypertrofi, ekstracellulær fibrose og økt kardiomyocyttstivhet (10).
Veien videre
Teorien om at hjertesvikt med bevart ejeksjonsfraksjon er et multiorgansyndrom drevet av inflammasjon og endoteldysfunksjon støttes av stadig flere studier (24). Også oksidativt stress ser ut til å bidra (25). Siden tilstanden omfatter en heterogen gruppe pasienter, vil det antagelig være forskjellige årsaksmekanismer, avhengig av hvilke komorbiditeter som ligger til grunn.
Oppmerksomhet overfor denne heterogeniteten er nødvendig når nye terapeutiske strategier skal utvikles. Da man antar det er komorbiditeter som bidrar til inflammasjon og multiorgandysfunksjon, bør behandlingen rette seg mot den enkelte pasients komorbide tilstander (26). En slik fenotypespesifikk behandlingsstrategi inngår i retningslinjene til European Society of Cardiology (1).
Kunnskap om hvilke hemodynamiske forhold som bidrar til symptomene er også nyttig når terapeutiske angrepspunkter skal identifiseres. I en nylig publisert oversiktsartikkel gjennomgås detaljene rundt slike målrettede behandlingsstrategier (27). For eksempel forsøker man å bedre den diastoliske funksjonen ved å modulere venstre ventrikkels aktive relaksasjon og/eller passive stivhet. Hemming av den ekstracellulære kollagenproduksjonen eller endring av titinproteinets egenskaper er foreslåtte angrepspunkter i denne sammenhengen.
Autonom dysfunksjon utgjør et annet angrepspunkt, og autonom modulering ved for eksempel hjelp av vagusstimulering kan være en mulig behandlingsstrategi. Nytten av annen mekanisk behandling (device), slik som resykroniseringsterapi, er foreløpig uklar. Derimot er fysisk trening en målrettet intervensjon som er vist å være effektiv ved hjertesvikt med bevart ejeksjonsfraksjon, mediert av gunstige effekter på endotelfunksjon, karstivhet og skjelettmuskelmetabolisme (28).
I tillegg er andre behandlingsstrategier under utvikling, rettet mot sykdomsdrivende signalveier (27). Antiinflammatorisk behandling kan tenkes å få en plass på bakgrunn av den antatt underliggende systemiske inflammasjonsprosessen. Lav biotilgjengelighet av nitrogenmonoksid kan behandles med inorganiske nitrater, mens nedstrøms stimulering av syklisk guanosinmonofosfat/proteinkinase G for øyeblikket testes i flere ulike studier.
Selv om lovende behandling er under utvikling, er veien videre lang. Historien er full av mekanistisk funderte terapier som aldri har nådd klinikken. I påvente av fremtiden er det imidlertid viktig ikke å gi opp denne pasientgruppen. Avslutningsvis kan det derfor være nyttig å huske på at symptomlindring og forbedret livskvalitet kanskje er et vel så viktig behandlingsmål som overlevelse for disse pasientene.
