Mykobakterier er aerobe stavbakterier som ikke danner sporer, er ubevegelige og «syrefaste», dvs. de lar seg ikke avfarge ved syre-alkohol-spesialfarging. Veksthastigheten er generelt lav, men varierer. Dette danner grunnlag for inndeling i hurtig- og langsomtvoksende arter, definert som vekst på fast medium før eller etter syv dager, ved utsæd fra flytende bakteriekultur. Ikke-tuberkuløse mykobakterier har varierende patogenisitet og finnes normalt i miljøet, f.eks. i jord og vann, men kan gi infeksjoner hos både mennesker og dyr. Bakteriene kan også kolonisere medisinsk utstyr. I USA og Europa er den vanligste årsaken til lungeinfeksjon med ikke-tuberkuløse mykobakterier Mycobacterium avium-komplekset (MAC), etterfulgt av M. kansasii, M. abscessus-komplekset og M. malmoense – i litt varierende rekkefølge avhengig av geografisk område. Enkelte steder er M. fortuitum og M. xenopi vanligere enn de sistnevnte (1, 2). M. abscessus-komplekset og M. fortuitum er hurtigvoksende arter, de øvrige er langsomtvoksende.
Med introduksjon av nye molekylære metoder har stadig flere ikke-tuberkuløse mykobakteriearter blitt identifisert, per i dag 186 arter og 13 underarter (3, 4). Inndeling i grupper/kompleks, arter og underarter er i stadig endring og kan variere avhengig av metode. Dette kan ha klinisk betydning og innvirkning på valg av antibiotika. Spesielt gjelder dette den hurtigvoksende arten M. abscessus, som nå betegnes som et kompleks og inndeles i tre ulike underarter (subspecies): subsp.abscessus, bolletii og massiliense. Induserbar makrolidresistens kan finnes hos de to førstnevnte underartene, og er assosiert med dårligere behandlingsresultat (5).
Sannsynlighet for infeksjon med mykobakterier varierer med artens patogenisitet, grad av eksponering og personens mottagelighet. Tidligere ble det antatt at smitte mellom mennesker ikke forekom, men nyere kasuistikker kan tyde på at det kan skje mellom pasienter med cystisk fibrose (6, 7). Det er imidlertid såvidt vi vet ingen enighet om at dette krever spesielle smittevernstiltak.
Frem til 1950-årene dominerte M. tuberculosis ved lungeinfeksjoner forårsaket av mykobakterier, og ikke-tuberkuløse mykobakterier ble stort sett regnet som ikke-patogene. Samtidig som forekomsten av tuberkulose gikk ned, ble et økende antall pasienter diagnostisert med lungeinfeksjoner forårsaket av ikke-tuberkuløse mykobakterier. Under hivepidemien i 1980-årene økte forekomsten av systemiske ikke-tuberkuløse mykobakterieinfeksjoner, og behovet for bedre behandling fikk økt oppmerksomhet.
Infeksjoner med ikke-tuberkuløse mykobakterier er ikke meldepliktige i de fleste land, inkludert Norge, og påvisning av lungeinfeksjon baserer seg på kliniske, radiologiske og mikrobiologiske kriterier. Det er derfor vanskelig å få god oversikt over forekomst. Likevel tyder studier fra andre land på en økning de siste årene, som ikke kan forklares med hivepidemien eller bedre diagnostikk (1, 8). Det er foreslått mange årsaker til dette, som en større andel eldre i befolkningen, lavere BCG-vaksinasjonsdekning, flere som lever lenger med strukturelle lungesykdommer (bronkiektasier, kronisk obstruktiv lungesykdom) og sykdommer som nedsetter immunforsvaret (malignitet, diabetes mellitus m.m.) (9), i tillegg til økt bruk av immunmodulerende behandling (10). I motsetning til tuberkulose er det vanskelig å si om infeksjoner med ikke-tuberkuløse mykobakterier er hyppigere hos personer fra andre land enn Norge, siden vi ikke har oversikt over forekomsten hos oss.
Diagnostikk og behandling av lungeinfeksjoner med ikke-tuberkuløse mykobakterier er utfordrende. Internasjonale retningslinjer bygger i stor grad på erfaring og kasuistikker (11–13). Temaet er kort og generelt omtalt i Tuberkuloseveilederen, utover det finnes ingen nasjonal behandlingsveileder om temaet. Vi ønsket å sammenfatte den nyeste kunnskapen om emnet, med hovedvekt på diagnostikk og behandling.
Kunnskapsgrunnlag
I 2007 utga American Thoracic Society (ATS) og The Infectious Diseases Society of America (IDSA) en felles retningslinje for diagnostikk, behandling og forebygging av ikke-tuberkuløse mykobakterieinfeksjoner (11). Disse retningslinjene danner grunnlaget for mange av de anbefalingene om diagnostikk og behandling som presenteres i denne artikkelen. I tillegg er nyere kunnskap og retningslinjer inkludert. I 2016 kom retningslinjer for behandling av pasienter med cystisk fibrose (CF) (12), og i 2017 utga British Thoracic Society (BTS) egne anbefalinger (13) som bygger på en gjennomgang av relevant litteratur og ekspertpanelets konklusjoner.
Vi søkte i PubMed, Embase og Cochrane etter alle oversiktsartikler og systematiske oversiktsartikler publisert i tidsrommet 2007‒17 som omhandler ikke-tuberkuløse mykobakterier som årsak til lungesykdom (se søkestreng i appendiks). Søket ble avsluttet 28. september 2017. Dette ga totalt 215 treff. Artikler som var på annet språk enn engelsk eller ble vurdert til ikke å dekke temaet (infeksjoner hos dyr, lokale epidemiologiske data og infeksjoner hos barn), samt infeksjoner hos hivpasienter ble ekskludert, i alt 103 artikler. Totalt 112 artikler ble gjennomgått i sin helhet. Blant disse ble i tillegg henvisninger til relevant originallitteratur gjennomgått, totalt 50 artikler.
Diagnostisering
I anbefalingen fra American Thoracic Society og The Infectious Diseases Society of America er det angitt kriterier for kliniske, radiologiske og bakteriologiske funn for å avgjøre om en mistenkt lungeinfeksjon med ikke-tuberkuløse mykobakterier er aktuell for behandling (11) (ramme 1).
Ramme 1 Kliniske, radiologiske og mikrobiologiske kriterier for
lungesykdom med ikke-tuberkuløse mykobakterier (11)
Kliniske/radiologiske kriterier
-
Lungesymptomer og nodulære eller kavitære oppklaringer på lungerøntgenbilde eller multifokale bronkiektasier med multiple små noduli på CT thorax
og
-
Tilstrekkelig utelukkelse av andre diagnoser
Mikrobiologiske kriterier
-
Oppvekst i minst to separate ekspektoratprøver. Hvis resultatene ikke er diagnostiske, vurder nye direkte mikroskopiprøver for syrefaste bakterier og dyrkning
eller
-
Oppvekst i én bronkialskylling eller bronkoalveolær lavage
eller
-
Transbronkial eller annen lungebiopsi med histologiske funn forenlig med mykobakterieinfeksjon (granulomatøs betennelse eller syrefaste staver) og oppvekst av ikke-tuberkuløse mykobakterier, eller biopsi med funn forenlig med mykobakteriell infeksjon og én eller flere ekspektoratprøver eller bronkoalveolær lavage med oppvekst
Man bør konsultere lege med erfaring på feltet ved oppvekst av uvanlige mikrober eller mikrober som vanligvis representerer kontaminering.
Mistenker man ikke-tuberkuløs mykobakterierelatert lungesykdom hos en pasient som ikke oppfyller kriteriene, bør denne følges til diagnosen er bekreftet eller avkreftet.
Diagnosen lungesykdom med ikke-tuberkuløse mykobakterier betyr ikke i seg selv at behandling må iverksettes. Det må avgjøres etter nøye overveielse av potensiell risiko og nytte for den enkelte pasient.
Klinisk undersøkelse
Symptomer på infeksjon med ikke-tuberkuløse mykobakterier i lungene er som regel uspesifikke. Hoste, økt slimdannelse, vekttap, lavgradig feber, hemoptyse og dyspné er vanlig. I tillegg har pasientene ofte underliggende sykdom som kan gi tilsvarende symptomer. Symptombildet kan ligne på det man finner ved tuberkulose (14, 15).
Pasienter med cystisk fibrose eller bronkiektasier har en overhyppighet av lungeinfeksjoner med ikke-tuberkuløse mykobakterier, og i en nylig publisert metaanalyse fant man tilstanden hos 9,3 % av pasientene med bronkiektasier (16). I tillegg er det funnet overrepresentasjon av mutasjon i cystisk fibrose-transmembranregulatorgenet (CFTR-genet) hos pasienter med ikke-tuberkuløse mykobakterieinfeksjoner, uten at disse har klinisk cystisk fibrose (heterozygot mutasjon) (17–20). Årsaken til dette, og hvilken rolle CFTR-genet spiller, er fortsatt ukjent.
En uvanlig sykdomsmanifestasjon er hypersensitivitetspneumonitt. Årsaken antas å være en immunologisk reaksjon på inhalerte ikke-tuberkuløse mykobakterier i aerosol fra infisert vann, inkludert svømmebasseng og boblebad (21, 22), også kalt «hot tub lung». Kliniske og radiologiske funn skiller seg ikke fra andre hypersensitivitetspneumonitter.
Radiologisk undersøkelse
Ved mistanke om lungesykdom som skyldes ikke-tuberkuløse mykobakterier bør pasienten utredes med CT thorax. De to vanligste radiologiske presentasjonsformene er fibrokavitær og nodulær bronkiektatisk form (23, 24). Den fibrokavitære formen har kavitære lesjoner, hyppigst i overlappene, med radiologiske funn som ligner tuberkulose (figur 1). Denne formen har ofte et mer aggressivt forløp og ses hyppigst hos eldre menn som røyker eller har annen lungesykdom, f.eks. kronisk obstruktiv lungesykdom eller gjennomgått tuberkulose. Nodulær bronkiektatisk form preges av multifokale bronkiektasier og små noduli, oftest hos ikke-røykende, eldre kvinner. Denne formen er ellers overrepresentert blant pasienter med lav kroppsmasseindeks, skoliose, pectus excavatum, mitralprolaps og hos høye personer (17, 19).

Figur 1 CT thorax av en pasient med alvorlig kols med emfysem. Det ses kavernøse og fibrotiske forandringer samt infiltrater. Det var gjentatt oppvekst av M. intracellulare i luftveisprøver.
Mikrobiologisk undersøkelse
Mikrobiologisk diagnostikk av lungesykdom forårsaket av ikke-tuberkuløse mykobakterier kan være vanskelig fordi disse finnes naturlig i omgivelsene. I motsetning til ved tuberkulose, der funn av bakterien bekrefter sykdom, vil funn av ikke-tuberkuløse mykobakterier i luftveiene ikke være ensbetydende med klinisk relevant infeksjon. Det er en stor risiko for kontaminering av ekspektorat- eller bronkoskopiprøver (f.eks. fra munnhulen), og et positivt funn kan også representere kolonisering av luftveier uten at dette er årsak til pasientens plager. Påvist art er av stor betydning, siden enkelte arter er mer patogene enn andre (9, 25) (figur 2). Forekomst av klinisk relevant lungeinfeksjon med de ulike artene vil også være avhengig av bakteriens geografiske utbredelse i omgivelsene og forekomst av risikofaktorer hos befolkningen (1, 25). Som mikrobiologisk kriterium på lungeinfeksjon med ikke-tuberkuløse mykobakterier kreves oppvekst i to eller flere ekspektoratprøver som er tatt på ulike tidspunkt. Alternativt aksepteres oppvekst i kun én prøve tatt via bronkoskop (bronkoalveolær lavage (BAL)) eller oppvekst i lungebiopsi (11). Ved lungemedisinsk og infeksjonsmedisinsk avdeling ved Oslo universitetssykehus ønsker vi alltid at det tas ekspektoratprøver med noen ukers mellomrom for å bekrefte vedvarende infeksjon. Det har vært diskusjon om disse kriteriene, spesielt at kun én bronkoskopiprøve er tilstrekkelig, da kontaminering også her er en risiko. Man må uansett bruke kriteriene med skjønn og vektlegge hvilke mikrober som er funnet, samt om øvrige funn og klinisk presentasjon er overbevisende.
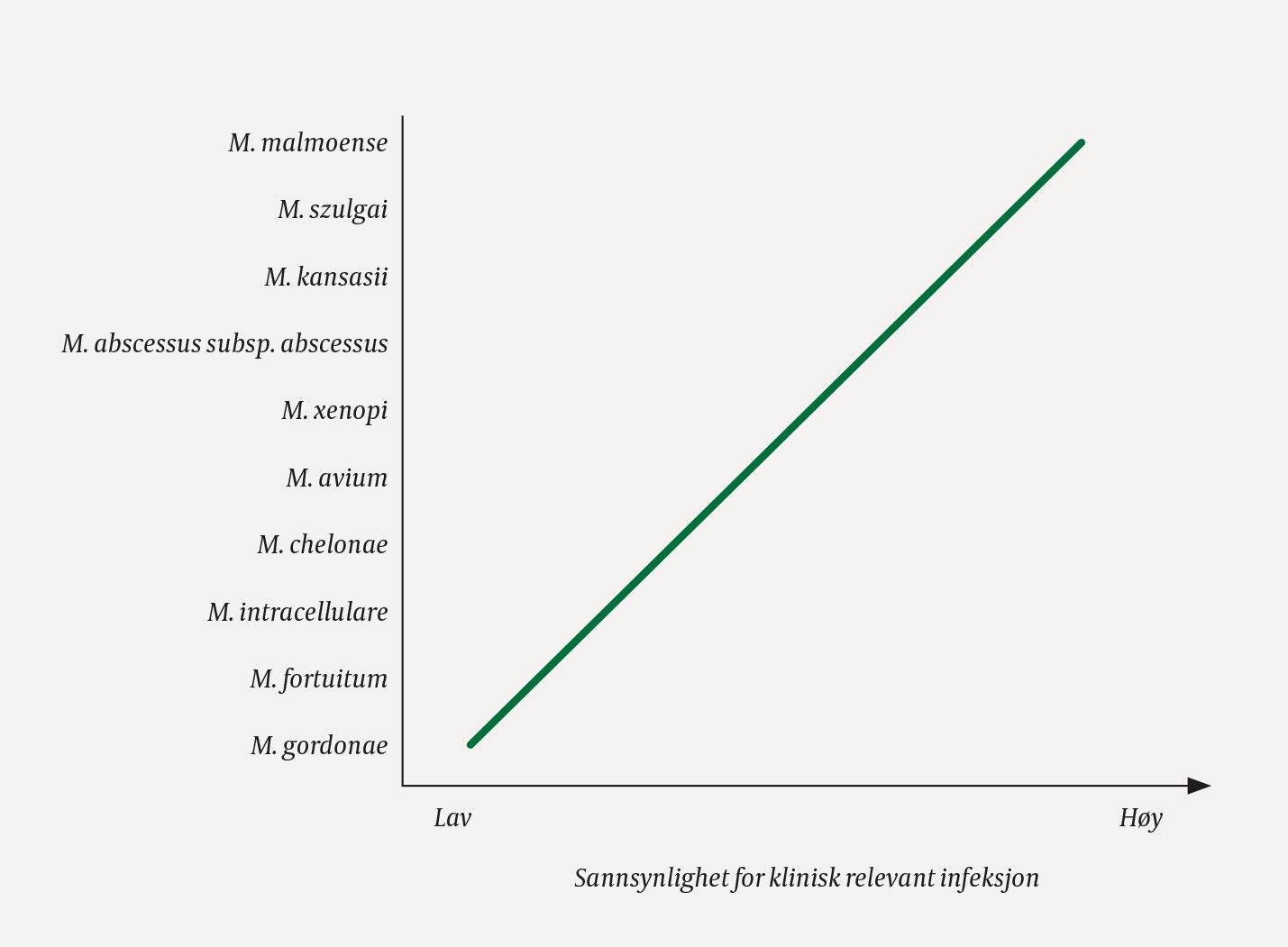
Figur 2 Funn av ikke-tuberkuløse mykobakterier i luftveisprøver og sannsynligheten for at disse representerer klinisk relevant infeksjon (9, 25).
For å kunne velge riktig behandlingsregime er det i tillegg til å identifisere bakterien viktig å utføre relevant resistenstesting. For de hurtigvoksende mykobakteriene er det anbefalt å utføre resistenstesting for en rekke antibiotika, mens det for de langsomtvoksende er anbefalt å teste for færre medikamenter. Dessverre er det usikker sammenheng mellom in vitro-resistensbestemmelse og in vivo-effekt for flere av de aktuelle medikamentene. Eksempelvis er det ved infeksjon med Mycobacterium avium-komplekset kun makrolider og amikacin som har samsvarende in vitro- og in vivo-effekt (26–28).
Makrolidfølsomhet har vist seg å være en viktig prognostisk indikator ved behandling av infeksjoner med ikke-tuberkuløse mykobakterier (5, 29). I tillegg til ervervet resistens som skyldes mutasjoner i 23S rRNA-genet (rrl-genet), har man de siste årene blitt oppmerksom på induserbar makrolidresistens hos enkelte hurtigvoksende ikke-tuberkuløse mykobakterier. Disse kan initialt være følsomme for makrolider, men ved eksponering for makrolider i 14 dager in vitro påvises det resistens. Dette er knyttet til et funksjonelt erm-gen hos enkelte arter og underarter (30). Det er derfor viktig at man tar hensyn til dette ved resistensbestemmelse i laboratoriene og ved valg av antibiotikaregime. Den viktigste risikofaktoren for å utvikle makrolidresistens er behandling med makrolider i monoterapi (31). I lys av dette, og fordi makrolider er så sentrale i behandlingen av disse infeksjonene, har det vært reist spørsmål ved langtidsbehandling med makrolider hos lungepasienter, som for eksempel pasienter med cystisk fibrose (32, 33).
Behandling
Det finnes enkelte randomiserte, kontrollerte studier der man har forsøkt å evaluere behandlingseffekt av ulike regimer (34–38). Disse studiene har imidlertid flere svakheter og gir ikke entydige svar. Anbefalte behandlingsregimer bygger derfor i stor grad på empiri og ekspertuttalelser. I det følgende redegjør vi kort for dette, men for en mer fullstendig omtale vises det til amerikanske og britiske retningslinjer (11, 13). Dersom ikke annet er angitt, er behandlingene som anbefales i artikkelen hentet fra disse retningslinjene.
Behandling av lungeinfeksjoner med ikke-tuberkuløse mykobakterier er langvarig, krever samtidig bruk av flere antimikrobielle medikamenter og har varierende effekt. Behandlingssuksess defineres som negative ekspektoratprøver i 12 måneder under pågående behandling. Generelt anbefales behandling i minst 18 måneder. Unntaket er behandling av hypersensitivitetspneumonitt, der det ikke er sett sikker effekt av behandling med antimikrobielle midler. Anbefalt terapi for dette er systemiske glukokortikoider og å unngå ytterligere eksponering.
Behandlingsregimene er ressurskrevende og medfører ofte bivirkninger og interaksjoner. Samtidig er det stor variasjon i det naturlige forløpet av disse infeksjonene ‒ fra subklinisk til raskt progredierende sykdom. Det er derfor svært viktig at det gjøres en grundig vurdering av pasienten med tanke på om det er formålstjenlig å starte behandling. Samtidig er det viktig å optimalisere annen behandling, som f.eks. slimmobilisering og lungefysioterapi, og å utelukke annen årsak til sykdom. Det anbefales å monitorere behandlingseffekten med ekspektoratprøver tatt med 1‒2 måneders intervall. Dersom man fortsatt finner oppvekst i ekspektorat etter seks måneders behandling, er behandlingssvikt sannsynlig. Da bør det tas nye prøver for resistensbestemmelse før antibiotikaregimet revurderes. Selv om målet med behandlingen oftest er kurasjon, vil dette for enkelte være urealistisk. Suppresjon av infeksjonen kan da være behandlingsmålet.
Generelt om aktuelle antibiotika
I behandlingen av ikke-tuberkuløse mykobakterier har makrolider en viktig plass. Blant disse er det ikke vist sikker forskjell i effekt mellom klaritromycin eller azitromycin, og fordelen med sistnevnte er først og fremst færre interaksjoner. Også ved bruk av rifampicin må man være oppmerksom på interaksjoner. Vanlig dosering av rifampicin er 600 mg ved vekt over 50 kg, 450 mg ved lavere vekt. I internasjonale retningslinjer anbefales streptomycin eller amikacin som aminoglykosid, med unntak av ved behandling av M. chelonae, der tobramycin har vist best effekt. Serumkonsentrasjonsbestemmelse av streptomycin er lite tilgjengelig, noe som gjør at amikacin foretrekkes av disse to. Ved behandling med aminoglykosider må nyrefunksjonen vurderes, serumkonsentrasjon måles, og pasienten må følges med tanke på ototoksisitet. Ved bruk av isoniazid anbefales tillegg av pyridoksin 40 mg x 1 daglig for å forebygge polynevropati, og ved behandling med etambutol bør visus- og fargesyn testes før oppstart og ved symptomer. EKG er anbefalt før oppstart og etter to uker ved behandling med medikamenter som kan gi forlenget QT-tid, som f.eks. makrolider og fluorokinoloner (13).
I tabell 1 gjengis våre anbefalinger for behandling av de vanligste lungesykdommene forårsaket av ikke-tuberkuløse mykobakterier i henhold til de amerikanske og britiske retningslinjene (11, 13).
Tabell 1
Forfatternes anbefalte behandling av lungesykdom med de vanligste ikke-tuberkuløse mykobakteriene i henhold til amerikanske og britiske retningslinjer (11, 13).
|
|
Medikamentregime
|
Varighet
|
|
Mycobacterium avium-komplekset
|
|
|
|
Nodulær/bronkiektatisk sykdom
|
Tre ganger i uken
Klaritromycin 1 000 mg peroralt
(alternativt azitromycin 500 mg peroralt)
+ etambutol 25 mg/kg peroralt
+ rifampicin 450‒600 mg peroralt
eller
Daglig
Klaritromycin 500 mg x 2 peroralt (alternativt azitromycin 250‒500 mg x 1 peroralt)
+ etambutol 15 mg/kg peroralt
+ rifampicin 450‒600 mg peroralt
|
12 måneder etter negative ekspektoratprøver
|
|
Kavitær sykdom
|
Daglig
Klaritromycin 500 mg x 2 peroralt (alternativt azitromycin 250‒500 mg x 1 peroralt)
+ etambutol 15 mg/kg x 1 peroralt
+ rifampicin 450‒600 mg x 1 peroralt
og ev. i tillegg
tre ganger i uken
amikacin 15 mg/kg intravenøst
≤ 3 måneder
|
12 måneder etter negative ekspektoratprøver
|
|
M. kansasii
|
Daglig
Rifampicin 450‒600 mg x 1 peroralt
+ etambutol 15 mg/kg x 1 peroralt
+ isoniazid 300 mg x 1 peroralt (alternativt azitromycin 250‒500 mg x 1 peroralt eller klaritromycin 500 mg x 2 peroralt eller moksifloksacin 400 mg x 1 peroralt)
|
12 måneder etter negative ekspektoratprøver
Ved rifampicinresistens anbefales regime med tre medikamenter basert på resistensmønster.
|
|
M. malmoense
|
Daglig
Rifampicin 450‒600 mg x 1 peroralt
+ etambutol 15 mg/kg x 1 peroralt
+ klaritromycin 500 mg x 2 peroralt (alternativt azitromycin 250‒500 mg x 1 peroralt eller moksifloksacin 400 mg x 1 eller isoniazid 300 mg x 1 peroralt)
Ved alvorlig sykdom kan amikacin 15 mg/kg intravenøst tre ganger i uken vurderes
|
12 måneder etter negative ekspektoratprøver
|
|
M. abscessus- komplekset
|
Intensivfase:
Makrolid peroralt
+ 1‒6 måneder med minst 2 parenterale preparater (eks. amikacin, cefoksitin, imipenem og tigesyklin)
Vedlikeholdsfase:
Makrolid peroralt
+ 1‒2 andre medikamenter peroralt (eks. fluorokinoloner, linezolid, klofazimin) og/eller amikacin til inhalasjon
|
12 måneder etter negative ekspektoratprøver
Resistensmønster må vurderes ved valg av medikament (13).
Behandlingen må tilpasses individuelt.
Kirurgi må vurderes.
|
Langsomtvoksende ikke-tuberkuløse mykobakterier
Makrolider er hjørnesteinen i behandling av de fleste infeksjoner med langsomtvoksende ikke-tuberkuløse mykobakterier (tabell 1). Det finnes kun retningslinjer for resistenstesting for enkelte av disse artene. Det anbefales primært å teste Mycobacterium avium-komplekset kun for resistens mot makrolider og amikacin. Hvis makrolid ikke kan benyttes, er det i tillegg aktuelt å teste for moksifloksacin- og linezolidresistens. For M. kansasii, M. malmoense og M. xenopi anbefales resistenstesting for rifampicin og utvidet testing ved påvist rifampicin-resistens.
Mycobacterium avium-komplekset (MAC)
M. avium-komplekset inkluderer artene M. avium, M. intracellulare og M. chimaera. Anbefalt behandlingsregime er makrolid, rifampicin og etambutol i 12 måneder etter siste negative dyrkningsprøve, typisk 18‒24 måneder. For pasienter uten kavitære lesjoner har intermitterende regime med dosering tre ganger i uken vist like gode resultater som daglig behandling (39, 40). Nyere studier har også vist mindre bivirkninger ved intermitterende behandling (41, 42). Ved kavitær sykdom gir intermitterende behandling dårligere resultater, og anbefales derfor ikke. Ved uttalt sykdom er det anbefalt å legge til et aminoglykosid de første to til tre månedene av behandlingen. Dersom det er behov for langvarig behandling med aminoglykosider, kan inhalasjon av amikacin være et alternativ (43). Ved behandlingssvikt kan tillegg av moksifloksacin muligens øke suksessraten (44, 45). Klofazimin kan brukes som et effektivt alternativ til rifampicin eller ved refraktær MAC-sykdom (46, 47).
Behandlingsresultatene for lungesykdom med M. avium-komplekset er fortsatt relativt dårlige. Opphør av behandling pga. bivirkninger er vanlig (10‒30 %), og total behandlingssuksess er kun 40‒60 % (29, 48). Resultatene er en del bedre hos pasienter uten kavitær sykdom, ca. 70‒85 %, men etter vellykket behandling er tilbakefall av sykdommen vanlig (30–50 %). Dette skyldes oftest reinfeksjon med ny stamme i komplekset (42, 49). Makrolidresistens gir betydelig redusert behandlingssuksess og kompliserer behandlingen (31).
Mycobacterium kansasii
Generelt er dette den enkleste arten å behandle av alle ikke-tuberkuløse mykobakterier. Studier har vist opptil 95 % behandlingssuksess (50). I motsetning til andre ikke-tuberkuløse mykobakterier er det relativt god korrelasjon mellom in vitro-resistensbestemmelse og klinisk effekt, både for rifampicin, makrolider og fluorokinoloner (51). Standard regime har vært daglig behandling med rifampicin, etambutol og isoniazid (11). Imidlertid er det usikkerhet angående effekten av isoniazid i behandlingen, og det er rapportert god effekt av makrolider og fluorokinoloner. Mange anbefaler derfor å bytte ut isoniazid med et makrolid eller et fluorokinolon (52) (tabell 1).
Mycobacterium malmoense
Det er ikke konsensus om hva som er det optimale behandlingsregimet for denne mykobakterien, og studier med forskjellige regimer har vist varierende resultater (34, 53). I en retrospektiv undersøkelse fra Nederland så man relativt høy behandlingssuksess (70 %) (54). Tidligere ble regime med isoniazid, rifampicin og etambutol anbefalt. Imidlertid er dette endret i nyere veiledere, der isoniazid er byttet ut med makrolid (13). Ved alvorlig sykdom kan tilleggsbehandling med aminoglykosid vurderes (13). Et fluorokinolon kan eventuelt også legges til.
Hurtigvoksende ikke-tuberkuløse mykobakterier
Til tross for usikkert samsvar mellom klinisk effekt og resistensbestemmelse anbefales det at valg av antibiotika styres av denne. I gjeldende retningslinjer for hurtigvoksende mykobakterier anbefales resistensbestemmelse for amikacin, cefoksitin, ciprofloksacin, moksifloksacin, klaritromycin, doksycyklin, imipenem, linezolid, trimetoprim-sulfa og tobramycin (11), selv om ikke alle medikamentene er relevante for alle artene. M. chelona er den eneste arten hvor tobramycin foretrekkes fremfor amikacin som aminoglykosid. M. fortuitum anses generelt å være den enkleste å behandle og er som oftest følsom for en rekke medikamenter (55), mens infeksjon med M. abscessus-komplekset, som er den klart hyppigste årsaken til lungeinfeksjoner, er spesielt vanskelig å behandle.
Kun i to større studier har man forsøkt å evaluere effekten av ulike behandlingsregimer for M. abscessus. I 2009 ble det publisert en retrospektiv studie fra Korea der man evaluerte 65 pasienter som fikk standardisert behandling mot M. abscessus (56). Alle fikk klaritromycin, ciprofloksacin og doksycyklin peroralt. Initialt fikk de også fire uker med amikacin intravenøst, i tillegg til enten cefoksitin eller imipenem intravenøst. Negative dyrkningsprøver fra sputum i mer enn ett år ble oppnådd hos 58 % av pasientene. 83 % hadde symptombedring og 74 % radiologisk bedring. 22 % av pasientene gjennomgikk kirurgisk behandling. Kun 63 % fullførte behandlingen som planlagt. Det bemerkes spesielt at makrolidresistens var sterkt assosiert med dårlig behandlingsresultat. Kun 17 % oppnådde kurasjon i denne gruppen.
I 2011 ble det publisert en retrospektiv studie fra National Jewish Health i Colorado (57). 69 pasienter ble fulgt i gjennomsnitt 34 måneder. Antibiotikaregimet ble i denne studien individualisert ut fra in vitro-resistensbestemmelse og toleranse hos pasientene. Gjennomsnittlig behandlingstid var 52 måneder, hvorav seks måneder med intravenøs behandling. Sputumprøver hos 48 % av pasientene forble dyrkningsnegative. Det bemerkes her at det var betydelig bedre resultater med henblikk på dyrkningsnegativitet i 12 måneder hos dem som gjennomgikk kirurgisk behandling, som i denne studien utgjorde 33 %.
Ut fra litteraturen er det ikke mulig å gi en eksakt anbefaling om hvilke medikamenter som skal velges ved behandling av M. abscessus-komplekset. I tillegg til resistensmønster må bivirkningsprofil tas i betraktning. Det anbefales en intensivfase på 1–6 måneder med minst to parenterale medikamenter og et makrolid, deretter en vedlikeholdsfase med perorale medikamenter i 12 måneder etter negative sputumprøver (tabell 1). De mest effektive parenterale medikamentene inkluderer amikacin, cefoksitin, imipenem og tigesyklin. Etter at intensivfasen av behandlingen er gjennomført, anbefales behandling med makrolid og i tillegg ett eller to andre perorale antibiotika, som fluorokinoloner, linezolid eller klofazimin. Amikacin til inhalasjon er også et alternativ. Alle pasienter som har infeksjon med M. abscessus-komplekset, bør vurderes for kirurgi hvis det foreligger fokal sykdom, da suksessraten er høyere med kombinert medikamentell og kirurgisk behandling hos disse pasientene (57–61).
Oppsummering
Diagnostikk og behandling av lungeinfeksjoner med ikke-tuberkuløse mykobakterier bygger på kliniske og radiologiske funn samt mikrobiologiske prøvesvar. Identifikasjon av art og eventuell underart er av stor betydning, og resistensbestemmelse er ofte også viktig for valg av medikamentregime. Behandlingen består av en kombinasjon av flere medikamenter over lang tid, har til dels begrenset effekt og kan medføre betydelige bivirkninger og interaksjoner. Det er derfor viktig å ta stilling til om nytten av behandling forventes å oppveie ulempene denne kan medføre. Dersom man beslutter å behandle, bør pasientene følges opp regelmessig med ekspektoratprøver og monitorering av bivirkninger. Vi anbefaler at slike pasienter håndteres på sykehus med spesialist i infeksjonsmedisin eller lungemedisin (gjerne i samarbeid mellom disse), mikrobiolog, radiolog og thoraxkirurg. Ved Oslo universitetssykehus, Ullevål har vi opprettet en slik tverrfaglig gruppe der vi diskuterer alle pasienter som er aktuelle for behandling.
