Opptil halvparten av pasientene med Crohns sykdom utvikler fistel i løpet av sykdomsforløpet. Tilstanden krever ofte et tverrfaglig medisinsk og kirurgisk samarbeid. Medikamentell behandling er vesentlig for å redusere symptomene og behovet for kirurgiske inngrep. I denne artikkelen ønsker vi å gjennomgå dokumentasjon for effekten av medikamentell behandling ved fistulerende Crohns sykdom.
Crohns sykdom er en inflammatorisk tarmsykdom som kan ramme hele mage-tarm-kanalen fra munnhulen til endetarmsåpningen, men er hyppigst lokalisert til overgangen mellom tynn- og tykktarm. I motsetning til ulcerøs kolitt er inflammasjonen ved Crohns sykdom typisk transmural, segmental og kan medføre komplikasjoner som følge av fibrose, strikturering og fistulering (1). Fisteldanning kan gi betydelige plager i form av smerter, sekresjon og inkontinens. Behandlingstilbudet til pasienter med fistulerende Crohns sykdom er i hovedsak medikamentell behandling sammen med kirurgisk intervensjon. Ofte kreves et tverrfaglig samarbeid mellom gastroenterolog, gastrokirurg og radiolog (i enkelte tilfeller også gynekolog og urolog) for optimal håndtering, gjerne i et fistelteam.
I denne artikkelen presenteres hovedtrekkene i medikamentell behandling av fistulerende Crohns sykdom med spesiell vekt på perianal fistelsykdom. Innholdet er basert på et omfattende litteratursøk, artikler fra forfatternes egne arkiver samt mangeårig klinisk erfaring i fagfeltet.
Definisjon og kliniske aspekter
En fistel kan defineres som en kronisk kanal med granulasjonsvev mellom to epitelkledde overflater (2). Fistulering ved Crohns sykdom rammer 15–50 % av pasientene i løpet av sykdomsforløpet, hvorav halvparten er perianale fistler, en firedel er enteroenteriske fistler, de øvrige er vaginale fistler eller fistler av annen type. Ved inntil 40 % av tilfellene foreligger fistelsykdom allerede ved diagnosetidspunktet (3).
Antatt patogenese for perianal fisteldanning er at dype ulcera i tarmslimhinnen med tilstedeværelse av feces gir utgangspunkt for gjennomgående kanaler (fistler) fra tarmslimhinnen til andre organer/hud, og at betennelsesprosessen ved Crohns sykdom bidrar til sår- og kanaldanning (figur 1) (1).
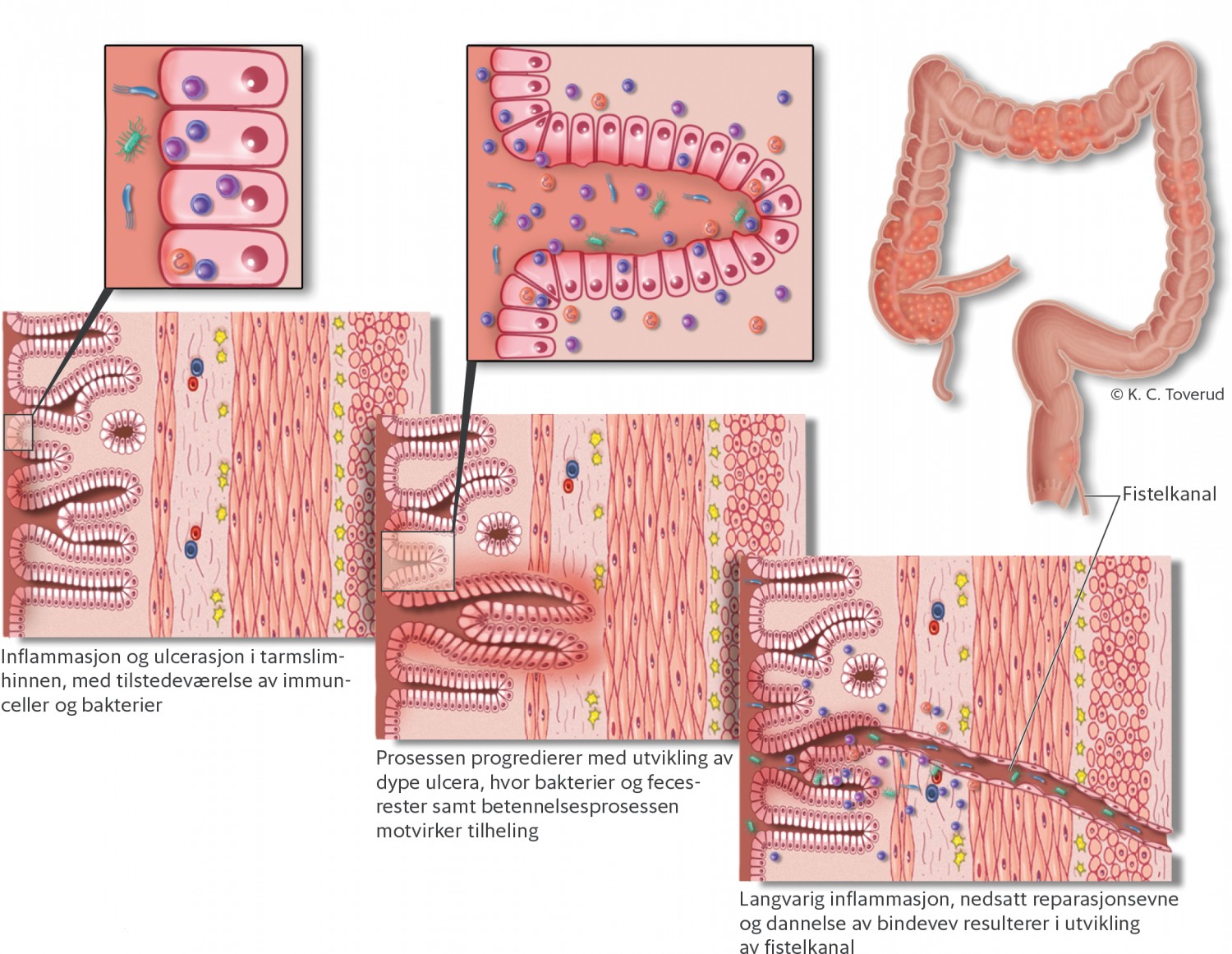
Figur 1 Antatt patogenese ved fistulerende Crohns sykdom.
Fistelsykdom kan debutere med abscess, som medfører smerter, lokal hevelse og feber, eller med sekresjon og/eller fekal inkontinens. Ved mistanke om abscess må pasienten på grunn av fare for vevsskade og septikemi tilses og vurderes for kirurgi umiddelbart. Ved antatt eller påvist fistelsykdom bør pasienten alltid henvises til gastrokirurg. Dette skjer ofte etter en initial vurdering hos gastroenterolog. Fisteltype og anatomisk utbredelse må kartlegges nøye. Dette gjøres ved klinisk undersøkelse, endoskopi og bildediagnostikk i form av endoanal ultralyd og magnetisk resonanstomografi (MR) av bekken (2).
Fistelsykdom krever ofte kombinert medisinsk og kirurgisk behandling. Etter drenasje av fistelrelatert abscess er målene å dempe inflammasjon og infeksjon, minke sekresjon og lukke fistelen. Ved perianale fistler kan kirurgisk fistulektomi eller fistulotomi utføres i noen tilfeller. Etter abscesskirurgi anvendes ofte ikke-skjærende setontråd for å sikre videre drenasje. Flere reparative teknikker kan forsøkes, som f.eks. å dekke den indre fistelåpningen og samtidig bevare sfinktermuskulaturen (advancement flap).
På lengre sikt er målet å unngå større kirurgiske inngrep, som proktektomi og anleggelse av stomi. Bortsett fra ved abscess benyttes kirurgi sjelden som førstevalg i behandlingen. Det er oftest ønskelig å starte med medikamentell fistelrettet behandling, både for å dempe den inflammatoriske aktiviteten, som ofte forårsaker fisteldanningen, og fistelsekresjonen/symptomene, som er svært plagsomme for pasienten.
I studier som har omhandlet medikamentell behandling av fistelsykdom ved Crohns sykdom, har terapirespons oftest vært oppgitt som fistelrespons: redusert sekresjon fra fistelen med minst 50 % eller komplett respons/tilheling: opphevet sekresjon fra fistelen.
Medikamentell behandling
Biologisk behandling
Biologisk behandling med tumornekrosefaktor (TNF)-α-hemmerne infliksimab eller adalimumab fremstår som den beste medikamentelle behandlingen ved fistulerende Crohns sykdom.
Infliksimab-studien publisert i 1999 er den eneste randomiserte, kontrollerte intervensjonsstudien med biologisk legemiddel med fisteleffekt som primært endepunkt. I denne studien ble 94 pasienter randomisert til enten infliksimab-induksjonsbehandling, med infusjon ved 0, 2 og 6 uker, eller placebo, deretter infusjon i uke 14 og evaluering i uke 18. Fistelrespons ved to påfølgende visitter var 62 % i behandlingsgruppen og 26 % i kontrollgruppen (4). Senere ble også effekten av 54 ukers vedlikeholdsbehandling undersøkt. I en studie fikk 306 pasienter vanlig induksjonsbehandling til uke 14, før randomisering til videre behandling med 5 mg/kg hver 8. uke eller placebo. Pasienter behandlet med infliksimab hadde høyere forekomst av komplett fistelrespons med 36 %, mot 19 % (5).
Adalimumab hadde også effekt i en studie med 117 pasienter som ble behandlet i 56 uker. Effekten, målt som reduksjon av antall drenerende fistler, var signifikant høyere i behandlingsgruppen etter 26 uker (33 % mot 13 %), og resultatene holdt seg til uke 56 (6). Certolizumab pegol er ikke godkjent for bruk mot Crohns sykdom i Norge, men i en substudie som omhandlet 54 respondere på induksjonsbehandling etter 6 uker, ble det vist signifikant effekt på fistellukking etter 26 ukers behandling sammenlignet med placebo (7).
Vedolizumab, et tarmspesifikt anti-integrin, har vist betennelsesdempende effekt ved Crohns sykdom, og i en subanalyse av 35 pasienter med fistelsykdom fant man signifikant forskjell i komplett fistelrespons etter 52 ukers behandling, 41 % mot 11 % for placebogruppen (8).
Ustekinumab blokkerer interleukin 12 og 23. Effekten ved fistulerende sykdom er ikke godt undersøkt, men en spansk kohortstudie med 18 fistelpasienter, der 11 pasienter hadde fistelrespons etter ti måneders behandling, indikerer at også dette legemidlet kan ha effekt (9).
Pilotforsøk med lokal injeksjon av infliksimab eller adalimumab i og/eller rundt fistelområdet har vist en responsrate ved fistulerende sykdom fra 40 % til 100 % (10).
Optimalisert biologisk behandling
Høyere serumkonsentrasjon av infliksimab har vist bedre resultater hos pasienter med Crohns sykdom. I en nylig publisert tverrsnittsstudie med 117 pasienter med fistulerende Crohns sykdom fant man at bunnkonsentrasjonen av legemidlet etter 24 ukers behandling var signifikant høyere hos pasienter med opphørt fistelsekresjon, 15,8 mg/l mot 4,4 mg/l. Etter å ha inndelt bunnkonsentrasjonene i kvartiler påviste man også at høyere nivåer var assosiert med bedre fistelrespons, fistellukking og mukosal tilheling (11). Dette indikerer at nivået av medikamentet i serum bør ligge høyere ved fistelsykdom enn ved luminal sykdom (11).
Immunmodulerende/immunsuppressiv behandling
Det synes å være en viss effekt av behandling med tiopurin. Andre immunsuppressive medikamenter, som ciklosporin og takrolimus, har foreløpig ikke tilstrekkelig vitenskapelig grunnlag til å ha en etablert rolle i fistelbehandlingen.
Azatioprin og 6-merkaptopurin (tiopuriner) har vært undersøkt i en randomisert kontrollert studie, hvor fistellukking forekom hos 31 % av pasientene, mot 6 % av placebobehandlede pasienter (12). I en metaanalyse av i alt 70 pasienter med Crohns sykdom med fisteldanning hadde 54 % fistelrespons, mot 21 % i placebogruppen etter minst seks måneders behandling (13).
I en retrospektiv studie med 16 pasienter ga metotreksat 25 mg/uke fistelrespons hos 56 % av pasientene etter tre måneder (14). En annen studie med gjennomsnittsdose 18 mg/uke over minst seks måneder viste fistelrespons hos 44 % av pasientene (15). Ciklosporin har vist effekt mot fistulerende sykdom i små pasientserier, med en responsrate inntil 88 % (16). Bruken av ciklosporin er imidlertid omdiskutert på grunn av potensielt alvorlige bivirkninger samt høy residivrate etter avsluttet behandling (17).
Takrolimus er undersøkt i en randomisert kontrollert studie med 48 pasienter over ti uker, hvor 43 % av pasientene mot 8 % av de placebobehandlede pasientene oppnådde fistelrespons. Også her ble det rapportert en del bivirkninger av behandlingen (18).
Medikamentell kombinasjonsbehandling
I en studie som inkluderte 49 pasienter med Crohns sykdom og fistler ble det gitt antibiotika i form av ciprofloksacin og/eller metronidazol i åtte uker. 29 av deltagerne fikk i tillegg behandling med azatioprin, enten fra studiestart eller fra uke 8. Etter 20 uker hadde 48 % av de kombinasjonsbehandlede pasientene fistelrespons, mot kun 15 % av pasientene som mottok antibiotika alene (19). For tiopuriner synes dermed kombinasjonsbehandling å være mest hensiktsmessig, særlig grunnet langsomt innsettende effekt (19).
Infliksimab og ciprofloksacin er utprøvd i en randomisert kontrollert studie med 24 pasienter med Crohns sykdom, der alle fikk infliksimab, og ciprofloksacin ble gitt de første 12 ukene. Etter 18 uker hadde kombinasjonsgruppen signifikant reduksjon av perianale symptomer og en tendens (ikke-signifikant) til reduksjon av antall drenerende fistler (20).
Adalimumab og ciprofloksacin ble kombinert i en studie med 76 pasienter, hvor den ene gruppen i tillegg til adalimumab fikk ciprofloksacin de 12 første ukene. Oppfølgingstiden var 24 uker. Etter 12 uker var det en signifikant reduksjon av fistelsekresjon og flere med helt opphørt fistelsekresjon i antibiotikagruppen. Imidlertid var disse forskjellene ikke lenger til stede ved studieavslutning (21). Kombinasjonsbehandling med TNF-hemmer og antibiotika har altså gunstig effekt, men den synes å være forbigående.
Hos 41 pasienter med Crohns sykdom og fistler som fikk behandling med infliksimab eller adalimumab kombinert med azatioprin/6-merkaptopurin, oppnådde 58 % remisjon eller respons av fistelsykdommen etter tre års behandling. Tidlig respons (etter seks uker) predikerte fremtidig remisjon fra fistelsykdom, mens bare 43 % av pasientene beholdt remisjon etter seponering av TNF-hemmer (22). Kombinert TNF-hemmer og immunmodulator har vist bedre effekt enn monobehandling med hvert av legemidlene ved luminal Crohns sykdom. Dette synes mest relatert til danning av medikamentantistoffer. Det er nærliggende å anta gunstig effekt også hos pasienter med fistulerende sykdom.
Antibiotika
Ciprofloksacin i doser på 1 000 mg per døgn og/eller metronidazol 1 000–1 500 mg per døgn over 8–12 uker har vært benyttet i en rekke pasientserier fra 1980- og 90-årene. Her angis fistelresponsen i små ukontrollerte materialer med 8–21 pasienter å være 60–100 % (23–25). I en randomisert kontrollert studie med 25 pasienter var det imidlertid ikke signifikant forskjell i fistelsekresjon eller lukking av fistler mellom ciprofloksacin, metronidazol eller placebo (26).
I en metaanalyse fra 2015, der man inkluderte tre studier med i alt 112 pasienter med fistulerende Crohns sykdom, fant man en signifikant effekt (RR 1,66; 95 % KI 1,16–2,39, p = 0,006) i favør av ciprofloksacin mot placebo eller metronidazol for å oppnå remisjon av fistelsykdom (27).
Selv om dokumentasjonen ikke er solid, er antibiotika i internasjonale retningslinjer angitt som førstelinjebehandling. Monoterapi er sjelden aktuelt, da det dreier seg om komplisert Crohns sykdom, og biologisk behandling blir ofte vurdert tidlig. Antibiotika synes å ha symptomatisk effekt, men grunnet betydelig residivfare og økende antibiotikaresistens er det mest hensiktsmessig å kombinere med andre antiinflammatoriske medikamenter. Behandlingen vil i klinisk praksis sjelden overskride 4–6 uker. Det foreligger ikke klare anbefalinger for behandlingslengde.
Et utvalg studier som vi anser sentrale for ulike typer av medikamentell behandling ved fistulerende Crohns sykdom, er angitt i tabell 1.
Tabell 1
Utvalgte studier for ulike typer medikamentell behandling av fistulerende Crohns sykdom, sortert etter årstall. OR = oddsratio.
|
Førsteforfatter, år (referanse)
|
Intervensjon
|
Design
|
Varighet (uker)
|
Antall deltagere (n)
|
Hovedfunn (* = signifikant forskjell)
|
|
Pearson, 1995 (13)
|
Azatioprin/6-merkaptopurin vs. placebo
|
Metaanalyse
|
8–52
|
70
|
Fistelrespons: 54 % vs. 21 %,
OR 4,4 (1,5–13,2)*
|
|
Present, 1999 (16)
|
Infliksimab vs. placebo
Induksjonsstudie
|
Randomisert kontrollert studie
|
18
|
94
|
Fistelrespons: 62 % vs. 26 %*
Komplett respons: 46 % vs. 13 %*
|
|
Dejaco, 2003 (19)
|
Ciprofloksacin/metronidazol med/uten azatioprin
|
Randomisert kontrollert studie
|
20
(antibiotika uke 0–8)
|
49
|
Fistelrespons: 48 % med azatioprin vs. 15 % uten azatioprin*
|
|
Sands, 2004 (5)
|
Infliksimab vs. placebo
Vedlikeholdsstudie
|
Randomisert kontrollert studie
|
54
|
306
|
Fistelrespons: 46 % vs. 23 %*
Komplett respons 36 % vs. 19 %*
|
|
Thia, 2009 (26)
|
Ciprofloksacin vs. metronidazol vs.placebo
|
Randomisert kontrollert studie
|
10
|
25
|
Ingen signifikant forskjell mellom gruppene
|
|
Colombel, 2009 (6)
|
Adalimumab vs. placebo
|
Randomisert kontrollert studie
|
56
|
117
|
Antall sekrerende fistler:
0,88 vs. 1,32 (pasienter vs. placebo)*
Komplett respons: 30 % vs. 13 %*
|
|
Dewint, 2014 (21)
|
Adalimumab + ciprofloksacin vs. adalimumab
|
Randomisert kontrollert studie
|
24
|
76
|
Fistelrespons: 71 % vs. 47 % (12 u)*
Fistellukking: 65 % vs. 33 % (12 u)*
Uke 24: ingen signifikant forskjell
|
|
Yarur, 2017 (11)
|
Infliksimab (ulike serumkonsentrasjoner)
|
Retrospektiv observasjonsstudie
|
24
|
117
|
Komplett respons vs. ikke-respons: s-infliksimab 15,4 mg/l vs. 4,4 mg/l*
Infliksimab-antistoffer ga lavere OR for komplett respons*
|
Oppsummering
Fisteldanning ved Crohns sykdom er en vanskelig tilstand å behandle, og behandlingen må ofte individualiseres grunnet den store variasjonen i presentasjonsform. Biologisk behandling har best dokumentert effekt mot fistelsykdom, og bør sannsynligvis doseres høyere enn ved luminal sykdom. Immunmodulatorer (tiopuriner) har en viss effekt. Antibiotika kan være gunstig i en begrenset behandlingsperiode, men bør kombineres med biologiske eller immunmodulerende medikamenter for bedre behandlingsrespons. Medikamentell behandling alene er sjelden aktuelt, men kan ofte startes i forkant av kirurgi og fortsettes etter gjennomført inngrep. I de fleste tilfeller gir en kombinasjon av kirurgisk og medikamentell terapi det beste resultatet, men den ideelle strategien eller sammensetningen av slik behandling er ikke avklart.
