En tenåringsgutt ble innlagt på sykehus med nedsatt bevissthetsnivå, dårlig ånde og vekttap over noen dager. Blodprøver viste en rekke alvorlige avvik og identifiserte en sjelden komplikasjon.
En tidligere frisk tenåringsgutt utviklet slapphet, tørste, tørre slimhinner og en ekkel smak i munnen som gjorde det vanskelig å spise. Han oppsøkte lege, men ble sendt hjem med mistanke om halsinfeksjon. To dager senere tilkalte foreldrene ambulanse da han kastet opp og fremsto sløv. Ambulansepersonellet fant respirasjonsfrekvens på 40 per minutt (ref. 14–19) og takykardi på 145 slag/min (ref. 55–95). Gutten ble transportert til sykehus med pågående saltvannsinfusjon.
På sykehuset ble pasienten tatt imot av akutt barneteam, som gjorde følgende funn: Frie luftveier, acetonlukt, respirasjonsfrekvens 40 per minutt, normal surstoffsmetning, ingen fremmedlyder over lungene, puls 150 slag/min, blodtrykk 125/70 mm Hg, normale hjertetoner, tørrhet i huden og på leppene. Han skåret 13 på Glasgow Coma Scale, hadde sidelike lysreaktive pupiller, var desorientert, urolig og somnolent. Det var ingen utslett.
Blodprøver ved innkomst avdekket alvorlig hypernatremi, hyperglykemi og svært forhøyet serum-osmolalitet (tabell 1). Blodgassanalyse viste en delvis kompensert metabolsk acidose. Pasienten hadde også nyresvikt og leukocytose, men negativ CRP og ingen kliniske tegn til infeksjon.
Tabell 1
Blodprøver, blodgass og urinstiks tatt ved innkomst.
|
Analyse
|
Verdi (referanse)
|
|
Natrium (ukorrigert)
|
167 mmol/l (137–145)
|
|
Natrium (korrigert)
|
197 mmol/l (137–145)
|
|
Kalium
|
4,3 mmol/l (3,5–5,1)
|
|
Klor
|
106 mmol/l (95–105)
|
|
Kalsium
|
1,48 mmol/l (1,15–1,35)
|
|
Glukose
|
76 mmol/l (4–6)
|
|
HbA1c (langtidsblodsukker)
|
8,8 % (< 6,5)
|
|
Osmolalitet
|
469 mosm/kg (275–310)
|
|
Kreatinin
|
166 μmol/l (60–105)
|
|
Urinstoff
|
18,6 mmol/l (1,8–7,1)
|
|
Leukocytter
|
26 · 109/l (3,3–11,4)
|
|
CRP
|
< 1
|
|
Arteriell blodgass
|
pH 7,18 (7,36–7,44), pCO2 4,5 kPa (4,5–6,1), pO2 12,0 kPa (11–13), bikarbonat 13 mmol/l (22–26), baseoverskudd -14.7 mmol/l (-3– +3), aniongap 46 mmol/l (10–16), laktat 3,0 mmol/l (0,4–1,3)
|
|
Urinstiks
|
glukose +4, ketoner +
|
Hos pasienter med hyperosmolalitet grunnet hyperglykemi vil transport av vann fra cellene redusere plasma-natriumkonsentrasjon. Derfor er det viktig å regne ut korrigert natrium (Formel: Korrigert s-natrium = målt s-natrium (mmol/l) + [(s-glukose [mmol/l] – 5,6) / 5,6] x 2,4). Når hyperglykemien korrigeres, vil s-natrium stige grunnet osmose (1). Vår pasient hadde s-natrium på 167 mmol/l, som tilsvarer en korrigert s-natrium på 197 mmol/l.
Tilstanden ble tolket som en diabetisk ketoacidose, og pasienten ble overflyttet til intensivavdelingen, der han ble behandlet med 15 ml/kg/t 0,9 % saltvann i to timer. Det ble klinisk vurdert at pasienten hadde tapt 10 % av kroppsvekten i væske (tilsvarer alvorlig dehydrering). S-glukose og s-osmolalitet falt parallelt med at ukorrigert s-natrium steg (figur 1a–c). Etter to timer gikk man over til vedlikeholdsbehandling (natriumklorid før overgang til glukose 5 % tilsatt kaliumklorid, natriumklorid og monokaliumfosfat), der resterende væskeunderskudd samt basalbehovet ble fordelt over 46 timer. Det ble også startet med insulin 0,1 E/kg/t etter prosedyre. Tross dehydreringen hadde pasienten en timediurese på omkring 260 ml/time, som tilsvarte ca. 4,5 ml/kg/t (normal diurese for ungdom er 0,5–1 ml/kg/t). Infusjonshastigheten ble økt i tråd med dette for å få en positiv væskebalanse på 100 ml/t, og glukose og elektrolyttinnholdet ble justert ut fra blodprøver.
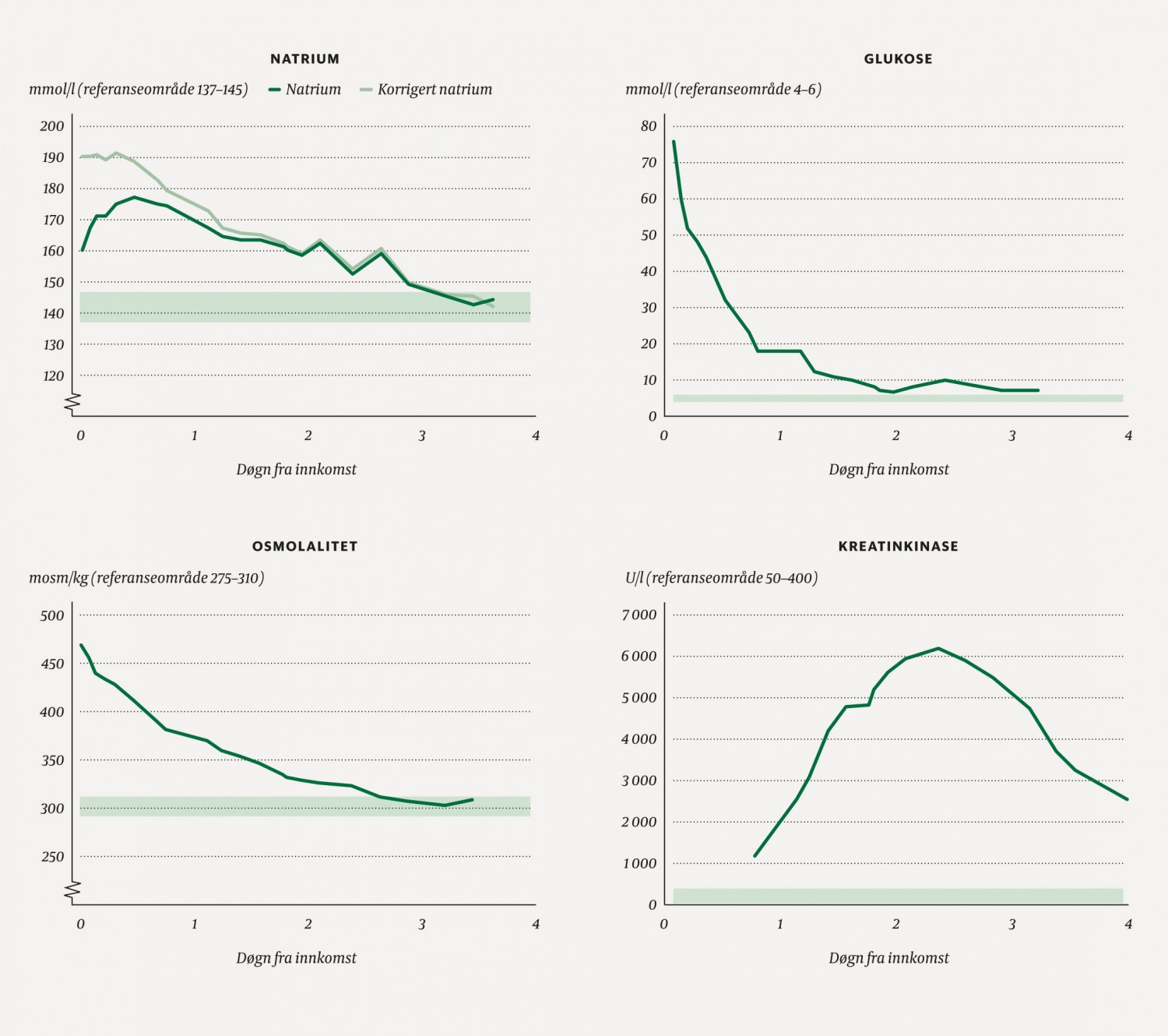
Figur 1 Utvikling av natrium, glukose, osmolalitet og kreatinkinase i serum de 3–4 første døgn pasienten var innlagt på sykehus. Grønt felt markerer referanseområdet.
Til tross for flere fellestrekk med diabetisk ketoacidose var det funn som ikke passet helt med tilstanden, herunder den alvorlige graden av hyperglykemi, hypernatremi og hyperosmolalitet. I tillegg var blodgassen bedre enn forventet ut fra det kliniske bildet (tabell 1). Disse funnene pekte i retning hyperglykemisk hyperosmolært syndrom, som er en sjeldnere tilstand enn diabetisk ketoacidose (2) (tabell 2).
Tabell 2
Forskjeller mellom diabetisk ketoacidose og hyperglykemisk hyperosmolært syndrom (2, 9).
|
|
Diabetisk ketoacidose
|
Hyperglykemisk hyperosmolært syndrom
|
|
Forekomst
|
Relativt hyppig
|
Sjelden
|
|
S-glukose
|
> 11 mmol/l1
|
> 33 mmol/l
|
|
Syre-base-status
|
Venøs pH < 7,3 eller bikarbonat < 15 mmol/l
|
Venøs pH > 7,25 eller arteriell pH > 7,3 og bikarbonat > 15 mmol/l
|
|
Ketonbelastning
|
Signifikant ketose (betahydroksybutyrat
≥ 3 mmol/l) og/eller ketonuri (typisk +2)
|
Fraværende til mild ketonemi og mild ketonuri
|
|
Bevissthets-påvirkning
|
Mild til alvorlig
|
Alvorlig eller krampeanfall
|
|
Elektrolyttmangel (kalium, fosfat, magnesium)
|
Varierer
|
Generelt større tap
|
|
Dehydrering
|
5–10 % av kroppsvekt
|
12–15 % av kroppsvekt
|
|
Rehydrering
|
Over 48 t
|
Raskere, over 24–48t
|
|
Urintap
|
Erstattes ikke
|
Bør erstattes
|
|
Osmolalitet
|
300–350 mosm/kg
|
> 320 mosm/kg
|
|
Insulin
|
0,05–0,1 E/kg/t startes 1–2 t etter oppstart av væskebehandling
|
0,025–0,05 E/kg/t startes når s-glukose ikke faller med minimum 3 mmol/l/t med kun væskebehandling
|
|
Mortalitet
|
0,15–0,3 %
|
5–20 %
|
|
Morbiditet
|
Skyldes hovedsakelig hjerneødem
|
Hypokalemi, hypofosfatemi, venøs trombose, aspirasjonspneumoni, lungeødem, rabdomyolyse, akutt nyresvikt, akutt pankreatitt
|
Blodsukker og osmolalitet responderte på behandlingen, og syre-base-statusen ble relativt raskt normalisert. Etter rundt et døgn var natriumverdien fremdeles svært høy, omkring 170 mmol/l. Det ble konferert med endokrinolog på universitetssykehus som anbefalte å redusere salttilsetninger eller få pasienten til å drikke vann. Pasienten var ikke i stand til å drikke og sonde var ikke et alternativ, da han var urolig. Mot kvelden andre døgn var han økende agitert, forvirret og kastet opp. Med tanke på hjerneødem var behandlingen vanskelig, da både hypertont saltvann (hypernatremi) og mannitol (hyperosmolalitet) var kontraindisert. CT caput ville ikke være mulig uten narkose. Symptomene bedret seg imidlertid spontant i løpet et par timer.
Natrium og glukose skal i utgangspunktet korrigeres gradvis, med henholdsvis 0,5 mmol/l og 5 mmol/l per time (2). Samtidig bør ikke effektiv osmolalitet (2 x s-natrium + s-glukose) falle raskere enn 3 mosmol/kg/t grunnet risiko for hjerneødem (1). Ettersom tonisitet avhenger av både natrium og glukose, aksepterer man en stigning av ukorrigert natrium parallelt med at glukose faller. Dette skjedde også hos vår pasient (figur 1a). Fravær av dette fallet, eller for raskt fall i korrigert natrium eller glukose, er en risikofaktor for hjerneødem (2).
Rabdomyolyse er en mulig komplikasjon til hyperglykemisk hyperosmolært syndrom, og måling av kreatinkinase ble derfor bestilt. Denne var forhøyet til 1 172 U/l (ref. 50–400).
Rabdomyolyse er kjennetegnet ved akutt destruksjon og celledød av tverrstripet muskulatur og kan medføre en rekke komplikasjoner som akutt nyresvikt, alvorlig hyperkalemi, hypokalsemi, muskulært kompartmentsyndrom, dissiminert intravaskulær koagulasjon og hjertestans (3). Hovedbehandlingen er store mengder væske for å øke diuresen.
Utviklingen av rabdomyolyse i kombinasjon med hypernatremi gjorde totalsituasjonen mer utfordrende. Pasienten skulle ha mye væske på grunn av rabdomyolysen, men samtidig var det ikke ønskelig med for rask rehydrering grunnet fare for raskt fall i s-natrium og s-osmolalitet. Ut over ettermiddagen dag 2 steg kreatinkinaseverdien ytterligere til 4 209 U/l, sammen med s-myoglobin 2 360 ug/l (ref. < 70) og u-myoglobin 1 680 ug/l (ref. < 21), som er svært høyt.
Diuresen var kraftig avtagende til omkring 10 ml/t (0,2 ml/kg/t). I samråd med universitetssykehus, nefrolog og anestesilege ble dialyse vurdert, men ikke startet. Det ble konkludert med at det uavhengig av metode var fare for fall i natrium, da man vanskelig kan tilpasse natriumkonsentrasjon i dialysevæsken.
I diskusjon med nefrolog kom man etter hvert frem til at pasienten trolig måtte være vesentlig mer dehydrert enn de 10 % man hadde beregnet klinisk. Det var vanskelig å veie pasienten initialt. Vekt på dag 2 sammenholdt med 1,5 døgn før innleggelse og vekt ved utreise tydet på et reelt vekttap på over 20 %. Av dette hadde han mistet over 10 % av kroppsvekten siste halvannet døgn før innleggelse. Det ble gitt flere væskestøt med 0,9 % NaCl og man økte væskemengden 0,9 % NaCl kraftig i håp om langsomt å korrigere s-natrium og få i gang diuresen. Dette hadde god effekt. Ettersom pasienten var så dehydrert, var det ikke forventet at diuretika skulle gi vesentlig effekt. Natriumbikarbonat ble tilføyd i deler av infusjonsvæsken. Kaliumverdien var tilnærmet normal hele forløpet.
Bikarbonatbehandling ved diabetisk ketoacidose og hyperglykemisk hyperosmolært syndrom er kontroversielt og skal som hovedregel kun gis ved særskilte tilfeller, som livstruende hyperkalemi (2). Ved alvorlig rabdomyolyse (kreatinkinase > 5 000 U/l) kan forsert alkalisk diurese forsøkes dersom følgende kriterier er møtt: fravær av hypokalsemi, arteriell pH < 7,5 og s-bikarbonat < 30 mEq/l. Infusjonen rettes mot å få pH-verdien i urin > 6,5, som kan ha flere teoretiske fordeler (4).
Det ble tatt hyppige kontroller av blodgass og urin-pH. Væskebehandling ble gitt med mål om diurese omkring 100–150 ml/t. Pasienten fikk flere væskestøt tidlig døgn 3. Han følte seg da noe bedre og ble mer våken. På kvelden døgn 3 falt natriumverdien til 158 mmol/l, og den var normalisert på døgn 4 (figur 1a). Infusjonshastigheten ble endret fortløpende etter blodprøveverdier (natrium, osmolalitet, kreatinin, kreatinkinase), og urinproduksjonen lå stabilt på 200–300 ml/t. Han fikk etter hvert betydelig vektøkning og utvikling av lettgradige ødemer med klinisk god effekt av furosemid intravenøst. Døgn 3 nådde kreatinkinaseverdien en topp på 6 204 U/l (ref. 50–400) (figur 1d), og kreatininverdien lå samtidig stabilt rundt 50-tallet.
Etter fem døgn på intensivavdeling ble pasienten overflyttet til pediatrisk sengeavdeling for diabetesopplæring. Han ble utskrevet med god allmenntilstand etter ti dager på sengepost, med avtale om videre oppfølging hos endokrinolog. Kontroller har ikke vist tegn til cerebral skade.
Diskusjon
I Norge utgjør type 1-diabetes 98 % av alle diabetestilfeller hos barn. I 2016 var insidensen 35,2 per 100 000 personår for aldersgruppen 0–14 år, som er nest høyest på verdensbasis (5). Som nylig problematisert i Tidsskriftet, har flere norske barn og unge med nyoppdaget diabetes type 1 ketoacidose sammenlignet med barn i Sverige og Danmark, hhv. 23,5 % mot 20,4 % og 20,5 % (6).
Hyperglykemisk hyperosmolært syndrom har usikker prevalens og kan forekomme hos unge med både type 1- og type 2-diabetes og nyfødte, spesielt de med 6q24-relatert forbigående neonatal diabetes mellitus (2). Tilstanden er likevel hyppigst hos voksne og særlig eldre med type 2-diabetes.
Kasuistikken illustrerer et ekstremt tilfelle med diabetes type 1 som debuterte med en blandingstilstand mellom diabetisk ketoacidose og hyperglykemisk hyperosmolært syndrom, der sistnevnte dominerte det kliniske bildet. Langtidsblodsukker 72 mmol/mol (ref. < 48 mmol/mol) og C-peptid 165 pmol/l (ref. 300–1 480) illustrerer at tilstanden utviklet seg relativt raskt. Den voldsomme hyperglykemien ved hyperglykemisk hyperosmolært syndrom er multifaktoriell og skyldes økt glukoneogenese, glykogenolyse og utilstrekkelig forbruk av glukose i perifere vev (7). I vårt tilfelle kan det ha vært medvirkende at pasienten hadde inntatt store mengder karbohydratholdig væske før innleggelsen.
Hyperglykemisk hyperosmolært syndrom er kjennetegnet ved ekstrem økning i glukose og hyperosmolalitet uten signifikant ketose. Ulikt symptomene ved diabetisk ketoacidose (hyperventilasjon, oppkast og magesmerter) som gjerne bringer pasienten til legen, får man ved hyperglykemisk hyperosmolært syndrom gradvis polyuri og polydipsi, som gir alvorlig dehydrering og elektrolyttap.
Diagnosekriteriene for hyperglykemisk hyperosmolært syndrom kan variere noe avhengig av kildegrunnlag (2) og mellom ulike land (8), men er i hovedtrekk: p-glukose > 33 mmol/l; minimal acidose (arteriell pH > 7,3); s-bikarbonat > 15 mmol/l; mild ketonuri og fraværende til mild ketonemi; s-osmolalitet > 320 mosm/kg; påvirket bevissthet eller kramper.
Sammenlignet med diabetisk ketoacidose er retningslinjene for behandling av hyperglykemisk hyperosmolært syndrom basert mer på klinisk erfaring og i mindre grad evidens. En sentral forskjell er at væsketapet er langt større ved hyperglykemisk hyperosmolært syndrom, der et væskeunderskudd på 12–15 % av kroppsvekten kan forventes. Rehydreringen bør derfor foregå raskere for å unngå vaskulær kollaps (2).
I vår kasuistikk ga sterk hyperglykemi på 76 mmol/l, korrigert natrium på 197 mmol/l og svært forhøyet s-osmolalitet på 469 mosm/kg mistanke om tilstanden. Bortsett fra en lav pH-verdi ved innkomst hadde pasienten alle kriteriene oppfylt. Trolig var det en viss grad av ketose kombinert med lett laktatstigning som hadde gitt pasienten lav pH initialt. Syre-base-avvik var ellers ikke en dominerende del av sykehistorien.
Til tross for alvorlig dehydrering fører hypertonisitet ved hyperglykemisk hyperosmolært syndrom til at det intravaskulære volumet til en viss grad opprettholdes, og tegn til dehydrering kan derfor være mindre uttalt. Tidlig i forløpet kan urinmengden være betydelig på grunn av massiv osmotisk diurese, som hos denne pasienten. Man trenger derfor en mer aggressiv væskebehandling for å unngå vaskulært kollaps. Målene med væsketerapien er å erstatte volumtap, gjenopprette perfusjonen til nyrene og gradvis redusere s-natrium og s-osmolalitet (2). Etter utregning av væskeunderskudd starter man med bolus 20 ml/kg isoton NaCl (0,9 %), eventuelt i flere omganger ved kompromittert sirkulasjon. Deretter gis 0,45–0,9 % NaCl over 24–48 timer for rehydrering (2). Det overordnede målet er en jevn og gradvis reduksjon i s-natrium og s-osmolalitet. Ved utilfredsstillende hemodynamisk status med fallende s-osmolalitet bør isoton NaCl gjenstartes, da dette bedre kan opprettholde sirkulatorisk volum (2). Man kan også med fordel benytte Ringer-laktat, da høy klortilførsel kan bidra til hyperkloremi og hyperkloremisk metabolsk acidose (2).
Tidlig insulinbehandling er som regel ikke nødvendig ved hyperglykemisk hyperosmolært syndrom, fordi væske alene gir et markert fall i glukose grunnet fortynningseffekt. Glukosuri ved økt nyrefiltrasjon og bedre sirkulasjon gir økt vevsopptak av s-glukose. Glukosens osmotiske trykk bidrar til opprettholdelse av blodvolumet, og et for hurtig fall i s-glukose og s-osmolalitet etter insulinadministrasjon kan føre til sirkulatorisk kollaps hvis væsketilførselen ikke er adekvat (2). Pasienter med hyperglykemisk hyperosmolært syndrom kan ha ekstrem kaliummangel, og et insulinindusert kaliumskift til det intracellulære rom kan medføre arytmi. Insulin bør startes med dosering 0,025–0,05 E/kg/t når glukose ikke lenger faller med minst 3 mmol/l/t med væskebehandling alene. Ved alvorlig ketose og acidose kan insulin startes tidligere. For spesifikke tiltak for elektrolyttmangel viser vi til retningslinjer fra International Society for Pediatric and Adolescent Diabetes (2).
Rabdomyolyse forekommer hyppigst hos barn med infeksjon, etter traume eller trening, men kan også forekomme ved diabetisk ketoacidose og hyperglykemisk hyperosmolært syndrom. En mulig forklaring er at store avvik i natrium og glukose gir dysfunksjon av muskulaturens Na+/Ka+-ATPase med påfølgende destruksjon av muskulaturen (3). Hos pasienter med klinisk bilde på rabdomyolyse eller mistenkt hyperglykemisk hyperosmolært syndrom bør kreatinkinase måles hver 2.–3. time for tidlig oppdagelse.
Konklusjon
Vår kasuistikk viser hvordan en relativt hyppig sykdomstilstand kan bli livstruende på kort tid. Den illustrerer betydningen av å kalkulere og monitorere effektiv osmolalitet ved akutt alvorlig hyperglykemi og hypernatremi. Store avvik i s-glukose og osmolalitet med minimal ketose bør gi mistanke om hyperglykemisk hyperosmolar tilstand, der væskebehovet er betydelig større enn ved diabetisk ketoacidose. Kreatinkinase tas tidlig i forløpet for å avdekke eventuell utvikling av rabdomyolyse, da dette kan ha implikasjoner for væskebehandlingen.