En tidligere frisk 19 år gammel mann kjørte utfor med motorsykkel i en slak sving i ca. 80 km i timen og skled et stykke med sykkelen før han ble slengt av. Han fikk slag mot venstre del av brystet, men reiste seg opp selv, tok av seg jakke og hjelm og ringte etter hjelp med mobiltelefon. Han hadde hemoptyse og respirasjonsavhengige smerter i venstre del av brystet. Blodtrykket var normalt. Han ble transportert til sykehus med redningshelikopter. Tre timer senere viste CT lungekontusjon med blødning og mindre pneumothoraxkapper bilateralt, fraktur av venstre 7. og 8. costa i medioaksillærlinjen og miltruptur med moderat blødning.
Han ble observert i intensivavdelingen, det ble lagt inn torakalt epiduralkateter for smertelindring og han trengte oksygenmaske med reservoar og 10 l oksygen for å holde oksygenmetningen over 95 %. Han var takykard med hjertefrekvens 100 – 110, middelarterietrykket var 70 mm Hg og hemoglobinnivået var stabilt på ca. 13 g/100 ml.
Dag 4 fikk han økende oksygeneringsvansker, og måtte intuberes og respiratorbehandles med trykkontrollert modus og inspirert oksygenfraksjon på 0,5. Det ble lagt thoraxdren på venstre side. Han ble sirkulatorisk ustabil. Væskeinfusjon hadde liten effekt, men intravenøs noradrenalin 0,12 µg/kg/min gav tilfredsstillende middelarterietrykk på 65 – 70 mm Hg. EKG viste utbredte ST-elevasjoner (fig 1) og troponin-T-verdien økte fra 0,33 µg/l dag 4 til 1,9 µg/l dag 5.
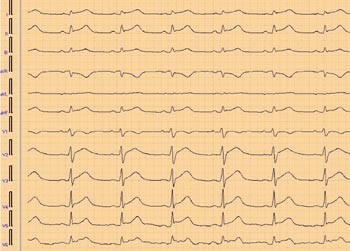
Figur 1 EKG tatt dag 3 viser ST-elevasjon i de fleste avledninger som ved perikarditt
Pasienten gjennomgikk en dramatisk forverring både respiratorisk og sirkulatorisk uten noen åpenbar forklaring. Aktuelle differensialdiagnoser kunne være akutt respirasjonssvikt som følge av lungekontusjon, ventilpneumothorax eller overtrykkspneumothorax, utvikling av sjokklunge (ARDS), hjertekontusjon med utvikling av biventrikkulær hjertesvikt og lungeemboli.
Røntgen thorax viste ikke nytilkommede forandringer på lunger eller mediastinum, men transtorakal ekkokardiografi viste moderate mengder perikardvæske uten truende tamponade, mitralinsuffisiens grad 3 av 4 (fig 2), ca. 50 mm Hg systolisk pulmonalarterietrykk og moderat trikuspidalinsuffisiens. Undersøkelsen ble gjentatt dag 5, og viste da ytterligere forverret hemodynamikk.
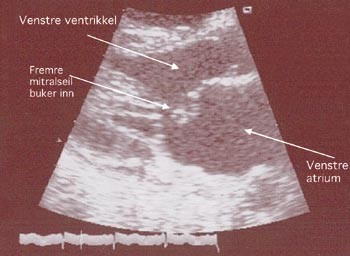
Figur 2 Transtorakal ekkokardiografi med fremstilling i parasternal langakseprojeksjon. Bildet viser at fremre mitralseil gir etter og buker inn i venstre atrium
I tillegg til massive lungeskader hadde altså vår pasient en stor mitralinsuffisiens med global hjertesvikt. Skade på hjerteklaffer etter ikke-penetrerende thoraxtraumer er sjeldent. Imidlertid kan også moderate traumer gi slik skade. Symptomene kan maskeres av hjertekontusjon og skader i lunge, brystvegg og buk. I dette tilfellet ble pasientens klaffeskade og hjertesvikt ikke diagnostisert før dag 4. Auskulasjon av hjertelyder glemmes ofte i akuttmottak og intensivavdelinger, men er viktige ved stumpe thoraxtraumer. Auskultasjon ble dessverre ikke gjort hos oss. EKG-forandringer og biokjemisk diagnostikk er lite sensitiv for klaffeskader. Imidlertid ble det på bakgrunn av slike forandringer gjort transtorakal ekkokardiografi hvor man fikk visualisert klaffeskaden. Transøsofageal ekkokardiografi anbefales som beste undersøkelsesmetode.
Etter konferanse med regionsykehuset ble pasienten overflyttet dit for operasjonsvurdering dag 5. Monitorering med pulmonalarteriekateter ble diskutert, men daglig ekkokardiografi ble valgt som eneste monitorering av hjertefunksjonen i tillegg til intraarteriell blodtrykksmåling, sentralt venetrykk og EKG. Respirator- og vasopressorbehandling fortsatte frem til dag 12. På dag 12 ble det likevel lagt inn pulmonalarteriekateter, og målingene viste nedsatt hjerteminutttvolum på 3,6 l/min og nedsatt sentralvenøs oksygenmetning på 42 %. Infusjon med noradrenalin ble gradvis trappet ned hvoretter hjerteminutttvolumet steg til 4,5 l/min og sentralvenøs oksygenmetning økte til 56 %.
Det er mulig at tidligere monitorering med pulmonalarteriekateter ville ha påvirket den farmakologiske behandlingen av denne pasienten. Avlastning av venstre ventrikkel med f.eks. nitroprussid kunne bidratt til økt hjerteminuttvolum, forbedret oksygentilbud og redusert transmuraltrykk (1). Dette kunne bidratt til å utsette tidspunktet for nødvendig kirurgisk intervensjon og til å redusere den perioperative risikoen.
Dag 12 ble han operert pga. økende perikardvæske, truende tamponade, høyt lungekartrykk, trikuspidalinsuffisiens og begynnende nyresvikt. Peroperativt var perikard struttende av blodig serøs væske uten koagler, og det var vanskelig å kjenne hjertets pulsasjon. Hjertet og de store kar var dekket med fibrin. Eksponering av mitralapparatet avdekket en forlenget og avbleket fremre papillemuskel. Chordaapparatet var nesten intakt, men fremre mitralseil og koaptasjonsflaten mot bakre seil var trukket inn i atriet. Morfologisk var dette forenlig med en avaskulær papille- og ventrikkelmuskulatur. Hele klaffeapparatet ble bevart og en mekanisk ventil (Carbomedics 27 mm) ble implantert.
Selv om vi ikke kan vite det sikkert, kunne en traumatisk skade av en septal koronararterie forklare papillemuskelskaden hos vår pasient. Kirurgisk behandling av mitralapparatet bør følge vanlige prinsipper, og plastikk er å foretrekke dersom dette er mulig. Et slikt eksempel er isolert chordaruptur. Klaffeapparatet lot seg imidlertid ikke rekonstruere med plastikk i dette tilfellet idet muskelvevet rundt papillemuskel og ventrikkelfeste ble vurdert til å være for skadet.
Han ble ekstubert dag 14 og viste etter dette rask bedring med tilnærmet normale ekkokardiografiske kontroller senere. En liten trikuspidallekkasje uten hemodynamisk betydning gjenstod.
Diskusjon
En universitetsklinikk i Athen som mottar 150 multitraumatiserte pasienter årlig, rapporterte ett tilfelle av traumatisk trikuspidal- og ett tilfelle av traumatisk mitralklafferuptur i løpet av fem år (2). Et annet senter oppgav det samme antall i en prospektiv studie av 134 pasienter over tre år (3). I et norsk 12-årsmateriale var det ingen kjent traumatisk årsak til mitralklaffeplastikk (4). Moderate traumer kan også gi skader på hjertet (5). Dersom klaffene skades, synes aortklaffene mest utsatt, fulgt av mitral- og dernest trikuspidalklaffene (6). Akutte skader på mitralklaffen skyldes mest sannsynlig en plutselig trykkstigning i hjertet etter kompresjon av en full ventrikkel i sen diastole eller tidlig systole. Aortaklaffen er mest sårbar i tidlig diastole. Eksperimentelt kreves et trykk på over 320 mm Hg for at det skal oppstå ruptur av klaffeapparat eller vegg (7). Traumatiske klaffeskader som debuterer senere kan også forklares av papillemuskelkontusjon, inflammasjon, nekrose og sekundær ruptur (2).
Transøsofageal ekkokardiografi anbefales som beste undersøkelse, men ofte brukes kliniske tegn eller transtorakal ekkokardiografi for å stille diagnosen (2). Det gjaldt også vår pasient. EKG og biokjemiske undersøkelser har vist seg å være lite sensitive. EKG (fig 2) og troponinverdiene hos vår pasient var således forenlig med hhv. perikarditt og hjertekontusjon.
I dette tilfellet var perikarditten med fibrinbelegg så uttalt at høyre lyske ble valgt til arteriekanylering under tilkoblingen til hjerte-lunge-maskinen, i stedet for aorta. Operasjonen ble utsatt lengst mulig for å unngå ytterligere inflammatorisk påvirkning av de skadede lungene. Vi fryktet også blødning fra venstre lunge og den sprukne milten under full heparinisering som er nødvendig for tilkobling til hjerte-lunge-maskin.
Optimalt operasjonstidspunkt kan være vanskelig å bestemme, og må også bygge på kliniske tegn (2).
Mitrallekkasjen ble antatt å forårsake økt trykk i lungekarene og høyre atrium med sekundær trikuspidallekkasje. Dessuten tiltok perikardvæsken og truet hjertets evne til å utvide seg for fylling. Samlet ble dette vurdert som operasjonsindikasjon. Ved senere kontroller har trikuspidallekkasjen vært svært liten og uten hemodymanisk betydning. Den preoperative betydelige trikuspidallekkasjen var derfor mest sannsynlig sekundær til høye trykk i lungekar, og ikke traumatisk betinget.
Sirkulasjonssvikt hos traumepasienter
Sirkulasjonssvikt hos traumepasienter er en vanlig akuttmedisinsk problemstilling. Etter at man har vurdert og fått kontroll over luftveier og ventilasjon (A og B), er det sirkulasjon og blødningskontroll som skal ivaretas (C) (1). Ved vurdering av sirkulasjonsstatus er spørsmålet om organperfusjonen er tilfredsstillende, og dersom så ikke er tilfellet, hva dette kan skyldes.
Sjokkutvikling kan være vanskelig å erkjenne, men kirurgisk blødning er den vanligste årsaken. I utgangspunktet må man lete etter blødningskilden der hvor potensialet for livstruende volumtap er størst; abdomen, thorax og bekken. I tillegg kan selvsagt ytre blødninger være livstruende, men intrakraniale blødninger medfører ikke sirkulasjonssvikt (1). Blødning krever ofte kirurgisk inngrep, og pasienter med omfattende blødning kan ikke «stabiliseres» med infusjon. Forsøk på å normalisere pasientens sirkulasjonsstatus med infusjon av væske må frarådes (2). Hvert minutt som brukes på diagnostikk betyr større blodtap, og øker risikoen for å havne i den livsfarlige triaden med hypotermi, acidose og koagulopati. I en slik situasjon er det bare skadebegrensende kirurgi som kan redde pasienten (3).
Trykkpneumothorax og hjertetamponade er sjeldnere, men livstruende årsaker til sirkulasjonssvikt hos traumepasienter. Direkte hjerteskade forekommer sjelden, og rundt 40 % av ventriklenes myokard må være skadet før dette alene medfører sjokkutvikling (4). Klaffeskader som årsak til sirkulasjonssvikt kan også forekomme, som det så godt er beskrevet av Kalstad og medarbeidere i dette nummer av Tidsskriftet (5). Den kliniske utfordringen er å finne ut hvilke av de nevnte tilstandene som forårsaker sirkulasjonssvikten.
En systematisk og grundig undersøkelse av alle skadepasienter er derfor viktig, men dessverre gjøres ikke dette alltid (6). Likeledes hender det at man ved håndtering av pasienter som åpenbart har sirkulasjonssvikt ikke følger de strategier som er anbefalt av andre behandlingssentre med langt større erfaring enn vi får i Norge.
I BEST-nettverket som nå omfatter 35 av landets sykehus, er det gjentatte ganger blitt fortalt historier om pasienter som er blitt sendt til omfattende røntgenundersøkelser, spesielt CT, i stedet for at man har handlet på grunnlag av kliniske tegn og eventuelle ultralydfunn. For mer enn ti år siden minnet Johan Pillgram-Larsen & Kaare Solheim om at det kan være livsfarlig for en traumepasient med blødning å bli sendt til CT-undersøkelse i stedet for å bli brakt til operasjon (7). CT-undersøkelse er et glimrende diagnostisk hjelpemiddel, men bare for pasienter som er i sirkulatorisk tilfredsstillende tilstand. Røntgen av thorax og bekken tatt på skadestue, sammen med ev. ultralydundersøkelse og selvsagt klinisk vurdering, gir nok informasjon til å kunne velge hvor man eventuelt skal starte kirurgisk intervensjon.
Når dette ikke alltid skjer, kan det skyldes at slike pasienter forekommer forholdsvis sjelden, og at man derfor ikke får mye erfaring. Dette kan bøtes på ved å ha øvd på prosedyrene slik at man er forberedt på å gjennomføre skadebegrensende kirurgi før det er for sent (3, 8).