Gjennom hele menneskehetens historie har forskjellige stoffer og urter vært brukt som legemidler for å bevare helse og lindre sykdom. Forklaringene på disse stoffenes virkningsmekanismer og effekter var før begynnelsen av 1800-tallet tildeles basert på magiske forestillinger om effekter. Utvikling innenfor bioteknologi, molekylærbiologi og genetikk har ført til bedre forståelse av virkningsmekanismer og derav optimalisering av eksisterende legemidler og utvikling av nye legemidler med mer spesifikke effekter. Denne utvikling har vært sentral innen fagområdet farmakologi.
Moderne farmakologi bygger på farmakokinetikk og farmakodynamikk. Farmakokinetikk beskriver hvordan kroppen omsetter legemidler ved absorpsjon, distribusjon, metabolisme og utskilling (1 – 4). Farmakodynamikk beskriver hvordan legemidler, rusmidler og giftstoffer virker på sine målorganer i kroppen og utløser en eller forskjellige effekt(er). I denne artikkelen omtales generelle farmakodynamiske prinsipper.
Hvordan virker legemidler?
De fleste legemidler virker ved å binde seg til mottakermolekyler, som oftest er proteiner, for så å utløse en effekt direkte eller mer indirekte via en kaskade av reaksjoner. Andre legemidler virker direkte på DNA, for eksempel cyklofosfamid, som er et antitumormiddel. Enkelte legemidler virker direkte på fysikalske/kjemiske reaksjoner, slik syrenøytraliserende legemidler gjør i magesekken.
For alle legemidler, uansett type eller administrasjonsform, gjelder det at legemidlet må være til stede i en passende konsentrasjon for at legemidlet og mottakermolekylet skal reagere med hverandre og dermed gi den ønskede virkningen. Det er viktig å presisere at det er konsentrasjonen av den frie fraksjonen til et legemiddel som er i likevekt i områder rundt cellene. Virkesteder har ulik distribusjon i kroppen. Derfor kan et legemiddel ha lokalisert effekt uten at administrasjonen må være lokal. Vi sier at legemidlet må ha affinitet, dvs. tiltrekningskraft og binding, til mottakermolekylet og beskriver reaksjonen mellom molekylene i en bindings-metnings-kurve (fig 1) (5, 6).

Bindings-metnings-kurve: Kurven viser spesifikk binding til et mottakermolekyl som funksjon av legemiddelkonsentrasjon. Legg merke til at bindingen når et tak, dvs. ytterligere økning av konsentrasjonen vil ikke øke bindingen og heller ikke øke den spesifikke effekten. kd er definert som dissosiasjonskonstanten, som er den konsentrasjonen av legemidlet som er nødvendig for 50 % binding
Effektene legemidlene utløser, kan registreres som for eksempel effekt på blodtrykk, puls eller respirasjonsfrekvens. Det er vanlig å beskrive sammenhengen mellom dose eller konsentrasjon og effekt i en dose-respons-kurve (fig 2) (7). Ut ifra slike kurver kan vi sammenlikne forskjellige legemidler innen en legemiddelgruppe med hensyn til legemiddelaktivitet og effekt i ulike vev i kroppen.
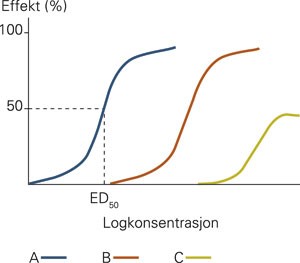
Konsentrasjon-effekt-kurver for tre forskjellige legemidler (A, B og C). Legemiddel A er mer potent enn B, men begge har samme effektivitet. Legemiddel C er mindre potent og mindre effektivt enn de to andre. ED50 for et legemiddel defineres som den konsentrasjonen av legemidlet som gir 50 % effekt. Effektivitet er et utrykk for maksimal definert effekt av et legemiddel. Potens er et utrykk for sammenlikning av legemiddelaktivitet av forskjellige legemidler innen samme gruppen, for eksempel ratio mellom ED50-verdier. Potens er avhengig av bindingsaffinitet og antall aktive bindingsseter
Det er viktig at legemidlene har mest mulig spesifikke effekter i utvalgte målorganer slik at de helst bare virker der de skal og ikke andre steder, ikke minst for å unngå bivirkninger og uønskede effekter. Imidlertid påvirker noen legemidler mottakermolekyler i mange celler i kroppen. Bruk av slike legemidler kan være farlig og føre til alvorlige, uønskede effekter dersom riktig dose ikke tilstrebes.
Det må presiseres at legemidler nesten aldri etablerer nye prosesser i kroppen/cellene, men modulerer prosesser som allerede skjer naturlig. Slike moduleringer skjer hele tiden i kroppen ved at ligander, dvs. hormoner, vekstfaktorer, nevrotransmittere, peptider osv., binder seg til mottakermolekyler og påvirker forskjellige prosesser gjennom å hemme (fullt eller delvis), stimulere (fullt eller delvis), og kan derfor ha til dels motsatte effekter på ulike systemer og prosesser.
Mottakerproteinene som legemidler virker på, tilhører stort sett en av fire grupper: enzymer, transportproteiner, ionekanaler og reseptorer (tab 1).
|
Tabell 1 Ulike mottakerproteiner som legemidler virker på i organismen, med eksempler
|
|
Enzymer
|
Transport-proteiner
|
Ionekanaler
|
Reseptorer
|
Annet¹
|
|
Legemidler
|
StatinerAcetylsalisylsyreNSAID³WarfarinAlteplaseHeparinACE-hemmere⁴
|
SSRI²SlyngediuretikaDigitalisOmeprazol
|
LokalanastetikaAmiodaronFlekainidKalsiumantagonister
|
β-blokkereβ-agonisterAntihistaminerOpioiderl-dopaInsulin
|
CyklofosfamidAntacidaBulklaksantia
|
|
[i]
|
Enzymer
Enzymer kontrollerer kjemiske reaksjoner i kroppen. Legemidler kan påvirke enzymer på forskjellige måter ved for eksempel å øke eller redusere enzymaktiviteten. Legemidlet kan være en konkurrerende hemmer av enzymet – dvs. at legemidlet binder til det samme stedet som substratet gjør. Dette kan være reversibel hemning, som kan ses ved bruk av statiner som blokkerer enzymet hydroksymetylglutaryl-koenzym A-reduktase (HMG-CoA-reduktase), som er det hastighetsbegrensende enzym i kolesterolsyntesen, og dermed hemning av bl.a. danningen av LDL-kolesterol. Det kan også være irreversibel hemning, som ved bruk av acetylsalisylsyre, som hemmer enzymet syklooksygenase, både COX-1 og COX-2.
Legemidler kan også aktivere enzymer, for eksempel, alteplase (rt-PA; recombinant human tissue type plasminogen activator). Alteplase er et glukoprotein som bindes til fibrin og aktiveres, noe som igjen resulterer i at plasminogen omdannes til plasmin og gir økt fibrinolyse. Preparatet brukes ved akutte vaskulære trombotiske tilstander som for eksempel akutt myokardinfarkt.
Transportproteiner
Proteiner kan binde andre molekyler og transportere dem over cellemembraner, bl.a. ioner som Na+ og Ca2+, aminosyrer, og nevrotransmittere, slik som 5-hydroksytryptamin (serotonin) og andre katekolaminer. Legemidler kan blokkere og derfor hemme disse transportmekanismene. For eksempel bindes selektive serotoninreopptakshemmere (SSRI) til transportmolekyler og hemmer transporten av serotonin fra synapsespalten til den presynaptiske terminalen i nervesystemet. Likeledes hemmer amfetamin reopptak av katekolaminer i nervesystemet. Andre eksempler er diuretika, som blokkerer reabsorpsjon av ioner i renal tubuli, og digitalis, som hemmer Na+/K+-ATPasen i hjerteceller.
Ionekanaler
Ionekanaler er proteinkanaler gjennom cellemembraner som tillater ioner å bevege mellom innsiden og utsiden av celler. Deres funksjon er forholdsvis enkel: de åpner eller lukker avhengig av en rekke faktorer og utgjør grunnlaget for vitale funksjoner, blant annet membranpotensialene i nerveceller og muskelceller. I ionekanaler er åpningen kontrollert av en port eller grind som kan styres av elektriske krefter (spenning over cellemembranen). Kanalene kalles i det tilfellet spenningsstyrte ionekanaler. Eksempler på legemidler som virker på spenningsstyrte ionekanaler, er kalsiumantagonister og visse andre antiarytmika. Detaljert informasjon om spenningsstyrte ionekanalers klassifikasjon finnes på nettsiden www.iuphar.org.
Ionekanaler kan også styres av kjemiske signaler (som acetylkolin, som virker på nikotin-acetylkolin-reseptor) og kalles da ligandstyrte ionekanaler eller ionotropiske reseptorer. Ligandstyrte ionekanaler er ionekanaler som er bundet til en reseptor, og regulering av kanalfunksjon påvirkes/styres via eller gjennom reseptoren. Benzodiazepiner virker via ligandstyrte ionekanaler.
Reseptorer
Reseptorer er de viktigste molekyler sett i forhold til legemidlers påvirkning og viser stor variasjon. Når binding til en reseptor skjer, forandres reseptormolekylets form og funksjon, og en effekt utløses. Reseptorer er inndelt i forskjellige grupper, for eksempel opioide reseptorer, adrenerge reseptorer, muskarine reseptorer m.m. Nærmere omtale av reseptorklassifikasjon finnes på nettsiden www.iuphar.org.
Reseptoren kan, når en ligand er bundet, utløse en effekt raskt (millisekunder) for eksempel ved å påvirke en ionekanal, kan utløse en effekt etter minutter til timer hvis, for eksempel den aktiverte reseptoren påvirker enzymer via G-proteinkobling, eller etter mange timer dersom den aktiverte reseptoren er en kjernereseptor og påvirker transkripsjon av gener, for eksempel steroidreseptoren. G-protein-koblede reseptorer utgjør mer enn 50 % av alle mottakermolekyler legemidler virker på.
Eksempler på legemidler som virker via reseptorer er β-blokkere, antihistaminer, opioider (som morfin) og insulin (tab 1).
Agonisme og antagonisme
En ligand som binder til en reseptor og utløser en effekt er en agonist, i motsetning til en ligand som binder til en reseptor og hemmer utløsing av en effekt (antagonist). Det finnes også partielle agonister, som bare utløser en partiell effekt – dette på grunn av lavere effektivitet (fig 2). Noen reseptorer har også en basal virkning, dvs. at de virker til en viss grad uten at en ligand er bundet (8 – 10). Antagonistblokaden vil være avhengig av mengden endogen ligand som er til stede ved reseptoren, og dette har betydning for dosering av antagonister.
Spesifisitet, selektivitet og mottakerproteiner
Cellenes DNA inneholder gener for oppbygging av alle kroppens proteiner. Proteiner er laget av en kombinasjon av aminosyrer som er kodet av forskjellige kombinasjoner av nukleinsyrer. Strukturen til proteinet er bestemt av denne aminosyresekvensen. Små forskjeller eller mutasjoner i DNA-koden kan derfor forårsake forskjeller i mottakerproteinets struktur og funksjonalitet.
Bindingssetet på mottakerproteinet har på samme måte en bestemt aminosyresammensetning og romlig form som gjør at spesifikke ligander binder seg til mottakerproteinet. Mønsteret bestemmer hvilke ligander som kan «passe» i bindingssetet. Dette er kjent som spesifisitet. Mange bruker en nøkkel-og-lås-analogi, hvor liganden sammenliknes med en nøkkel, mottakerproteinet med en lås, og det aktive stedet til nøkkelhullet. Endres aminosyresammensetningen i dette området, kan bindingsegenskapene til mottakerproteinet også endres. Her er mulighetene for genetiske varianter av mottakerproteiner (11).
Hvis strukturen til et mottakerprotein er kjent, er det mulig å lage et legemiddel som kan passe i det aktive bindingssetet på mottakerproteinet. Dette er et viktig område i legemiddelforskning i dag.
Til tross for spesifisitet kan noen ligander binde til flere mottakerproteiner av samme type (likhetstrekk), med utløsning av ønskede og uønskede effekter. Et legemiddel som binder og påvirker β₁-reseptorer (for eksempel metoprolol, som er en antagonist til β₁-reseptorer) ved høye doser, vil også kunne påvirke β₂-reseptorer, fordi β₁- og β₂-reseptorene har svært lik aminosyresammensetning. Det er derfor viktig å være klar over at selektivitet kan være doseavhengig.
Konklusjon
De alle fleste legemidler virker ved å reagere med mottakermolekyler som hovedsakelig er proteiner av fire ulike typer – enzymer, transportproteiner, ionekanaler og reseptorer. Interaksjonen mellom legemiddel og protein er spesifikk og selektiv. Legemidlet kan gi raske, middelsraske og sene reaksjoner i cellen. Bindingseffektkurver brukes for å beskrive legemiddeleffekter og for sammenlikning av potensen til legemidler innen samme legemiddelgruppe. Det er viktig å kjenne til generelle farmakodynamiske prinsipper for å forstå hvordan legemidler virker i kroppen.