I tidligere artikler i Tidsskriftet er det beskrevet hvordan et legemiddel absorberes og distribueres i kroppen (1, 2). I denne tredje artikkelen omtales viktige forhold ved nedbrytning og utskilling av legemidler.
Mens vannløselige (polare) legemidler i prinsippet utskilles uforandret i urinen, er omdanning til mer vannløselige metabolitter en viktig prosess for at fettløselige legemidler skal kunne skilles ut. Fettløselige stoffer vil ellers reabsorberes fra nyretubuli tilbake til blodet og dermed sirkulere i kroppen i svært lang tid. Nedbrytningen av legemidler skjer i all hovedsak i leveren, men metabolisme av legemidler kan også skje andre steder, som i plasma, i tarmveggen og i andre vev. Noen legemidler skilles ut metabolisert eller umetabolisert i feces via gallen, mens andre hovedsakelig elimineres via utåndingsluft. Eksempler på legemidler som elimineres via disse ulike mekanismene presenteres i tabell 1.
|
Tabell 1 Eksempler på legemidler som elimineres via ulike mekanismer
|
|
Metabolisme i lever
|
|
Digitoksin
|
|
Metoprolol
|
|
Paracetamol
|
|
|
Metabolisme i plasma
|
|
Levodopa
|
|
Pivampicillin
|
|
Suksameton
|
|
|
Metabolisme i tarm
|
|
Digitoksin (via bakterier i tarmlumen)
|
|
Diltiazem (i tarmveggen)
|
|
|
Ekskresjon i nyrene
|
|
Litium
|
|
Atenolol
|
|
Furosemid
|
|
|
Ekskresjon i galle/feces
|
|
Ciklosporin
|
|
Erytromycin
|
|
Etinyløstradiol-glukuronid
|
|
|
Eliminasjon via utåndingsluft
|
|
Etanol (i små mengder)
|
|
Inhalasjonsanestetika, inklusive lystgass
|
Metabolisme i lever
Som oftest gis legemidler i aktiv form. I leveren omdannes de til inaktive metabolitter (tab 2). Noen legemidler er imidlertid inaktive når de gis (såkalte prodrugs), men brytes ned til stoffer med farmakologisk effekt (aktive metabolitter). Andre legemidler er aktive i seg selv samtidig som de har aktive metabolitter. Noen legemidler har også metabolitter som er årsak til bivirkninger (tab 2). Danning av toksiske eller allergene metabolitter hos enkeltindivider med avvikende metabolisme er en viktig årsak til såkalte idiosynkratiske (ikke-forutsigbare) bivirkninger.
|
Tabell 2 Eksempler på metabolisme av legemidler
|
|
Aktiv → inaktiv
|
Citalopram → desmetylcitalopram
|
|
Morfin → morfin-3-glukuronid
|
|
Klozapin → desmetylklozapin
|
|
|
|
Inaktiv → aktiv
|
Kodein → morfin
|
|
Enalapril → enalaprilat
|
|
Pivampicillin → ampicillin
|
|
Levodopa → dopamin
|
|
Simvastatin → simvastatinsyre
|
|
|
|
Aktiv → aktiv
|
Morfin → morfin-6-glukuronid
|
|
Klomipramin → desmetylklomipramin
|
|
Diazepam → N-desmetyldiazepam → oksazepam
|
|
Karbamazepin → karbamazepin-epoxid
|
|
|
|
Aktiv → toksisk/allergen
|
Paracetamol → N-acetyl-P-benzoquinonimin (NAPQI) (levertoksisk)
|
|
Penicillin → penicilloyl → penicilloyl-proteinkonjugat (allergent)
|
Metabolismen av legemidler i leveren skjer i prinsippet i to trinn. I det første trinnet (fase 1-metabolisme) avdekkes eller dannes små polare grupper som gjør legemidlet mer vannløselig. Det vanligste er at det tas bort CH₃-grupper (demetylering) eller at det legges til OH-grupper (hydroksylering). Imidlertid kan dette være utilstrekkelig for å få legemidlene skilt ut. I slike tilfeller kan større molekyler, slik som sulfat eller glukuronsyre, kobles på (fase 2-metabolisme; konjugeringsreaksjoner). For visse legemidler, som paracetamol, oksazepam og morfin, kan glukuronsyre kobles på direkte uten noen forutgående fase 1-metabolisme.
Mange ulike enzymer deltar i metabolismen av legemidler. For fase 1-reaksjoner er cytokrom P-450-enzymene (CYP-enzymene) viktigst. Dette er et enzymsystem som omfatter mer enn 50 ulike enkeltenzymer, men bare rundt ti av dem har noen kjent betydning for metabolismen av legemidler (3). Aktiviteten til CYP-enzymene er bestemt ut fra så vel arvelige faktorer som faktorer i omgivelsene. Forskjellen i enzymaktivitet mellom ulike individer er enorm og forklarer mye av den store interindividuelle variasjonen i effekt og bivirkninger man ser når man gir én og samme dose av et legemiddel til forskjellige individer. Hemming og induksjon av aktiviteten til CYP-enzymer er viktige forhold som forklarer og i noen grad kan forutsi interaksjoner mellom legemidler (3). Noen legemidler, som karbamazepin, fenytoin og rifampicin, induserer CYP-enzymaktiviteten. I regelen påvirkes da flere ulike CYP-enzymer i større eller mindre grad. Andre legemidler hemmer CYP-enzymaktiviteten. Dette skjer i regelen mer spesifikt. Også mat og drikke, naturmidler og andre faktorer kan påvirke kapasiteten til CYP-enzymene. Grapefrukt og grapefruktjuice inneholder stoffer som hemmer CYP-enzymet CYP3A4, naturmidlet johannesurt inneholder stoffer som induserer flere ulike CYP-enzymer, mens sigarettrøyk inneholder stoffer som induserer CYP-enzymet CYP1A2.
For fase 2-reaksjoner er uridindifosfatglukuronosyltransferasesystemet (UGT-systemet) viktigst. Dette er et system som er mindre studert enn CYP-systemet, både når det gjelder genetiske forskjeller i aktivitet, påvirkning av omgivelsesfaktorer og hvilke legemidler som brytes ned av de enkelte enzymene. En av de viktigste interaksjonene i UGT-systemet er p-pillers induserende effekt, noe som kan øke metabolismen av legemidler som elimineres via glukuronidering. Dette er vist blant annet for lamotrigin, oksazepam og morfin (4).
Ved nedsatt leverfunksjon må dosen av legemidler som metaboliseres i leveren av og til reduseres. Leverskaden skal imidlertid være stor før kapasiteten til de legemiddelmetaboliserende enzymene reduseres signifikant.
Etter fødselen modnes de ulike legemiddelmetaboliserende enzymene med ulik hastighet. Noen enzymsystemer er nærmest ferdigutviklet allerede ved fødselen, men for de fleste enzymene tar det 3 – 6 måneder før kapasiteten per kilo kroppsvekt er på nivå med det man ser hos voksne.
Senere i livet er leverens metabolismekapasitet er ofte godt bevart, slik at det ut fra leverfunksjonen ofte ikke er nødvendig å redusere legemiddeldosen til eldre. Det finnes imidlertid en rekke andre gode grunner for å gi eller i det minste starte med lave doser til eldre, slik som økt bivirkningsfølsomhet og reduserte fysiologiske kompensatoriske mekanismer (5).
Ekskresjon via gallen
Visse legemidler, fremfor alt fettløselige midler med høy molekylvekt, skilles ut metabolisert eller umetabolisert via gallen (tab 1). Mange av disse midlene har en enterohepatisk resirkulasjon. Det vil si at de, etter å ha blitt skilt ut i tarmen via gallen, på ny vil kunne absorberes fra tarmen til blodet, skilles ut i tarmen via gallen osv. Hvis reabsorpsjonen fra tarmen av en eller annen grunn hemmes, vil nivåene av legemidlene bli for lave og effekten bli redusert. Et slikt eksempel er p-piller, der bredspektrede antibiotika gitt peroralt kan redusere den bakterielle spaltingen fra etinyløstradiol-glukuronid til fritt etinyløstradiol og dermed nedsette den normale reabsorpsjonen av etinyløstradiol, med mellomblødninger og eventuelt nedsatt graviditetsbeskyttelse som resultat.
Renal ekskresjon
Vannløselige legemidler (tab 1) skilles hovedsakelig ut umetabolisert i nyrene. Noen legemidler har også aktive metabolitter som skilles ut i nyrene. Et slikt eksempel er morfin, som har morfin-6-glukuronid som aktiv metabolitt. Stoffene kan skilles ut i urinen ved hjelp av glomerulær filtrasjon eller tubulær sekresjon. Etter at et legemiddel er filtrert gjennom glomeruli, vil graden av fettløselighet og ioniseringsgraden avgjøre hvor stor andel som vil bli reabsorbert i tubuli.
Visse legemidler pumpes aktivt ut i urinen ved tubulær sekresjon. Det er identifisert i alt rundt ti ulike legemiddeltransportører i nyretubuli, og disse kan deles inn i to hovedtyper. Noen transportører (organiske aniontransportører) pumper hovedsakelig ut svake syrer som penicilliner, ikke-steroide antiinflammatoriske legemidler (NSAID-preparater), metotreksat og probenecid. Andre transportører (organiske kationtransportører) pumper hovedsakelig ut svake baser som for eksempel trimetroprim. Siden dette er transportsystemer med begrenset kapasitet, vil legemidler kunne interagere med hverandre ved å konkurrere om disse transportmekanismene (6). Legemidler kan også konkurrere med endogene stoffer om tubulær sekresjon. For eksempel vil den normale tubulære sekresjonen av kreatinin hemmes av trimetoprim. Ved behandling med trimetoprim kan derfor serumkonsentrasjonen av kreatinin stige, uten at dette nødvendigvis er uttrykk for noen nyreskade.
Ved nedsatt nyrefunksjon må dosen av legemidler som skilles ut umetabolisert i nyrene (som litium) eller som har aktive metabolitter som skilles ut renalt (som morfin) reduseres. I denne sammenhengen er det viktig å huske på at eldre mennesker fysiologisk sett kan ha en betydelig nedsatt nyrefunksjon (fig 1). Etter fødselen tar det mange måneder før glomerulær filtrasjon og tubulær sekresjon er fullt utviklet. Det må derfor også tas særskilte hensyn ved dosering av legemidler som skilles ut renalt til spedbarn.
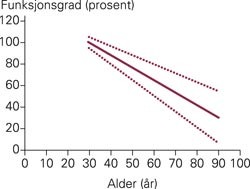
Prinsippskisse for graden av reduksjon i nyrefunksjonen med økende alder. Den heltrukne linjen viser gjennomsnittet og de stiplede linjene viser normalvariasjonen. Observer at variasjonen i nyrefunksjon mellom ulike individer øker med økende alder
I motsetning til leverfunksjonen kan nyrefunksjonen monitoreres relativt enkelt ved å måle serumkonsentrasjonen av kreatinin. Det er imidlertid kreatininclearance og ikke serumkonsentrasjonen av kreatinin som direkte kan korreleres til nyrenes evne til å skille ut legemidler. Ut fra formler eller nomogrammer kan kreatininclearance beregnes ved hjelp av serumkonsentrasjonen av kreatinin og alder, kjønn og kroppsvekt (5). Hovedregelen er at dosen av et legemiddel som utskilles umetabolisert i urinen må reduseres proporsjonalt med reduksjonen i kreatininclearance sett i forhold til en normalverdi på 120 ml/min. Siden serumkonsentrasjonen av kreatinin også påvirkes av muskelmassen, kan liten muskelmasse, som for eksempel hos små og tynne eldre personer, medføre at serumkonsentrasjonen av kreatinin er tilsynelatende normal også ved betydelig nedsatt nyrefunksjon.