Årlig rammes rundt 3 100 kvinner og menn i Norge av kolorektal kreft, og nær halvparten dør innen fem år etter diagnosetidspunktet. Det er dokumentert at screening kan redusere dødeligheten, men hvilken screeningmetode skal velges? Koloskopi muliggjør samtidig diagnostikk og behandling, men er belastende for pasienten. Fremtiden ligger i utvikling av genbaserte og proteinbaserte diagnostiske tester. Klinisk bruk av slike tester forutsetter vitenskapelig dokumentasjon av effekt. Det er fortsatt betydelige svakheter og kostnader ved gentesting i avføring.
Reduksjon i kreftspesifikk dødelighet som følge av screening er vist i flere studier, bl.a. den norske NORCCAP-studien (1), men omfattende screening for kolorektal kreft er ennå ikke etablert i Norge (2). Tidlig diagnose av kolorektal kreft og forstadier til kolorektal kreft ved påvisning av feil i gener og proteiner er nå mulig. Flere internasjonale selskaper, bl.a. EXACT Sciences med sin test PreGen-Plus, har utviklet fekale gentester for kolorektal kreft (3). I Norge har produktet Genefec fra firmaet NorDiag vært i klinisk bruk siden 2002.
Fordelen med ikke-invasive tester, som fekale gentester er, er at det ikke påfører pasienten ubehaget ved koloskopi og således kan øke deltakelsen ved screening. Da tarmens slimhinne stadig avsetter epitelceller, vil det være kontinuerlig tilgang på DNA som kan undersøkes – i motsetning til påvisning av okkult blod i avføring, en metode som forutsetter at polyppen/lesjonen blør, noe den ikke gjør hele tiden (fig 1). Imidlertid gir ikke avføringstester mulighet for samtidig behandling, dvs. fjerning av polypper, slik som ved koloskopi. Innsamlingen av avføring kan være noe upraktisk, for som regel kreves hel tarmtømming for å få nok til utvinning av DNA. Dette kan dermed føre til redusert etterlevelse hos pasientene. Flere ubesvarte spørsmål gjenstår hva gjelder metodenes holdbarhet, diagnostiske treffsikkerhet og kostnadseffektivitet og klinisk anvendelse for denne typen molekylærbaserte tester.
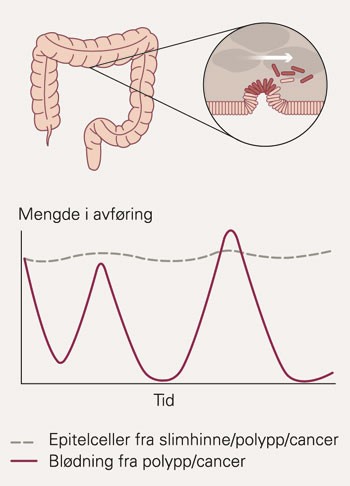
Øverste panel illustrerer hvordan epitelceller, godartede og ondartede, blir tatt med av avføringen gjennom tarmkanalen. I nedre panel fremstilles grafisk en relativt jevn tilgang på epitelceller ifra tarmens slimhinne over tid. Blødninger, derimot, viser periodiske variasjoner, noe som påvirker muligheten til fekal okkult blodtesting
Gunnar Baatrup har i et innlegg i Tidsskriftet nylig etterlyst bruksområdet for Genefec (4). Tilsvaret fra produsenten NorDiag (5) er i beste fall tuftet på unøyaktighet, i verste fall på svak translasjonsforskning basert på økonomiske motiver. Ifølge firmaet skal Genefec
være en diagnostisk test til bruk hos symptomatiske pasienter
gi tilleggsinformasjon for legen
detektere de molekylære forandringer som finner sted tidlig i karsinogenesen
være komplementær til koloskopi
følge samme kliniske indikasjon som fagmiljøene anbefaler for test for okkult blod i avføring (FOBT)
ved negativt svar føre til videre utredning av aktuelle symptomer
I NorDiags fremstilling er det på flere punkter brist i den biologiske og vitenskapelige fremstillingen av produktet.
Diagnostikk eller screening?
Som en diagnostisk metode for symptomatiske pasienter, og således ikke en screeningmetode, er NorDiags henvisning til «dokumentasjonsstudier» (6) basert på evaluering av fekal DNA-test hos asymptomatiske pasienter – dermed som screeningmetode. I den siterte studien (6) var fekal gentest, bestående av multiple gener, signifikant bedre enn test for okkult blod i avføringen for diagnostisering av tykktarmskreft, men testene var likeverdige for oppdagelse av adenomer, selv om rundt 85 % av adenomene ikke blir oppdaget. Fekal gentest som inneholder multiple gener (6, 7) øker altså ikke sjansen for å oppdage forstadiene til tykktarmskreft sammenliknet med test for okkult blod i avføringen. Er det da riktig å bruke Genefec som erstatning (8) for test for okkult blod eller til å avgjøre hvem som skal/bør ha videre koloskopi?
Målrettet tumorbiologi?
Kun 35 – 45 % av sporadiske tykktarmssvulster inneholder K-ras-mutasjoner (3). Slike mutasjoner finnes også i normal slimhinne og i hyperplastiske polypper og ved inflammatorisk tarmsykdom, i tillegg til i andre gastrointestinale svulster og forstadier, f.eks. i bukspyttkjertelen (9). De fleste forskergrupper har derfor rettet sin oppmerksomhet mot andre markører, slik som mikrosatellittinstabilitet, epigenetiske endringer/metyleringsendringer, utvalgte APC-mutasjonsassay, langfragmentert (ikke-apoptotisk) DNA o.l., som er mer egnet til diagnostisering av kreft i mage-tarm-tractus (3). Forståelse av den heterogene karsinogenesen i tykktarmen (10), der om lag 15 – 20 % av alle svulstene har mikrosatellittinstabilitet og opptil halvparten inneholder en eller flere former for metyleringsfeil, er avgjørende for valg av markører (e-fig 2). Til dags dato er det ikke påvist samtlige mutasjoner i en og samme svulst, multiple genmarkører i en test er dermed nødvendig.
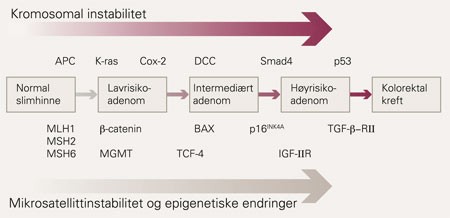
Illustrasjonen gir et forenklet overblikk over kreftutvikling gjennom flere forstadier og hvordan denne drives av ulike genetiske signalveier. Bildet er ikke absolutt, og betydelig overlapping forekommer
Genefec II, basert på K-ras og p53, inneholder to uspesifikke kreftmarkører. Mutasjoner i det universale tumorsuppressorgenet p53 opptrer først i overgangen fra adenom til kreft og egner seg lite til å påvise forstadier av tykktarmskreft. Således er det biologisk tvilsomt om K-ras og p53 er de beste og riktigste markørene for denne type testing. Ahlquist og medarbeidere har vist at sensitiviteten forble uendret for tykktarmskreft, mens spesifisiteten økte for oppdagelse av adenomer når K-ras ble utelukket fra deres multipanel av gener hos pasienter med kjent neoplasi i tykktarmen (7). Langfragmentert DNA, markører for mikrosatellittinstabilitet (Bat-26, MLH1) og epigenetiske markører (p16, MGMT) er sannsynligvis mer lovende (e-fig 2).
Vitenskapelig grunnlag?
At Genefec II lanseres mer enn fem år etter andre multipaneltester, kan tyde på at firmaet henger etter vitenskapelig. Kanskje er det brukt mer tid på patentering, markedsføring og børsnotering enn på metode og innhold? At testen har vært i bruk i flere år uten at det er fremlagt vitenskapelige kliniske data, annet enn en ren metodebeskrivelse, er betenkelig og uetisk.
Horn & Parker fra NorDiag henviser til resultater presentert på WCGC-kongressen i 2006 i Barcelona (der jeg selv deltok). De to abstraktene de henviser til (11, 12), har identisk tekst og innhold, men ulike titler og forfatterliste, noe som er uakseptabel dobbeltpublisering. I posterpresentasjonen tilsvarende abstrakt P-046 oppsummeres en mutasjonsanalyse av 77 biopsier fra 64 pasienter med mutasjonsfrekvens av K-ras, B-raf, APC, PIK3CA og p53, angivelig såkalt Genefec II-assay. Disse resultatene er i beste fall metodebeskrivelse og er ikke egnet som bevisføring for en ny diagnostisk metode. Posterpresentasjonen tilsvarende abstrakt P-142 gjengir resultater fra Genefec I, med kun K-ras. Fekalt DNA ble testet i 3 685 symptomatiske pasienter, hvorav 56 var positive for Genefec. Av disse fikk 48 (86 %) utført koloskopi – 23 hadde kolorektal «kreft», to hadde kreft i bukspyttkjertelen (påvist etter CT) og hos åtte var koloskopifunnene ukjente. I en tabell angis at kun fem pasienter fikk utført kirurgi (antakelig pga. kreft?), 11 pasienter fikk fjernet polypp, fire pasienter fikk oppfølging med koloskopi, grunnet flate lesjoner, og tre pasienter fikk ikke fullført koloskopi. Hos hvor mange av de 3 629 symptomatiske pasientene med negativ Genefec-test var det likevel patologiske lesjoner i tykktarmen? Disse er ikke fulgt opp eller gjort rede for, noe som umuliggjør evaluering av bl.a. falskt negative funn ved testen.
Er populasjonen representativ? Forekomsten av fem krefttilfeller (0,14 %) og 15 polypper/flate lesjoner (0,41 %) blant 3 685 symptomatiske pasienter er i underkant av forventet i forhold til den asymptomatisk screenede norske befolkning, hvor oppdagede krefttilfeller er to ganger høyere og antallet med polypper 10 – 40 ganger høyere (1). Dette tyder enten på at det må ligge en høy andel udiagnostiserte falskt negative tilfeller i studien eller at det har vært en skjevhet i rekrutteringen. I alle tilfeller er tallene ikke egnet for vurdering av testens diagnostiske egenskaper. Bruk av en slik test burde ikke skje utenfor studieprotokoll med etisk godkjenning, helst med kontrollgruppe og i det minste med bruk av en gullstandard (koloskopi) som kontroll for testens diagnostiske evne.
Kostnader
Bruk av Genefec i norsk allmennpraksis er refusjonsberettiget. Pasienten betaler 48 kroner i egenandel og firmaet refuseres med 1 100 kroner, ifølge opplysninger fra markedsavdelingen til NorDiag. Det koster således minst 1 148 kroner for hver test som utføres, herunder ikke inkludert utgifter til annen diagnostikk, legetimer etc. Gitt tallene ovenfor koster det noe over 4,2 millioner kroner å teste 3 685 pasienter med Genefec, dvs. rundt 846 000 kroner for hvert krefttilfelle. At bevilgende helsemyndigheter mener dette er vel anvendte penger selv om testen likevel ikke endrer utredningsalgoritme eller kostnader ved andre diagnostiske metoder, er høyst betenkelig, så lenge det mangler vitenskapelig dokumentasjonen for testen. Andre har anslått at gentesting er opptil 200 ganger dyrere enn testing for okkult blod i avføringen. Det må foreligge kostnad-nytte-analyser og dokumentasjon av helsegevinst i godt planlagte studier før denne typen testing kan implementeres i vanlig klinisk praksis (3, 13).
Konsekvens i utredning av pasienter?
En primærlege som lurer på om pasientens symptomer kan tilskrives gastrointestinal kreft, vil være like langt i utredningen etter bruk av Genefec. Ved positivt svar må pasienten utredes videre – for enhver type av gastrointestinal kreft eller forstadium til dette. Ved negativt svar må også pasienten utredes, da dette anbefales fra NorDiag – ettersom testen kun skal utføres på symptomatiske pasienter. Den eneste (økonomiske) gevinsten ser da ut til å være hos NorDiag. Hvordan skal primærlegen forholde seg til en symptomatisk pasient med positiv test der det ikke er funn ved videre utredning? Er vedkommende en «genetisk tikkende bombe»?
Teknisk, metodemessig og kostnadsmessig synes ikke Genefec å være bedre enn andre diagnostiske metoder. De diagnostiske tiltakene, som koloskopi, endres ikke for pasienter med symptomer. Testen er et fordyrende mellomledd før endelig diagnostikk. Det er heller ikke vist at testen for den aktuelle målgruppen har betydning for overlevelsen. Studier på testens diagnostiske verdi og kliniske betydning er nødvendig før utbredt markedsføring og klinisk rutinebruk kan forsvares (3, 13). NorDiag selger ikke bare skinnet før bjørnen er skutt – de gjør også sine brukere en bjørnetjeneste som verken bringer diagnostikk eller tidlig behandling fremover. Et potensielt spennende og lovende norsk molekylærbiologiske produkt fremstår således som useriøst.