En 76 år gammel mann ble henvist til lokalsykehus på grunn av hyperkalsemi med en totalkalsiumverdi på 3,05 mmol/l. Han hadde hypertensjon, oppdaget for første gang for mange år siden, men kun behandlet i en periode. Seks år tidligere, i forbindelse med fornyelse av førerkortet, hadde han igjen fått påvist forhøyet blodtrykk, og det ble da startet behandling med Diovan (valsartan) og Norvasc (amlodipin). Mot artroseplager i begge hendene brukte han Vioxx (rofecoxib) ved behov. Omtrent tre måneder før innleggelsen hadde han fått ankelødemer og hadde følt seg slapp og svimmel. Det hadde ikke vært noen forandringer når det gjaldt matlyst, kroppsvekt eller avførings- og vannlatingsmønster. Han hadde ikke hatt nattesvette, feber, tung pust eller smerter.
Ved innleggelsen var blodtrykket 120/70 mm Hg og pulsen regelmessig, 82 slag per minutt. Det ble funnet en systolisk bilyd med punctum maximum over aortastedet og utstråling til halskar, forstørret lever og lette ødemer ved anklene.
Tabell 1 viser blodprøver ved første innleggelse. Kalsiumnivået var 3,02 mmol/l, SR 84 mm/t og PTH-verdien 0,8 pmol/l.
|
Tabell 1 Blodprøver ved første innleggelse
|
|
Hb
|
16,3 g/100 ml
|
Kreatinin
|
94 µmol/l
|
|
Leukocytter
|
11,6 · 10⁹/l
|
Glukose
|
6,8 mmol/l
|
|
Nøytrofile celler
|
6 · 1012/l
|
Total bilirubin
|
7 mol/l
|
|
Lymfocytter
|
4,2 · 10⁹/l
|
Albumin
|
27 g/l
|
|
Monocytter
|
0,9 · 10⁹/l
|
ALP
|
191 U/l
|
|
Eosinofile celler
|
0,17 · 10⁹/l
|
γ-GT
|
227 U/l
|
|
Basofile celler
|
0,1 · 10⁹/l
|
ASAT
|
54 U/l
|
|
SR
|
84 mm/t
|
ALAT
|
48 U/l
|
|
CRP
|
< 10 mg/l
|
Kalsium
|
3,02 mmol/l
|
|
Natrium
|
137 mmol/l
|
Ionisert kalsium
|
1,44 mmol/l
|
|
Kalium
|
4,6 mmol/l
|
|
|
|
PTH
|
0,8 pmol/l (< 2,6)
|
|
|
|
Kolesterol
|
10,8 mmol/l
|
|
|
|
Triglyserider
|
4,7 mmol/l
|
|
|
|
S-25(OH)-vitamin D 25 nmol/l (37 – 131)
|
|
|
|
S-1,25(OH)-vitamin D₂ 104 pmol/l (42 – 169)
|
|
|
|
ACE
|
113 U/l (20 – 100)
|
|
|
De to klart viktigste årsaker til hyperkalsemi er malign sykdom, som lungekreft, brystkreft, lymfom og myelomatose, og primær hyperparatyreoidisme. Andre sjeldnere årsaker er granulomatøse sykdommer som tuberkulose eller sarkoidose, familiær hypokalsiurisk hyperkalsemi, A- og D-vitaminintoksikasjon, tiazidbruk, overforbruk av syrenøytraliserende medikamenter (melk-akali-syndrom) og langvarig sengeleie (1).
Lav PTH-verdi utelukket primær hyperparatyreoidisme og familiær hypokalsiurisk hyperkalsemi. Normale vitamin D-verdier utelukket vitamin D- intoksikasjon. Det var heller ingen holdepunkter i anamnesen for langvarig sengeleie eller medikamentell årsak til hyperkalsemi. A-vitaminforgiftning er veldig sjeldent. Dette var ikke undersøkt hos pasienten, men det var ingenting i anamnesen som kunne tyde på det.
Blodprøvene var best forenlig med at pasienten hadde hyperkalsemi på grunn av malign sykdom. Sarkoidose var én mulig differensialdiagnose.
Urinstiks viste +3 protein, ingen funn i sedimentet. Det ble målt proteinuri ca. 11 g/l. Det var ingen monoklonal komponent, verken ved serum- eller urin- elektroforese. Utstryk av perifert blod og sternalmarg viste lett lymfocytose, men innenfor normale verdier. Væskestrømscytometri av perifert blod viste normal fordeling av B- og T-lymfocytter. Serologiske undersøkelser på hepatitt og hiv, ANA, C- og P-ANCA, anti-MPO, anti-PR3, anti-GBM og tumormarkører (PSA og NSE) var alle negative. Det var ingen patologiske funn ved røntgen thorax, og ved røntgen totalskjelett så man ingen osteolytiske lesjoner. Skjelettscintigrafi viste lett forhøyet opptak i Th8, sannsynligvis av degenerativ natur. Ultralydundersøkelse av abdomen viste en cyste i venstre nyre og en liten cyste i høyre. CT abdomen var negativ.
Pasienten fikk behandling med pamidronatinfusjon (Aredia), med normalisering av kalsiumnivået. Han ble henvist videre til utredning av nefrotisk proteinuri ved nefrologisk seksjon ved universitetssykehus.
Pasienten hadde gjennomgått omfattende utredning ved sitt lokalsykehus, uten at det ble påvist malign sykdom. Det var ingen holdepunkter for myelomatose (ingen M-komponent i serum eller urin, ingen osteolytiske lesjoner ved røntgen skjelett, normalt antall plasmaceller i beinmargen).
Med tanke på sarkoidose hadde man målt ACE-nivået, som var litt forhøyet. Manglende dyspné, negativ røntgen thorax og i tillegg normale 1,25(OH)-vitamin D₂-verdier gjorde diagnosen sarkoidose lite sannsynlig.
Pasienten hadde betydelig proteinuri, i nefrotisk område. Han hadde lavt albuminnivå (27 g/l) og ødemer og hadde derfor definisjonsmessig nefrotisk syndrom. Diabetes mellitus er en viktig årsak til nefrotisk proteinuri, men pasienten hadde ikke diabetes. Dernest er glomerulonefritt en vanlig årsak til nefrotisk syndrom (2). Man bør også tenke på amyloidose som en mulig differensialdiagnose, spesielt hos eldre mennesker. Nyreskade på grunn av langvarig hypertensjon eller bruk av ikke-steroide antiinflammatoriske legemidler (NSAID), som kan gi nefrotisk syndrom, var også mulige differensialdiagnoser (2). Ut fra kliniske funn og blodprøver var det ingen holdepunkter for å mistenke infeksjon eller autoimmun systemsykdom.
Ved universitetssykehuset ble pasienten utredet med nyrebiopsi, ny serum- og urinelektroforese, MR columna og ny beinmargbiopsi.
Både serum- og urinproteinelektroforese viste denne gangen et svakt monoklonalt bånd. Ved urinproteinelektroforese ble M-båndet identifisert som frie lette λ-kjeder med relativ lav konsentrasjon, ca. 250 mg/l (fig 1). Ved serumimmunfiksasjon fant man at M-båndet var komplett IgG-κ, i tillegg fant man et svakt monoklonalt λ-protein i fremre γ -sone med samme mobilitet som i urin (fig 2).
MR columna viste degenerative forandringer og generelt lavt beinmargsignal i hele columna, men ingen osteolytiske lesjoner. Det ble utført nyrebiopsi, som ved lys- og elektronmikroskopi viste amyloidavleiringer i glomeruli og kar, lett interstitiell fibrose og tubulær atrofi (fig 3, fig 4). Immunohistokjemi av nyrebiopsien viste AL-amyloidose (lette kjeder).
Beinmargbiopsi viste massiv amyloidavleiring (fig 5). Ved immunhistokjemisk undersøkelse var mellom 5 % og 10 % av cellene plasmaceller (fig 6), hvorav mesteparten var λ-positive (fig 7), men en sikker histopatologisk myelomatosediagnose kunne ikke stilles.
Ekkokardiografi viste massiv hypertrofi, god venstre ventrikkel-funksjon, aortasklerose med lett stenose og tegn til diastolisk dysfunksjon.
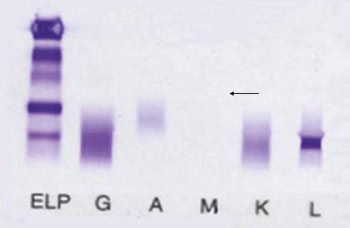
Figur 1 Påvisning av monoklonale frie lette λ-kjeder (←) ved urinimmunfiksasjonselektroforese
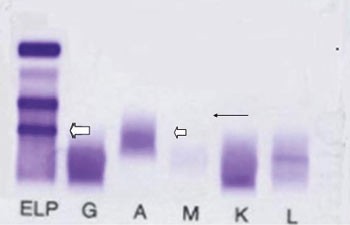
Figur 2 Serumimmunfiksasjonselektroforese. Påvisning av små mengder av komplett IgG-κ katodisk i γ -sonen (⇐) og monoklonale frie lette λ-kjeder (←) med samme mobilitet som i urin
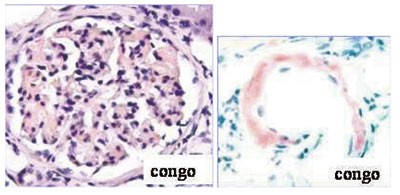
Figur 3 Nyrebiopsi. Kongofarging for amyloid
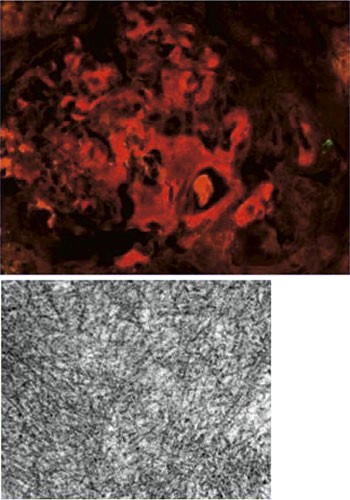
Figur 4 Øverste bilde viser glomerulære nedslag av anti-λ-positivt materiale (rødt) ved immunfluorescens. Nederste bilde viser fibrillær substruktur i nedslagene ved elektronmikroskopi
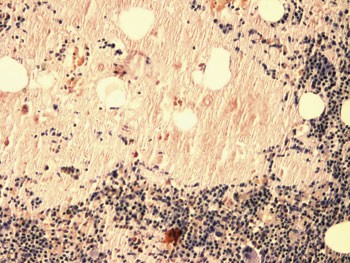
Figur 5 Beinmargsbiopsi. Kongofarging for amyloid
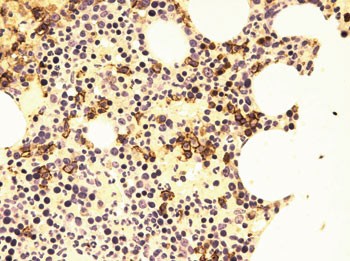
Figur 6 Beinmargsbiopsi. Immunfarging CD 138. Små ansamlinger av plasmaceller
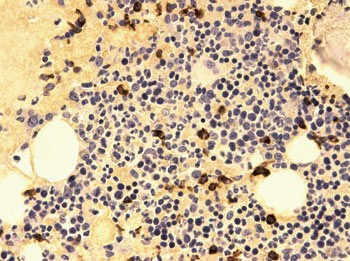
Figur 7 Beinmargsbiopsi. Immunfarging. Lette λ-kjeder
Utredningen viste at pasienten hadde AL-amyloidose med påvist nedslag av amyloid i nyre- og beinmargsbiopsi. Ekkokardiografi viste betydelig venstre ventrikkel-hypertrofi, overveiende sannsynlig på grunn av amyloidose.
Pasienten fikk på nytt stigende kalsiumverdier. Han fikk derfor behandling med zolendosyremonohydratinfusjon (Zometa), med god effekt. Mot amyloidosen fikk han prednisolon og melfalan.
Ved første polikliniske kontroll etter behandlingsoppstart var han i relativ god allmenntilstand, men han refererte en episode med hemoptyse. Han ble derfor henvist til bronkoskopi. Undersøkelsen ble dessverre ikke utført fordi han kort tid senere ble innlagt på grunn av dyspné, økende ødemer og ascites. Han hadde fortsatt uttalt nefrotisk syndrom med lett nyresvikt, men ut fra kliniske funn mistenkte man at symptomene var forårsaket av hjertesvikt. Det ble forsøkt behandling med Furix (furosemid) intravenøst og væskerestriksjon, uten effekt. Pasienten sovnet stille inn under oppholdet, fire måneder etter at diagnosen ble stilt. Obduksjon ble ikke utført.
Pasienten hadde AL-amyloidose. Dette forklarer at han hadde nefrotisk syndrom. Årsaken til hyperkalsemi var vanskeligere å forstå. Det er vel kjent at hyperkalsemi forekommer ved myelomatose. Hos vår pasient var det påvist M-komponent ved serum- og urinelektroforese og økt antall plasmaceller i beinmargsbiopsi, men de diagnostiske kriteriene for myelomatose var ikke oppfylt (ramme 1) (3, 4). Det er likevel slik at det er en plasmacelleproliferativ prosess som ligger til grunn for primær amyloidose. Det er derfor ikke urimelig å anta at hyperkalsemi kan forekomme ved AL-amyloidose, men oss bekjent er det ikke beskrevet tilfeller av hyperkalsemi ved AL-amyloidose uten samtidig myelomatose. I en studie fra Mayo-klinikken i USA hadde 11 av 474 pasienter med primær amyloidose hyperkalsemi. Alle disse hadde myelomatose (5).
Ramme 1
Kriterier for myelomatose
A Monoklonalt immunoglobulin (M-komponent) i serum av type IgG > 30 g/l, av type IgA > 20 g/l, av type IgD eller IgE uansett konsentrasjon, og/eller utskilling i urinen av M-komponent type κ eller λ > 1 g/24 t
B M-komponent i serum og/eller i urin i konsentrasjoner lavere enn referert over
C 10 % plasmaceller eller mer i aspirat av beinmarg eller plasmacytose i biopsi av skjelett- eller bløtdelstumor
D Osteolytiske skjelettdestruksjoner
For diagnose myelomatose kreves en kombinasjon av A + C eller A + D eller B + C + D. Ved ikke-sekretorisk myelom kan immunocytokjemisk påvist monoklonalitet av plasmacelleinfiltrat erstatte kriteriene A og B. Omregningsfaktor for IgG og IgA: g/l = µmol/l · 0,16
Vår konklusjon blir derfor at vi ikke med sikkerhet kan si hva som var årsaken til at pasienten hadde hyperkalsemi. Vi synes likevel at det er rimelig å anta at den plasmacelleproliferative sykdommen var årsaken til hyperkalsemien.
Diskusjon
AL-amyloidose, tidligere omtalt som primær amyloidose, er den vanligste og den mest alvorlige av de systemiske amyloidoseformene. Sykdommen skyldes deponering i alle organer av amyloid, som farges med kongorødt (6). AL-amyloidose forårsakes av en monoklonal plasmacelledyskrasi med danning av frie lette immunoglobulinkjeder (κ eller λ), som er grunnelementet i amyloidfibrillene (7). Diagnosen er vanskelig å stille. Det finnes ingen biokjemiske eller radiologiske undersøkelser som med sikkerhet kan påvise sykdommen. Diagnosen stilles ved påvisning av amyloid i vevsbiopsi (8).
Serum- og urinelektroforese er viktige undersøkelser i utredningen av nefrotisk proteinuri. Tilstedeværelse av frie lette monoklonale immunoglobulinkjeder i serum eller urin er diagnostiske karakteristika ved AL-amyloidose. Hos vår pasient fant man ikke M-bånd i serum eller urin ved utredningen ved lokalsykehuset, men hos opptil 20 % av pasienter med AL-amyloidose finnes det små mengder lette kjeder i serum som ikke kan identifiseres ved vanlig proteinelektroforese (9). I urinen er monoklonale proteiner ofte vanskelig å påvise fordi de maskeres av betydelig proteinuri. Det er derfor nødvendig å utføre immunfiksasjonselektroforese ved mistanke om AL-amyloidose, selv om vanlig proteinelektroforese er negativ. Likevel er det slik at 20 % av pasientene med primær amyloidose verken har M-bånd i serum eller i urin. Kvantitering av frie lette kjeder i serum er de siste årene blitt brukt i økende grad. Analysen har høyere sensitivitet enn immunfiksasjonselektroforese (10). Den utføres ikke ved Akershus universitetssykehus.
Denne kasuistikken viser at det kan være vanskelig å stille diagnosen amyloidose, og at vevsbiopsi er nødvendig.