Legemidler som påvirker inkretinsystemet (inkretinmodulatorer) representerer et nytt prinsipp i behandlingen av type 2-diabetes. Inkretinsystemet spiller en viktig rolle i reguleringen av glukosehomøostasen og forbereder organismen på næringsinntak ved hjelp av signalsubstanser som kalles inkretinhormoner. Inkretinmodulatorer potenserer inkretinhormonenes effekter, som blant andre er økt insulinproduksjon og -sekresjon, økt glukoseopptak og glykogensyntese, forsinket ventrikkeltømming og redusert appetitt. I motsetning til de andre antidiabetika med insulinøkende effekter, fører modulatorer av inkretinsystemet ikke til hypoglykemi og vektøkning. Foreløpig mangler langtidsstudier med inkretinmodulatorer og de er kun indisert kun som tilleggsbehandling ved type 2-diabetes.
Hyppigheten av type 2-diabetes øker sterkt og bidrar betydelig til sykelighet og dødelighet i befolkningen. Flere defekter i reguleringen av glukosehomøostasen ligger til grunn for utviklingen av type 2-diabetes, hvorav de viktigste er perifer insulinresistens, økt hepatisk glukoseproduksjon og β-celledysfunksjon (1).
Etter hvert som sykdommen utvikler seg, tilkommer en progredierende reduksjon i β-cellenes funksjon og masse, og de klarer ikke å kompensere for den foreliggende insulinresistens. Det fører til hyperglykemi og langtidsrisiko for mikro- og makrovaskulære komplikasjoner. Degenereringen av β-cellene skyldes sannsynligvis en genetisk predisposisjon for økt apoptose i tillegg til miljøpåvirkninger som toksiske effekter blant annet av høye nivåer av glukose og fettstoffer i blodet (2, 3).
Inkretinsystemet
Inkretinsystemet har en viktig rolle i glukosehomøostasen, og de to viktigste signalsubstansene som inngår er glukoseavhengig insulinotropt polypeptid (GIP) og glukagonliknende peptid 1 (GLP-1). Disse inkretinene forbereder kroppen på næringsinntak, først og fremst ved at bukspyttkjertelen raskt øker insulinproduksjonen og -sekresjonen. Konseptet ble beskrevet etter at man observerte langt kraftigere insulinstigning i blodet etter oralt inntak av glukose, enn om man ga glukose intravenøst i en mengde som ga samme blodsukkerprofil som den mengden som ble administrert peroralt (fig 1) (4). Denne inkretineffekten er betydelig redusert ved type 2-diabetes. Inkretinhormonene gjenfinnes i blodbanen bare minutter etter et måltid starter, og de produseres i ulike deler av tarmen. Glukoseavhengig insulinotropt polypeptid syntetiseres vesentlig i endokrine drepeceller i duodenum og i jejenum, mens glukagonliknende peptid-1 først og fremst utskilles fra endokrine L-celler i ileum og colon. Den raske sekresjonen av inkretinhormonene stimuleres sannsynligvis av en kombinasjon av en direkte effekt av fødemidler i tarmen, nevrogene og endokrine signaler (5). Frisettingen av inkretinhormonene fører til økt opptak av glukose i muskel- og fettvev og redusert glukoseproduksjon i lever. De viktige effektene i hjernen er redusert appetittfølelse, økt metthetsfølelse og redusert matinntak. Tømming av magesekken forsinkes og syresekresjonen reduseres. I bukspyttkjertelen reduseres glukagonsekresjonen fra α-cellene, mens det induseres økt nysyntese av insulin, økt insulinsekresjon og økt regenerering av β-cellenes masse (det siste er vist in vitro og i dyremodeller) (6) (e-tab 1).
|
Tabell 1 Effekter av stimulering av inkretinsystemet på ulike organer og vev. Basert på (6)
|
|
Vev
|
Biologisk funksjon
|
Farmakologisk funksjon
|
|
Tarm
|
GLP-1¹-syntese fra proglukagon
Økt GLP-1¹-sekresjon etter måltid
|
Økt insulinsekresjon og redusert blod-glukosenivå
|
|
Magesekk
|
Forsinket ventrikkeltømming
Redusert syresekresjon
|
Langsommere blodglukosestigning etter måltid. Redusert matinntak?
|
|
Lever
|
Økt glukoseopptak
Redusert glukoseproduksjon
|
Redusert blod-glukosenivå
|
|
Fettvev
|
Økt glukoseopptak
|
Redusert blod-glukosenivå
|
|
Muskel
|
Økt glukoseopptak
Økt glykogensyntese
|
Redusert blod-glukosenivå
|
|
Hjerne
|
Redusert appetitt, mat- og væskeinntak
Økt metthetsfølelse
|
Manglende vektøkning – vektreduksjon?
Fare for dehydrering?
|
|
Bukspyttkjertelen
|
Økt insulinproduksjon og -sekresjon
Redusert glukagonsekresjon
Økt syntese av proinsulin
Økt regenerering og vekst av β-celler
|
Økt insulinnivå. Beskyttende effekt mot ødeleggelse av β-cellene (?)
|
|
[i]
|
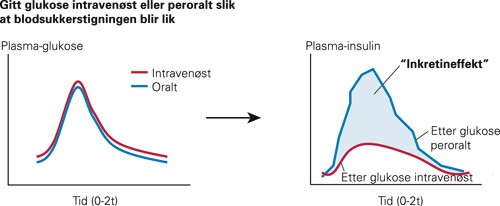
Figur 1 Illustrasjon av hvordan en viss mengde glukose gitt intravenøst gir mindre insulinstigning i blodet enn peroral glukosetilførsel tilpasset for å gi samme blodsukkerstigning
Mer kunnskap om inkretinhormonenes rolle i glukosereguleringen har økt interessen for å utnytte systemet i behandlingen av type 2-diabetes. Inkretineffektene er redusert ved type 2-diabetes, sannsynligvis som følge av manglende respons på glukoseavhengig insulinotropt polypeptid (7) og redusert sekresjon av glukagonliknende peptid 1 (8). Farmakologisk utvikling av medikamenter for å potensere effekten av inkretinsystemet har særlig vært konsentrert om glukagonliknende peptid 1.
Inkretinmimetika og dipeptidylpeptidase-4-inhibitorer
Endogent glukagonliknende peptid 1 har kort halveringstid (1 – 2 minutter) og er derfor lite egnet til terapeutisk bruk. Det aktive peptidet brytes raskt ned av enzymet dipeptidylpeptidase 4 (DPP-4), slik at effekten på glukosekonsentrasjonen i blodet etter subkutane injeksjoner er borte etter 1 – 2 timer (9). To nye legemiddelklasser som påvirker inkretinsystemet, GLP-1-analoger (inkretinmimetika) og DPP-4-inhibitorer (gliptiner) er nylig godkjent i Norge. Medikamentene har litt ulike angrepspunkter (fig 2).
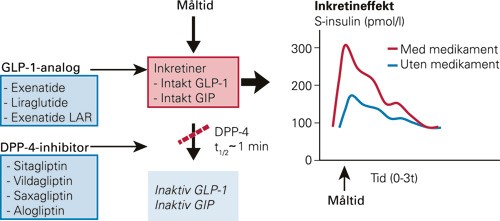
Figur 2 Virkningsmekanismene for glukagonliknende peptid 1 (GLP-1)-analoger og dipeptidylpeptidase 4 (DPP-4)-inhibitorer. GLP-1-analogene er designet slik at de ikke degraderes så raskt av dipeptidylpeptidase 4, mens DPP-4-inhibitorene hindrer enzymet i å degradere endogent glukagonliknende peptid 1 og glukoseavhengig insulinotropt polypeptid (GIP). Begge legemiddelgruppene fører til lengre virketid og økte biologiske effekter av glukagonliknende peptid 1 i organismen
Exenatide (Byetta) er det første inkretinmimetikum på markedet. Det er en analog av glukagonliknende peptid 1 hvor aminosyresammensetningen er endret slik at inaktiveringen ved dipeptidylpeptidase 4 hemmes. Halveringstiden er derved forlenget til 4 – 6 timer og legemidlet injiseres subkutant to ganger i døgnet med enkeltdoser på 5 – 10 µg. I Norge er exenatide indisert som tilleggsbehandling ved type 2-diabetes i kombinasjon med metformin og/eller sulfonylurea hos pasienter som ikke har oppnådd tilstrekkelig blodsukkerkontroll på høyeste tolererte dose av disse legemidlene. Startdosen er 5 µg to ganger daglig med økning ved behov til 10 µg to ganger daglig etter fire uker. På grunn av behovet for dosering flere ganger daglig har mer langtidsvirkende GLP-1-analoger vært etterspurt. Liraglutide har 97 % homologi med glukagonliknende peptid1 og er bundet til albumin som fungerer som et sterisk hinder for den enzymatiske nedbrytingen av peptidet. Liraglutide har halveringstid på ca. ti timer og skal injiseres en gang daglig. Medikamentet er fortsatt under klinisk utprøving. Det er også utviklet et meget langtidsvirkende preparat (Byetta LAR) som kan injiseres en gang per uke, men foreløpig er lite data tilgjengelig om dette medikamentet.
Sitagliptin (Januvia) er en DPP4-inhibitor som er indisert som tilleggsbehandling til pasienter med type 2-diabetes for å bedre blodsukkerkontrollen i kombinasjon med metformin eller PPARγ-agonist når diett, trening og metformin eller PPARγ-agonist ikke gir tilfredsstillende effekt. Andre DPP4-inhibitorer under utprøving er vildagliptin, saxagliptin og alogliptin. En viktig forskjell på GLP-1-reseptoragonister og DPP4-inhibitorer er at gliptinene administreres peroralt, noe som antas å øke brukervennligheten og pasientetterlevelsen.
Effekt og bivirkninger
De publiserte randomiserte kliniske studier med exenatide er gjort med medikamentet som tilleggsbehandling til eksisterende perorale antidiabetika hos pasienter med utilfredsstillende blodsukkerkontroll. De viser en gjennomsnittlig reduksjon i HbA1c på 0,8 – 1,0 % sammenliknet med placebo. Det er en effekt som i størrelsesorden er tilsvarende den man ser ved bruk av sulfonylureaforbindelser. Studiene viser også en gjennomsnittlig vektreduksjon under behandling med exenatide på 1 – 3 kg (10, 11). Hypoglykemi er sjeldent, med mindre medikamentet kombineres med et sulfonylureapreparat. Kvalme opptrer hos opptil halvparten av pasientene ved høyeste dosering som tilsvarer 10 µg to ganger daglig, men fører sjelden til at behandlingen må avsluttes. Andre bivirkninger er oppkast, diaré og forsinket ventrikkeltømming. Sjeldne bivirkninger involverer immunologiske og nevrologiske reaksjoner. Exenatide ser ut til å gi lite alvorlige bivirkninger, men langtidsstudier mangler. Medikamentet er kontraindisert ved overfølsomhet overfor virkestoffet. På grunn av begrenset erfaring frarådes bruk ved moderat og alvorlig nyresvikt og ved alvorlig gastrointestinal sykdom. Medikamenter som forsinker gastrisk tømming kan redusere hastigheten på absorpsjonen av oralt administrerte legemidler, slik at legemidler med rask absorpsjon eller smalt terapeutisk vindu kan kreve spesiell oppfølging. Eliminasjonen av exenatide foregår hovedsakelig via proteolytisk nedbrytning og glomerulær filtrasjon.
Sitagliptin (DPP-4-inhibitor) reduserer HbA1c-verdiene tilsvarende eller litt mindre enn exenatide, men påvirker ikke vekten (12, 13). Bivirkningene ser ut til å være få, og medikamentet gir ikke kvalme på samme måte som exenatide. I fase III-studiene er det observert en liten økning i forekomsten av øvre luftveisinfeksjoner (nasofaryngitt) og urinveisinfeksjoner, av usikker betydning (14). Det har vært reist spørsmål om hvorvidt det kan ha sammenheng med en effekt på andre dipeptidylpeptidaser som har viktige roller i lymfocyttene, men foreløpig er mekanismen ukjent. Inntil ytterligere kunnskap foreligger, anbefales forsiktighet hos pasienter som er disponert for slike infeksjoner eller hvor slike infeksjoner kan forventes å ha særlig store konsekvenser. Andre sjeldne eller lettere bivirkninger som er rapportert, er kvalme, magesmerter, diaré, hypoglykemi og anoreksi. Sitagliptin elimineres hovedsakelig uforandret via nyrene, det har få og lite aktive metabolitter og ingen kjente interaksjoner. Også for sitagliptin mangler langtidsstudier med henblikk på bivirkninger og effekter på harde endepunkter (sykelighet og dødelighet). Medikamentet er kontraindisert ved overfølsomhet for virkestoffet, og på grunn av begrenset erfaring frarådes bruk ved moderat eller alvorlig nyresvikt.
Sykdomsmodifiserende effekt?
I prekliniske studier har administrasjon av inkretinmimetika og DPP-4-hemmere ført til økt β-cellevekst og en reduksjon av antall β-celler som går i apoptose (15). I en musemodell oppnådde diabetiske mus med 50 % lavere β-cellemasse enn friske kontrollmus normalisering av β-cellemassen etter behandling med des-fluoro-sitagliptin (16). De diabetiske musene viste også både økt antall insulinsensitive β-celler, økt innhold av insulin i øycellene og forbedret glukosestimulert insulinsekresjon. Hvis tilsvarende effekter finnes hos mennesker, kan det tyde på at DPP4-inhibitorer har et potensial til å hemme sykdomsutviklingen ved type 2-diabetes (15).
Oppsummering
Medikamenter som påvirker inkretinsystemet (GLP-1-analoger og DPP-4-inhibitorer) er en ny klasse antidiabetika som reduserer blodglukosenivået ved type 2-diabetes. Effekten er i samme størrelsesorden som for tradisjonelle perorale antidiabetika, men risikoen for hypoglykemi og vektøkning er lavere enn ved bruk av sulfonylureapreparater. Foreløpig finnes kun korttidsstudier med intermediære endepunkter, og derfor etterlyses langtidsstudier med siktemål å undersøke effekten på diabetiske mikro- og makrovaskulære komplikasjoner. Legemidlene i denne gruppen er betydelig dyrere enn dagens førstevalgsmedikamenter og er foreløping indisert kun som tilleggsbehandling.