Byttelisten (generikalisten) er sammen med trinnpris, refusjonsordningen (blåresept), og maksimalpris de viktigste legemiddelpolitiske styringsverktøyene i Norge. Legemidler som kommer på byttelisten, kan byttes på apotekene. Apotekene kan, med visse unntak, levere ut det rimeligste legemidlet. Når legemidlene er kommet på byttelisten, kan det utløse trinnpris som gir betydelig prisreduksjon. Bytteordningen griper inn i legens praksis og pasientenes rettigheter, men har likevel stor aksept. Nesten alle problemer ved likeverdig bytte er knyttet til etterlevelse og ikke til selve legemidlene. Det er nyttig at norske leger har kjennskap til de vurderinger som ligger bak det arbeid som Statens legemiddelverk gjør for å utvikle byttelisten.
Som en følge av den nye apotekloven ble generisk (likeverdig) bytte innført i 2001 (1, 2). Intensjonen var å få rimeligere legemidler. En forutsetning for likeverdig bytte er at det finnes en liste over legemidler som kan byttes på apotekene. Statens legemiddelverk har ansvaret for byttelisten (tab 1) (3). Siden 2001 er byttelisten blitt betydelig utvidet, både når det gjelder antall legemidler og legemiddelformer (tab 2). Opptak på byttelisten vurderes av en egen faggruppe (Byttegruppen) som består av leger, farmasøyter, jurister og økonomer. Vedlikehold og utvikling av listen krever betydelig tverrfaglig innsats ved Legemiddelverket.
|
Tabell 1 Definisjoner som brukes i arbeidet med byttelisten
|
|
Begrep
|
Definisjon
|
|
Begrenset bytte
|
Enkelte legemidler føres opp på byttelisten med begrenset bytte. Dette innebærer at legemidlene kan byttes på apotek ved oppstart av behandling, men ved senere bytte må ansvarlig forskriver gi tillatelse til bytte
|
|
Bioekvivalente legemidler
|
Legemidler som inneholder samme virkestoff og der opptaket i kroppen er så likt at de anses som like effektive og sikre
|
|
Biotilgjengelighet
|
Totalt opptak av et legemiddel i kroppen
|
|
Bytteliste
|
Offisiell norsk liste over legemidler som anses å være medisinsk likeverdige og som kan byttes på apotekene
|
|
Hjelpestoffer
|
Stoffer som finnes i et ferdig legemiddel i tillegg til virkestoffet. Det er for eksempel bindemidler, fyllstoffer, fargestoffer eller pH-regulerende stoffer
|
|
Markedsføringstillatelse
|
Rett til å markedsføre og selge et godkjent legemiddel i Norge. Markedsføringstillatelse (MT) medfører ikke plikt til å selge legemidlet
|
|
Medisinsk likeverdige legemidler
|
Legemidler som det er trygt å bytte når alle forhold tas i betraktning: Virkning, sykdom, pasientgruppe og risiko for uheldige hendelser ved bytte
|
|
Parallellimport
|
Legemiddel med samme virkestoff og samme opphav, men som importeres via et tredjeland av en uavhengig importør. Parallellimporterte legemidler anses å ha samme virkning som de direkteimporterte legemidlene, selv om det kan være forskjeller i tablettenes utseende og hjelpestoffer
|
|
Terapeutisk vindu
|
Det konsentrasjonsintervall der det er et godt forhold mellom ønsket virkning og uønskede hendelser (bivirkninger) av et legemiddel
|
|
Virkestoff
|
Den kjemiske eller biologiske forbindelsen som gir den medisinske virkningen i et ferdigfremstilt legemiddel
|
|
Tabell 2 Utvikling av byttelisten fra 2001 til 2008
|
|
April 2001
|
Februar 2008
|
|
Antall virkestoffer, inkludert parallellimport
|
63
|
284
|
|
Antall virkestoffer, eksklusiv parallellimport
|
60
|
143
|
|
Virkestoffer, begrenset bytte
|
9
|
5
|
|
Antall pakninger (varenummer)
|
983
|
3 826
|
Bytteliste og trinnpris
Alle legemidler som Legemiddelverket vurderer som medisinsk likeverdige (tab 1), skal føres opp på byttelisten. Medisinsk likeverdighet vurderes ut fra den samlede dokumentasjon som kan omfatte biotilgjengelighet (tab 1), bioekvivalens (tab 1), sykdomstilstand, administrasjonsmåte og/eller pasientgruppe.
Alle reseptbelagte legemiddelpakninger i Norge får fastsatt en maksimalpris av Statens legemiddelverk. Maksimalprisen fastsettes på bakgrunn av internasjonale prissammenlikninger.
Når et nytt legemiddel kommer på markedet, har det patent og/eller konkurransebeskyttelse i minst ti år før konkurrerende legemiddelprodusenter kan produsere og selge det samme virkestoffet. Når flere legemidler med samme virkestoff kommer på markedet, gir det grunnlag for økt konkurranse og prisfall. For å sikre et raskt og effektivt prisfall innførte myndighetene i januar 2005 et nytt prissystem for byttbare legemidler, kalt trinnprismodellen. Formålet var å redusere statens og pasientenes kostnader knyttet til bruk av byttbare legemidler. Trinnprisen er den maksimale prisen som Folketrygden refunderer, eller pasientene må betale, for et legemiddel som inngår i systemet. Trinnprissystemet omfatter (mars 2008) 46 virkestoffer og utvides stadig etter som flere legemidler kommer på byttelisten (4).
Trinnprismodellen er endret flere ganger siden den ble innført i 2005. Prisen reduseres vanligvis med 65 % eller 80 % av tidligere maksimalpris, avhengig av salgsverdi av legemidlet. Prisen for simvastatin er redusert med 85 %.
Prisreduksjoner som følge av trinnprismodellen reduserte utgiftene for Folketrygden og pasienter med om lag 1,4 milliarder kroner i 2007. Koblingen til trinnpris har gjort byttelisten til et av myndighetenes mest sentrale legemiddelpolitiske verktøy.
Hva skal til for at et legemiddel kommer på byttelisten?
Alle legemidler som tas opp på byttelisten, må ha markedsføringstillatelse (tab 1) i Norge. Det faglige grunnlaget for tillatelsen er uten betydning for opptak på byttelisten. Videre kreves det at legemidlet skal ha samme virkestoff (tab 1), effekt og sikkerhet som de legemidlene det kan byttes med samt at de vurderes som medisinsk likeverdige. Legemidlene må ha tilnærmet samme legemiddelform, samme styrke og tilnærmet samme pakningsstørrelse for å være byttbare. Ingen legemiddelformer er i utgangspunktet unntatt fra å komme på byttelisten. Byttegruppen vurderer opptak av stadig flere legemiddelformer på byttelisten (kremer, salver, tabletter med modifisert frisetting, inhalasjonspreparater, injeksjonspreparater med flere). Legemiddelverket tar ikke stilling til patentkonflikter, men følger alle rettsbeslutninger i slike saker. Kriteriene for å velge ut legemidler som skal på byttelisten varierer, men for eksempel er byttelistene i de skandinaviske land temmelig like (5, 6).
Markedsføringstillatelse (tab 1) for et legemiddel gis etter et felles europeisk regelverk, og de fleste legemidler som settes på byttelisten i Norge, er godkjent i ett eller flere andre europeiske land, eventuelt i alle EØS-land. I alle europeiske land som har en ordning med likeverdig bytte, gjøres opptak i bytteordningen på bakgrunn av europeisk godkjennelse av legemidlene.
Effekt
Når to legemidler byttes, må pasienten få den forventede virkning også etter bytte. To legemidler som skal kunne byttes, må ha tilnærmet samme effekt og sikkerhet. Dette dokumenteres ofte gjennom bioekvivalensstudier.
Europeiske retningslinjer beskriver hvordan bioekvivalensstudier skal utføres (7). Vanligvis skjer dette ved at to grupper pasienter får henholdsvis originalpreparat og kopipreparat. Deretter tas det en rekke blodprøver for konsentrasjonsbestemmelser, og de vanligste farmakokinetiske variablene beregnes (fig 1). Minimumskrav for bioekvivalens er at 90 % konfidensintervall for målingene for kopipreparatet skal ligge mellom 0,80 og 1,25 i forhold til originalpreparatets gjennomsnittsverdi (fig 2). Dette betyr at det vil være god overensstemmelse mellom legemidlene for alle relevante målinger. Hvis sammensetningen av originalpreparatet endres, stilles de samme krav til bioekvivalens mellom gammelt og nytt originalpreparat som mellom originalpreparat og kopipreparat. Sammensetningen av originallegemidlene endres ofte i årenes løp uten at det gis noen særskilt informasjon om dette.
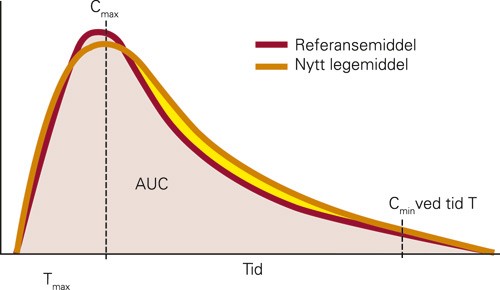
Figur 1 Vanlige målinger ved sammenlikning av bioekvivalens. Tmax, tid til maksimal konsentrasjon; AUC, konsentrasjonstidsforløp, areal under kurven; Cmax, høyeste konsentrasjon; Cmin ved tid T, laveste konsentrasjon ved et bestemt tidspunkt
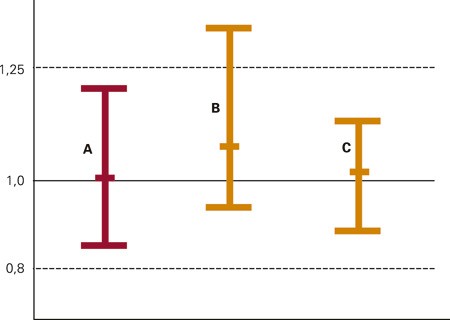
Figur 2 Sammenlikning av AUC, konsentrasjonstidsforløp, areal under kurven, for tre legemidler, gjennomsnitt og spredning er angitt. A er original. Av kopipreparatene har B for stor spredning, mens C har spredning innenfor grensene (0,8 – 1,25)
Bioekvivalensstudier viser at variasjonen som oftest er mindre enn 3 % (8). Slike forskjeller har ingen klinisk betydning og er mye mindre enn den variasjon som er knyttet til hver enkelt pasient. Denne variasjonen kan være opptil 60 % fra dag til dag (9, 10).
I noen tilfeller finnes det ingen originalpreparater å sammenlikne med og ingen bioekvivalensstudier. Ett eksempel er glukosamin som Legemiddelverket har satt på byttelisten ut fra kunnskap om biotilgjengelighet av glukosamin. Det er ikke gjort egne biotilgjengelighetsstudier for noen av glukosaminpreparatene i Norge. Markedsføringstillatelsene bygger på tidligere studier med andre preparater. I slike tilfeller må vurdering av medisinsk likeverdighet og dermed byttbarhet, baseres på sammenlikning av preparatomtalen, dosering, mengde virkestoff, oppløsningshastighet og kunnskaper om opptak av virkestoffet. Dette vil neppe være tilstrekkelig til opptak på byttelisten for legemidler som har smalt terapeutisk vindu (tab 1).
Original- og kopilegemiddel kan noen ganger ha forskjellig bruksområde (indikasjon). Ett av legemidlene kan ha et utvidet bruksområde i forhold til det andre. Slike forhold hindrer ikke opptak på byttelisten. Forskjeller i preparatomtaler og pakningsvedlegg kan være uheldig. Imidlertid vil alle opplysninger som har betydning for trygg bruk av legemidlene være til stede (kontraindikasjoner, forsiktighetsregler, bivirkninger). Alle pakningsvedlegg angir dessuten at legemidler uansett skal brukes slik legen har bestemt.
Forskjellige salter, estere, isomerer eller komplekser av virkestoffene får bare betydning for opptak på byttelisten når det har reell betydning for effekt eller sikkerhet. Dette er i tråd med de europeiske retningslinjene for godkjenning av generiske legemidler.
Byttbare legemidler skal normalt ha samme farmasøytiske form. Det vil si at hurtigoppløselige tabletter kan byttes med tilsvarende tabletter, men ikke med tabletter med modifisert frisetting. Det gjøres stadig endringer av både original og kopipreparater. Noen ganger gir endringene bedre klinisk effekt. «Produktforfininger» som ikke har klinisk betydning, hindrer ikke opptak på byttelisten.
Sikkerhet
Ved likeverdig bytte kan det oppstå to problemer: Endret effekt og bivirkninger knyttet til selve legemidlet og etterlevelsesproblemer knyttet til bytte av legemiddel. Problemer knyttet til legemidlene trekkes ofte frem i debatten. Det hevdes at hjelpestoffene (tab 1) kan gi allergiske reaksjoner og andre uønskede reaksjoner og at det kan være forskjeller i effekt. Det er sparsomt med dokumentasjon for at slike problemer virkelig oppstår, selv om en betydelig andel av pasientene er skeptiske til bytte og angir at de har negative erfaringer (11, 12). Psykologiske faktorer kan spille inn når pasientene rapporterer negative effekter (13). Pasientene aksepterer bytte som et nyttig tiltak (14). Forskjeller i hjelpestoffene har normalt ikke betydning for opptak på byttelisten. Hvis en pasient er allergisk mot for eksempel et fargestoff, kan legen reservere pasienten mot bytte eller angi det allergifremkallende stoffet på resepten. Legemiddelverket har gjennomgått over 400 meldinger om bivirkninger etter bytte uten å finne noen alvorlige bivirkninger som skyldes legemidlene i seg selv.
Ved bytte kan det oppstå problemer med etterlevelse. Pasienten kan ta dobbelt dose eller han kan slutte å ta et legemiddel. Det blir hevdet at enkelte pasientgrupper ikke bør bytte legemidler, for eksempel psykiatriske pasienter. Slike problemer blir det vanligvis ikke tatt hensyn til ved opptak på byttelisten. Det er legens ansvar å reservere pasienten mot bytte dersom legen mener det foreligger en holdbar medisinsk begrunnelse for reservasjon. Lege og apotek har sammen ansvar for å gi tilstrekkelig informasjon til pasientene om bytteordningen. Ifølge data Legemiddelverket har innhentet, ligger andelen legereservasjoner gjennomsnittlig på om lag 5 %, men er betydelig høyere for enkelte legemidler.
Begrenset bytte (tab 1) ble innført da bytteordningen ble startet i 2001 og gjelder legemidler til spesielt sårbare pasienter og legemidler med smalt terapeutisk vindu. Legemidler ved epilepsi og organtransplantasjon får begrenset bytte når de tas opp på byttelisten. Legemidler med begrenset bytte kan eventuelt bli fullt byttbare etter hvert. Av de ni virkestoffene som fikk begrenset bytte i 2001, er de fleste blitt overført til fullt bytte etter at kliniske eksperter og pasientorganisasjonene ble rådspurt (15). Problemet med begrenset bytte er at det ikke utløser trinnpris. Etter den pågående revisjon av blåreseptordningen vil det være mulig å skille mellom ulike bruksområder når det gjelder fullt eller begrenset bytte.
Dokumentasjonsgrunnlag
Legemiddelverket er blitt kritisert for ikke å offentliggjøre bioekvivalensstudier. Særlig er dette blitt debattert i forbindelse med godkjennelsen av likeverdige alendronatpreparater. Etter gjeldende regler og praksis oppfattes slike studier som forretningshemmeligheter. Legemiddelverket har ingen motforestillinger mot å offentliggjøre slike studier dersom firmaene tillater det. Erfaringsmessig sier de fleste legemiddelfirmaer nei til offentliggjøring av kliniske studier. Et nytt tiltak fra myndighetenes side er at det utarbeides en offentlig utredningsrapport (public assessment report) for alle nye legemidler. I en slik rapport vil resultatene av bioekvivalensstudiene bli gjengitt.
Oppsummering
Legemidler blir ført opp på byttelisten etter en grundig faglig prosess. Stadig flere legemidler tas opp på byttelisten, og dette medfører at flere legemidler får trinnpris. Trinnpris medfører at det frigjøres betydelige summer til andre oppgaver i samfunnet. Det er en viktig oppgave for forskrivere og apotek at intensjonene bak bytteliste og trinnpris følges opp. Legemidlene som er ført opp på byttelisten, er effekt- og sikkerhetsmessig like gode som originallegemidlene. Innsatsen må rettes mot å gjøre selve byttet av legemidler trygt for pasientene.