Svimmelhet, kvalme og flimring for øynene er symptomer som kan indikere tromboembolisk sykdom. Denne kasuistikken understreker betydningen av grundig anamnese og kunnskap om ulike etiologiske mekanismer.
En 40 år gammel kvinne oppsøkte fastlegen etter en episode med akutt vertigo, flimring for øynene og etterfølgende oppkast.
Dette er kjente og hyppige problemstillinger, og de diagnostiske overveielser går raskt i retning av vaskulære, nevrologiske og trykksymptomgivende årsaker, som krever rask avklaring.
Kvinnen fikk flere slike anfall samme år. Det ble i utredningen reist spørsmål om demyeliniserende sykdom i form av multippel sklerose eller epilepsi, men dette ble avkreftet.
Fem år senere fikk hun nedsatt førlighet i høyre sides ekstremiteter, sentral facialisparese, nedsatt tempo i høyre arm og patologisk koordinasjon i venstre. Cerebral MR viste multiple lesjoner i begge cerebrale hemisfærer, hovedsakelig lokalisert subkortikalt. Hun fikk et nytt anfall senere samme år, da hun ble paralytisk i høyre arm. Cerebral CT viste da at enkelte av lesjonene var blitt større, at det muligens var tilkommet nye, og at lesjonene bredte seg ut også kortikalt. Det var anført at dette ikke var typiske multippel sklerose-lesjoner, derimot ble vaskulitt overveid som årsak. Man startet på dette tidspunktet behandling med warfarin, og intermitterende vertigo, kvalme og brekninger forsvant. Kvinnen trente seg gradvis opp og fikk muskelkraften og førligheten tilbake. Imidlertid hadde hun sekvele i form av nedsatt koordinasjon i høyre overekstremitet.
Under pågående warfarinbehandling (INR-verdi i terapeutisk område rundt 2,5) ble hun fire år senere hoven og blå i høyre fot. Hun ble da innlagt i revmatologisk avdeling. Der ble det reist spørsmål om systemisk vaskulitt, noe som senere ble avkreftet. To måneder etter det ble imidlertid høyre underekstremitet mer og mer hoven og misfarget. Ultralydundersøkelse viste utbredt trombosering, men åpen lårvene. Det ble i tillegg gjort lungescintigrafi, med funn forenlig med nyoppstått lungeemboli i venstre underlapp. INR-verdien var også på dette tidspunkt i terapeutisk område.
Hos pasienter som får venøse tromboemboliske episoder under pågående warfarinbehandling og har INR-verdier i terapeutisk område, velger man ofte å gå over til å behandle med lavmolekylært heparin. Rasjonalet for dette er at hos noen få kan warfarinbehandlingen være vanskelig å styre – den tromboemboliske episoden kan således ha oppstått i et tidsintervall hvor INR-verdien har ligget under det terapeutiske nivå (2,0 – 3,0). Lavmolekylært heparin har i en rekke randomiserte studier vist seg å være minst like effektivt som warfarin for å hindre nye tromboemboliske episoder og er bedre enn warfarin til pasienter med kreftsykdom (1).
Kvinnen fikk etter dette endret medisineringen til lavmolekylært heparin. Det var ingen nye tromboemboliske episoder.
Ved omfattende utredning ble det ikke funnet indikasjoner på revmatologisk sykdom eller trombofili. CT caput med angiografi viste infarktsekveler uten vaskulittforandringer. Angiografisk CT av halskar og aorta med avgangskar samt MR-angiografi av bekkenkar ga heller ingen indikasjon på vaskulittforandringer. Ved hjerteundersøkelse med ekkodoppler samt MR var det upåfallende forhold.
Pasienten hadde hatt tromboemboliske episoder på både arterie- og venesiden. Det var viktig å få avklart om det forelå hjertesykdom hvor en venøs trombe kunne passere direkte over på arteriesiden på grunn av en anomali.
Undersøkelser av spinalvæske, hudbiopsi og beinmargsbiopsi var normale.
Spesielt tenkte man her på muligheten for eventell borreliasykdom som årsak til hennes initiale nevrologiske symptomer. Hudbiopsien ble også undersøkt med tanke på vaskulitt. Imidlertid hadde pasienten aldri på noe tidspunkt hatt noen hudforandringer.
Nevrologisk undersøkelse viste temposvikt i høyre hånd, uten sikre nevrologiske funn for øvrig.
På mistanke om trombocytopati ble det utført blodplateundersøkelser med aggregometri samt væskestrømscytometri. Aggregometri (fig 1) viste at pasienten hadde hyperaggregerbare blodplater, stimulert med subliminale konsentrasjoner av adenosindifosfat (ADP) og adrenalin, sammenliknet med blodplater fra en frisk kontrollperson. Videre fant man tegn til økt aktivering ved bruk av væskestrømscytometri, som viste økt ekspresjon av CD62P på trombocyttoverflaten (fig 2) samt økt mengde mikropartikler etter stimulering med subliminale konsentrasjoner av ADP og adrenalin sammenliknet med kontrollblodplater. Det ble ikke funnet tegn til økt aktivering av ustimulerte blodplater eller økt andel mikropartikler i plasma. For sekresjonsproduktet β-tromboglobulin, tegn på at blodplater har undergått aktivering, var det ingen tendens til økte nivåer i ustimulerte prøver.
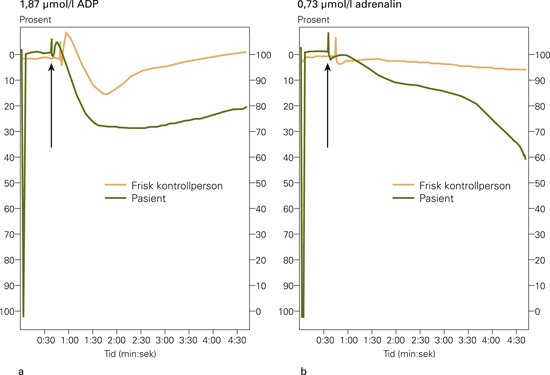
Figur 1 Stimulering av platerikt plasma med a) lavdose adenosindifosfat (ADP) (1,87 µmol/l) respektive b) adrenalin (0,73 µmol/l) induserer aggregering i pasientprøven. Tidspunkt for tilsetning av blodplateagonist er markert med pil
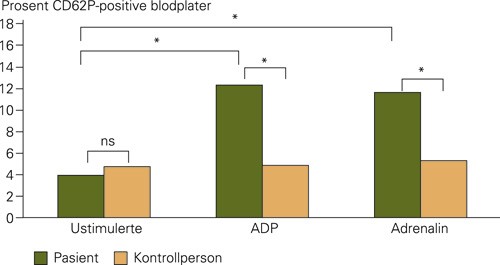
Figur 2 Væskestrømscytometrisk bestemmelse av CD62P (P-selektin) på overflaten av blodplater. Ustimulerte blodplater viser lavt nivå av CD62P hos både pasient og frisk kontrollperson. Pasientens blodplater har signifikant mer CD62P etter stimulering med lav konsentrasjon av adenosindifosfat (1,87 µmol/l) respektive adrenalin (0,73 µmol/l). * p < 0,05
Diskusjon
Blodplatene spiller en vestlig rolle i hemostase, trombose og aterosklerose. Hos denne pasienten var det holdepunkter for å tro at hyperaggregerbare blodplater kunne være en sentral årsaksfaktor bak de tromboemboliske hendelsene. Både ved ervervede og arvelige tilstander finner man hyperaggregerbare blodplater.
Ved ervervede tilstander skyldes dette vaskulær eller endotelial dysfunksjon, noe man ser ved koronar hjertesykdom, diabetes mellitus, nefrotisk syndrom, cystisk fibrose, aterosklerose og vaskulitt. Hos slike pasienter finner man forhøyede verdier i plasma av PF4 (platefaktor 4), β-TG (β-tromboglobulin) og TxA₂ (tromboksan A₂) som tegn på in vivo-aktivering. Dette korrelerer godt med væskestrømscytometri, hvor man finner tilstedeværelse av aktiveringsmarkører på blodplateoverflaten ex vivo.
«Sticky platelet syndrome» (SPS) er en arvelig tilstand med hyperaggregerbare blodplater (2, 3). Den er assosiert med arterielle og venøse tromboemboliske hendelser, og det er funnet autosomalt dominant arvegang. Ved nærmere gjennomgang av pasientens historie fant man at det hadde vært tromboemboliske episoder hos flere førstegradsslektinger, i form av hjerneslag i relativt ung alder.
Blodplatene hos pasienter med syndromet stimuleres in vitro med subliminale konsentrasjoner av ADP og/eller adrenalin. Avhengig av respons på aktiveringsinitiator subklassifiseres tilstanden som type 1 (både ADP og adrenalin), type 2 (kun adrenalin) og type 3 (kun ADP). Kvinnen viste seg å være en type 1-pasient. Inndelingen kan imidlertid diskuteres, da stimulering via adrenalin sannsynligvis krever en tilleggsagonist, f.eks. ADP, som enten kan foreligge ekstracellulært eller fremkomme som frisetting etter at det er tilsatt adrenalin.
Klinisk presenterer pasientene seg ofte med akutte koronare hendelser, TIA-/slagliknende episoder, retinatromboser, perifere arterielle tromboser og venøs trombose/tromboembolisme. Mange er tilsynelatende adekvat behandlet med perorale antikoagulanter, vurdert på bakgrunn av at de har INR-verdier i terapeutisk område. Blodplatene kan aktiveres av fysiologiske agonister som trombin, ADP og adrenalin, samt ved store skjærekrefter (f.eks. i trange aterosklerotiske kar). Ved aggregometri studeres blodplatenes evne til aggregasjon som respons på den tilsatte agonist. Blodplater inneholder α-granula, og ved aktivering fusjonerer deler av α-granulamembranen med blodplatens plasmamembran. Dette resulterer i at granulainnholdet (f.eks. β-TG og PF4) tømmes ut ekstracellulært og at CD62P fra α-granulamembranen blir en del av blodplatens overflate. Måling av CD62P på blodplateoverflaten (væskestrømscytometri) og β-TG (β-tromboglobulin) eller PF4 (platefaktor 4) (ELISA) gir således en indikasjon på aktiveringsgrad.
Normale nivåer av PF4 og β-TG i plasma tyder på at blodplatene ikke er aktiverte in vivo under normale forhold, men blir hyperaggregerbare ved utslipp av ADP eller ved adrenalinpåvirkning. Den eksakte etiologi ved denne tilstanden er til nå ikke helt klarlagt, men mye taler for at den er assosiert til overflatemolekyler i blodplatemembranen og påfølgende aktivering av intracellulære signalveier. Blant annet er det rapportert økt forekomst av hendelser i forbindelse med emosjonelt stress (2). I en studie med 153 pasienter fant man at 21 % av dem med arterielle tromboembolier og 13 % av dem med venøse tromber hadde «sticky platelet syndrome» (4). Av 195 pasienter med både arterielle og venøse tromboser hadde 28 % syndromet. Til sammenlikning fant man i at 15 % hadde aktivert protein C-resistens (APC-resistens) (5).
Diagnostikken av «sticky platelet syndrome» baseres i dag på ferskt citratblod med aggregometriundersøkelser og på væskestrømscytometri, hvor man benytter en rekke fortynninger av ADP samt adrenalin. Hos pasienter med hyperaggregerbare blodplater vil man da få aggregasjon med subliminale konsentrasjoner, som også kan påvises ved hjelp av væskestrømscytometri.
Acetylsalisylsyrebehandling – 75 mg daglig – har vist seg å ha meget god effekt ved denne tilstanden. Symptomene forsvinner. Ved aggregasjonsstudier ser man en normalisering av blodplatenes hyperaggregabilitet. Behandlingen er således svært lik den som gis til pasienter med ervervet tilstand av hyperaggregerbare blodplater, der tilstanden skyldes vaskulær eller endotelial dysfunksjon.
Denne kasuistikken viser at vanlige og initiale diffuse symptomer som akutt vertigo, flimring for øynene og oppkast kan forklares ut fra hypersensitive blodplater. Rask utredning og hurtig igangsetting av behandling er svært viktig for å unngå senskader og nye episoder. Acetylsalisylsyre er et veletablert og effektivt medikament mot blodplateinitierte arterielle tromber, også ved tilstander hvor man ikke finner holdepunkter for at det kan skyldes «sticky platelet syndrome». Det er derfor ikke grunnlag for rutinemessig blodplatefunksjonsstudier hos trombosepasienter. Imidlertid kan slike undersøkelser være et viktig diagnostisk supplement hos pasienter med kompleks tromboembolisk sykehistorie. I familier hvor det i anamnesen fremkommer en klar opphopning er det også aktuelt å undersøke førstegradsslektninger, da forebyggende behandling i relativt ung alder kan bli aktuelt.