Polyfarmasi er hverdagen for dagens hjertesviktpasienter. Mange legemidler som er aktuelle ved hjertesvikt, blir metabolisert via cytokrom P-450 (CYP)-enzymer. Dette er en gruppe enzymer der genetisk polymorfisme kan lede til store individuelle forskjeller i omsetningsevne.
En 60 år gammel mann født i Kashmir ble lagt inn på Ullevål universitetssykehus med et akutt fremreveggs hjerteinfarkt (STEMI). Fra tidligere hadde han kjent diabetes type 2 og hyperkolesterolemi. Tid fra symptomer til koronar angiografi var ca. 150 minutter. Det ble påvist okkludert proksimal venstre kransåre (LAD) som ble vellykket stentet. Pasienten utviklet postinfarkt hjertesvikt med redusert funksjon av venstre ventrikkel, tilnærmet akinetisk fremre vegg og ejeksjonsfraksjon på 30 – 35 %. Etter akuttbehandling og oppfølging ble han skrevet ut med simvastatin 40 mg daglig, metoprolol 25 mg daglig, ramipril 5 mg daglig, klopidogrel 75 mg daglig, acetylsalisylsyre 75 mg daglig og glimepirid 4 mg daglig. Han er senere blitt fulgt opp ved hjertesviktpoliklinikken ved Lovisenberg Diakonale Sykehus der han ved en kontroll en måned etter innleggelsen klaget over plagsom tørrhoste. Dette ble assosiert til ramipril, som ble seponert og erstattet med losartan 50 mg daglig.
Tørrhoste er en bivirkning som rammer rundt 10 % av pasientene som behandles med ramipril og andre ACE-hemmere (1). Mekanismen bak tørrhosten er akkumulering av bradykinin, et stoff som også brytes ned av angiotensin I-konverterende enzym (ACE). Ved bruk av ACE-hemmere får man både redusert aktivering av angiotensin I til angiotensin II og redusert inaktivering av bradykinin.
Angiotensin II-reseptorantagonister virker direkte ved å blokkere reseptorbinding av angiotensin II, og interfererer ikke med metabolismen av bradykinin. Dette er forklaringen på at angiotensin II-reseptorantagonister ikke har tørrhoste som bivirkning. I behandling av hjertesvikt er bruk av angiotensin II-reseptorantagonist indisert ved blant annet intoleranse av ACE-hemmer. Losartan ble valgt som erstatter for ramipril i dette tilfellet, men det er flere angiotensin II-reseptorantagonister som har indikasjonen hjertesvikt.
I forbindelse med en kontroll fem uker etter skifte til losartan ble det fattet mistanke om forverring av hjertesvikten ved arbeids-EKG. Testen måtte avsluttes på grunn av dyspné og utmattelse. Det ble gjort ekkokardiografi som viste høyresidig pleuravæske og trombe i venstre ventrikkel, men ingen målbar reduksjon i ejeksjonsfraksjon. Videre viste røntgen thorax samme sviktforandringer i form av økende hilumkarskygger og basolateral væskeansamling på høyre side opp mot interlobariet. Pasienten ble innlagt for å starte med warfarinbehandling og for intravenøs avvanning med furosemid. Doseringen av warfarin ble igangsatt etter standard protokoll med tre tabletter/7,5 mg første og andre dag. Allerede på dag 2 av behandlingen var INR-verdien 3,1 (terapeutisk område 2,0 – 3,0). INR-verdien fortsatte å ligge over terapeutisk område og ble på dag 9 målt til 4,9 uten at det var gitt ny dose (fig 1). Ved neste måling på dag 13 hadde INR-verdien sunket noe til 4,0, og en ny warfarindose på to tabletter ble først gitt fire dager senere.
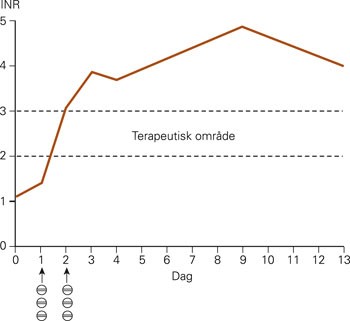
Figur 1 INR-målinger etter start av warfarinbehandling (tre tabletter/7,5 mg på dag 1 og 2)
Selv om det ikke ble påvist målbar endring i ejeksjonsfraksjon, viste kliniske symptomer og undersøkelser klare tegn på forverring av hjertesvikten. Forverringen ble ikke assosiert til bytte fra ramipril til losartan, men vurdert som en naturlig progrediering av sykdommen. Et velkjent klinisk fenomen ved bruk av warfarin er stor individuell variasjon i dosebehov for å oppnå terapeutisk INR-verdi Det er imidlertid sjelden at pasienter får en forhøyet INR-verdi som vedvarer mer enn ti dager etter de to første dosene. Det er umulig å si hvor høy INR-verdien kan ha vært, men pasientens INR-verdi sank fra 4,9 til 4,0 mellom dag 9 og dag 13 av warfarinbehandlingen. Den vedvarende høye INR-verdien kan indikere en vesentlig lengre halveringstid av warfarin enn normalt (1 – 2 døgn (2)). Dette er beskrevet hos warfarinpasienter med mutasjoner i genet som koder for enzymet CYP2C9 (3).
På bakgrunn av en vedvarende høy INR-verdi etter startdoseringen ble det mistenkt at pasienten hadde genetisk betinget langsom metabolisme av warfarin. For å finne ut om det var dette eller eventuelt andre forhold som lå til grunn for høy INR-verdi, ble det rekvirert en farmakogenetisk analyse av cytokrom P-450 (CYP)-mutasjoner. En blodprøve ble sendt til Psykofarmakologisk avdeling, Diakonhjemmet Sykehus, der analysen ble gjennomført. Analysen viste at pasienten var homozygot bærer av mutasjoner i både CYP2C9 og CYP2D6, henholdsvis mutasjon 1075A>C (allelbetegnelse CYP2C9*3) og mutasjon 1846G>A (allelbetegnelse CYP2D6*4). Før prøvesvaret forelå, hadde pasienten igjen vært innlagt på grunn av dyspné, brystsmerter og lungestuving.
Hyppighet av CYP-mutasjoner er ikke beskrevet i befolkningen i Kashmir, men blant hvite personer har CYP2C9*3 en allelfrekvens på rundt 7 % og CYP2D6*4 en allelfrekvens på rundt 20 % (4). Sammenliknet med villtypen koder CYP2C9*3 og CYP2D6*4 for sterkt redusert metabolismeaktivitet (< 5 % av normalt). Pasienten viste seg å være homozygot for begge allelene, noe som betyr at han i prinsippet er en langsom omsetter via både CYP2C9 og CYP2D6. Langsom omsetning via CYP2C9 forklarte den vedvarende høye INR-verdien etter startdoseringen av warfarin. I prøvesvaret ble det gjort oppmerksom på at også losartan og glimepirid ville bli påvirket av langsom CYP2C9-metabolisme, mens metoprololnivået på sin side ville bli påvirket av langsom CYP2D6-metabolisme. For losartans vedkommende ble det påpekt at redusert CYP2C9-metabolisme trolig innebærer manglende angiotensin II-blokade, siden substansen blir omdannet til en 10 – 40 ganger mer aktiv metabolitt via CYP2C9 (5). Det ble derfor anbefalt å bytte ut losartan med en alternativ angiotensin II-reseptorantagonist.
Basert på prøvesvaret fra den farmakogenetiske CYP-analysen ble forverringen av hjertesvikt etter bytte fra ACE-hemmer til losartan assosiert til pasientens manglende evne til å danne aktiv metabolitt av losartan. Det ble derfor besluttet å skifte ut losartan med en angiotensin II-reseptorantagonist som ikke blir metabolisert av CYP2C9 i betydelig grad. Valget falt på valsartan, som ble titrert opp fra 40 mg daglig til måldosen på 160 mg daglig.
Pasienten følges fortsatt tett opp på hjertesviktpoliklinikken. Det har ikke vært nye innleggelser eller hendelser med dyspné/lungestuving etter bytte av angiotensin II-reseptorantagonist. Ved kontroll tre måneder etter byttet var ejeksjonsfraksjonen forbedret til ca. 45 %. Pasienten føler seg nå mindre kortpustet enn tidligere og er i stand til å gå opp 2 – 3 etasjer uten å måtte legge inn pause. Blodtrykk, puls og fastende blodsukker ligger henholdsvis rundt 110/75 mm Hg, 70 slag/min og 6 mmol/l. Han behandles fortsatt med warfarin, og INR-verdien ligger stabilt i området 2 – 2,5 med en ukentlig dosering på 1,5 – 2,5 tabletter.
Diskusjon
Enzymer innen CYP-familien står sentralt i omsetning av mange legemidler. Disse enzymene utviser store individuelle forskjeller i fenotype. Dette kan være relatert til genetiske forhold, sykdomstilstander og inntak av enzymhemmere/indusere. Genetisk betingede forskjeller er typisk for CYP2C9, CYP2C19 og CYP2D6, der medfødte mutasjoner som oftest medfører redusert eller defekt metabolisme (6).
Pasienten viste seg å være homozygot bærer av mutasjoner som koder for langsom metabolisme via CYP2C9 og CYP2D6. Fire av de forskrevne legemidlene metaboliseres i stor grad av CYP2C9 (warfarin, losartan og glimepirid) eller CYP2D6 (metoprolol) (4). Losartan er i prinsippet et prodrug og blir aktivert via det aktuelle enzymet, mens de tre andre administreres i farmakologisk aktiv form og blir inaktivert (fig 2). Klinisk betyr det at pasienten hadde redusert danning av aktiv losartanmetabolitt (trolig mindre enn 10 % av normalt), og dermed utilstrekkelig angiotensin II-blokade (5). For warfarin, glimepirid og metoprolol innebærer langsom metabolisme på sin side høy konsentrasjon i forhold til administrert dose (ca. 5 – 10 ganger høyere enn normalt), og dermed økt bivirkningsrisiko (4). Warfarin er et legemiddel med smalt terapeutisk vindu og økt blødningsrisiko ved forhøyede INR-verdier, men det ble ikke observert tegn på blødning hos pasienten.
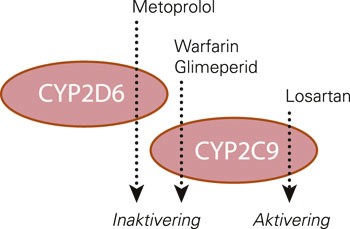
Figur 2 Skjematisk fremstilling av CYP-metabolismen som var sterkt redusert hos vår pasient
Utilstrekkelig angiotensin II-blokade av losartan på grunn av langsom metabolisme sammenfaller med forverringen av hjertesvikten som ble observert ved kontroll fem uker etter bytte fra ACE-hemmeren ramipril. På samme kontroll ble det også observert en trombe i venstre ventrikkel. Det kan ikke utelukkes at forverringen av hjertesvikten var et resultat av tromben, men vi vurderer manglende angiotensin II-blokade etter bytte til losartan som en mer sannsynlig årsak. I så fall kan man spekulere på om manglende effekt av losartan også forårsaket tromben og dermed behovet for warfarinbehandling.
Bakgrunnen for å rekvirere den farmakogenetiske CYP-analysen var den vedvarende høye INR-verdien etter startdosene av warfarin. Prøvesvaret bekreftet at høy INR-verdi skyldtes genetisk langsom metabolisme av warfarin og ikke andre omkringliggende faktorer, som for eksempel dårlig etterlevelse eller interaksjon med andre legemidler, kosthold eller naturmidler. Avklaringen bidro til trygghet rundt situasjonen, ikke minst for pasienten selv, og ga grunnlag for videre behandling med warfarin under forutsetning av spesiell forsiktighet ved doseendringer, annen behandling eller kosthold. I tillegg ga prøvesvaret økt klinisk forståelse av de andre legemidlene som pasienten ble behandlet med. Losartan ble erstattet med en annen angiotensin II-reseptorantagonist, mens lav tolererbar metoprololdose fremsto som rasjonell.
CYP-mutasjoner er stabile gjennom livet. Informasjonen fra den farmakogenetiske analysen har derfor prospektiv verdi ved valg av eventuell ny legemiddelbehandling. Komorbiditet ved hjertesvikt er vanlig, og det er rimelig å anta at informasjonen senere kan komme til nytte hos vår pasient. Det er imidlertid utfordringer knyttet til informasjonsflyt og kunnskap om klinisk bruk av farmakogenetiske analysesvar i helsevesenet. Poliklinisk oppfølging av pasientene kan bidra til å løse disse utfordringene gjennom kontinuerlige helhetsvurderinger av pasientens tilstand og legemiddelbruk.
Farmakogenetikk var tema i Tidsskriftet nr. 18/2006, og det ble der satt søkelys på individtilpasset behandling som fremtidsvisjon. Farmakogenetisk CYP-testing utføres i dag som rutineanalyser på flere norske laboratorier, og er et verktøy for rasjonelt valg av legemiddel og dose til den enkelte pasient. Det foregår imidlertid en debatt rundt kostnad-nytte-verdi av CYP-testing, og et kjernespørsmål er hvilken utstrekning testingen bør ha. Spørsmål som omfatter helseprioriteringer er kompliserte og vanskelige, men det er interessant at enkelte sykehus i Danmark har innført rutinemessig CYP-testing av alle nye pasienter som legges inn (7, 8). Dette gjøres ut fra tanken om at investering i denne engangstesten vil lønne seg på lengre sikt i form av mindre bivirkninger, mindre behov for oppfølging, bedre behandlingseffekt og færre innleggelser. En forutsetning for å realisere en potensiell nytteverdi er konkrete anbefalninger for valg av legemiddel og startdose hos pasienter med genetisk ulik metabolisme (9).
Farmakogenetisk CYP-testing består av om lag ti separate mutasjonsanalyser, og den samlede kostnaden basert på dagens takster tilsvarer kostnaden av tre måneders forbruk av losartan. I vårt tilfelle var behandlingen med losartan etter all sannsynlighet ineffektiv, noe som kan ha forårsaket ekstra innleggelser og behandlingsbehov. Dette illustrerer at en engangsinvestering til CYP-testing kan lønne seg økonomisk og helsemessig hos enkeltpasienter, men det er samtidig behov for forskning som kan evaluere nytteverdien i større målestokk (10).