Ikke før i midten av 1960-årene kom det første antivirale midlet amantadin på markedet som profylakse mot influensa. Utvikling av nye medikamenter mot virusinfeksjoner har gått saktere enn for antibakterielle midler, og antallet godkjente preparater har vært få. De siste tiårene har det imidlertid vært en økning i antallet antivirale medikamenter på markedet, da tall fra FDA viser at 0,4 midler ble godkjent årlig i 1980-årene mot 1,9 i 1990-årene (1). En viktig faktor i denne prosessen har vært infeksjon med humant immunsviktvirus (hiv). Et utvalg av medisiner for å holde hivinfeksjonen i sjakk har endret denne sykdommen fra å være dødelig til å bli en kronisk infeksjon (2).
Stadig flere virusinfeksjoner behandles med antivirale midler, og de fleste medikamentene på markedet i dag er i hovedsak rettet mot infeksjoner med virus som hiv, hepatittvirus og herpesvirus (3). Dette er kroniske eller latente virusinfeksjoner, der virus er vanskelig å utrydde. Ved å undersøke for virusresistens kan man ved behandlingssvikt seponere medikamenter eller endre regimet slik at det skreddersys for den enkelte pasient. Problemet er imidlertid at resistens opptrer i økende grad, spesielt ved langvarig behandling. Overvåking vil være et viktig verktøy for å ha oversikt over forekomst av resistens, som grunnlag for empirisk valg av behandling, og for å følge spredning av resistente stammer i befolkningen.
I artikkelen omtaler vi utvalgte virusinfeksjoner som det finnes antiviral behandling for og beskriver virusresistens med vekt på praktiske forhold ved diagnostikk og klinikk.
Materiale og metode
Artikkelen er basert på ikke-systematisk søk i litteraturen og en gjennomgang av denne, europeiske og amerikanske anbefalinger, i tillegg til egne erfaringer som nasjonalt referanselaboratorium blant annet for influensa og hepatittdiagnostikk.
En 32 år gammel kvinne av asiatisk herkomst ble henvist med spørsmål om kronisk hepatitt B. Det ble påvist HBsAg (hepatitt B-overflateantigen), HBeAg (hepatitt B e-antigen) og HBV-DNA (hepatitt B-virus-deoksyribonukleinsyre). Behandling med lamivudin ble startet med påfølgende fall i virusmengde (fig 1). Etter to år kunne det påvises økt virusmengde med HBV-DNA-PCR (polymerasekjedereaksjon) til 20 millioner internasjonaleenheter (IU)/ml. Pasienten hadde denne tiden brukt samme antivirale behandling. På mistanke om at denne forverringen kunne skyldes at det hadde oppstått resistente virus, ble det foretatt resistensundersøkelse. Ved genteknologisk analyse ble det påvist lamivudinresistent hepatitt B-virus (YIDD). Det ble startet behandling med pegylert interferon med respons i form av fall i virusmengde og en kort periode er HBV-DNA negativ. På grunn av graviditet ble antiviral behandling deretter seponert, og virusmengden økte igjen betydelig (160 millioner IU/ml). Imidlertid viste siste kontroll at HBV-DNA var falt til 2 000 IU/ml, fortsatt uten pågående behandling.
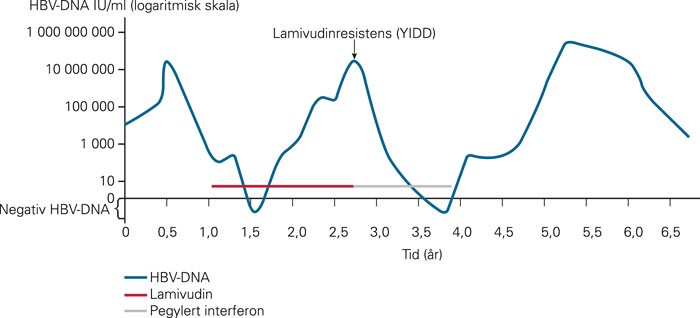
Figur 1 Variasjon over tid av HBV-DNA hos pasient med kronisk hepatitt B (kasuistikk) under antiviral behandling. YIDD = lamivudinresistent hepatitt B-virus
Virusinfeksjoner
Virusinfeksjoner kan variere mye både når det gjelder alvorlighetsgrad og forløp. Ofte forløper de asymptomatisk. Noen virus gir akutt infeksjon med ulik grad av alvorlighet, mens andre virus kan gi en kronisk infeksjon eller forbli latente i verten. Både virusegenskaper og vertsfaktorer har stor betydning for infeksjonsforløpet. Virus som kan etablere seg latent i infiserte celler for livstid, er blant annet virus tilhørende herpesfamilien. Slike virus kan reaktiveres av ulike årsaker for eksempel bruk av cytostatika eller annen immunsupprimerende behandling og gi kliniske tilbakefall (4). Etableringen av latens skjer antakelig så tidlig under en primærinfeksjon at det er lite sannsynlig at man kan få hindret dette ved antiviral terapi. Ved herpesinfeksjon der antiviral behandling er vellykket klinisk, vil allikevel virus persistere og kan reaktiveres senere (5). Mangel på egnede modellsystemer for studier av virus har ført til at det fortsatt er mange ukjente patogenetiske egenskaper og genetiske funksjoner hos virus, hvilket vanskeliggjør målrettet behandling. Virus er intracellulære mikroorganismer, derfor er det en utfordring å utvikle midler som virker mot viruset isolert uten å være toksisk for pasienten. En del antivirale midler, som har vært utviklet de siste tiårene, har vist seg å være celletoksiske (4).
Antiviral behandling
Det har skjedd en enorm utvikling innen behandling av virusinfeksjoner med en rekke nye medikamenter. Per i dag er rundt 30 direktevirkende antivirale midler godkjent for det norske markedet (ramme 1). De fleste antivirale medikamenter som er utviklet siste tiåret har i hovedsak vært for behandling av hivinfeksjon, men også mot infeksjoner med herpesvirus, hepatittvirus og luftveisvirus (3). Med det utvalg av medikamentalternativer som nå finnes mot hiv, er det mulig å skreddersy behandlingen for den enkelte pasient. Dette innebærer at man nøye følger utviklingen og effekten av behandlingen hos den enkelte pasient over år for å finne frem til det regimet som til enhver tid vil gi pasienten best effekt.
Ramme 1
Antiviral behandling
-
Rundt 30 medikamenter er registrert i Norge
-
Brukes primært ved kroniske infeksjoner
-
Kan skreddersys ut ifra effekten hos pasienten
-
Kan føre til utvikling av resistens
-
Behandlingssvikt kan ha flere årsaker
De fleste antivirale medikamenter er rettet mot kroniske infeksjoner. Disse har ofte lange behandlingsperioder med mulighet for å måle virusmengden i blod som indikator på behandlingseffekt (6). I dag kan man teste om virus er resistent overfor et medikamentalternativ både før og under behandling, slik at man kan velge medikamenter som har sikker effekt og derved unngå å utsette pasienten for virkningsløs behandling med eventuell påføring av bivirkninger.
Hiv
I slutten av 1980-årene ble det gitt monoterapi med zidovudin mot HIV-1, men behandlingen klarte ikke helt å undertrykke virus og det utviklet seg raskt resistente virus med behandlingssvikt som resultat (7). Fra midten av 1990-årene startet man med effektiv antiretroviral kombinasjonsbehandling som førte til en betydelig reduksjon i virusmengden og bedret livsprognose for hivpasientene. Behandling med samtidig bruk av tre til fire ulike midler rettet mot ulike angrepspunkter hos virus gir lavere risiko for resistensutvikling. Imidlertid har hiv en høy mutasjonsrate, og resistens vil derfor fortsatt være et problem, selv med nyere antivirale medikamenter i kombinasjon.
Hepatitt B-virus
Kronisk infeksjon med hepatitt B-virus (HBV) medfører økt risiko for levercirrhose og hepatocellulært karsinom. Det finnes nå flere behandlingsmuligheter for pasienter med kronisk hepatitt, nukleosid- og nukleotidanaloger (lamivudin, adefovir, entekavir, telbivudin) i tillegg til interferon (3, 8), men det er også her nødvendig med langvarige kurer. Faren for resistensutvikling er til stede mot samtlige av midlene (9). Overfor lamuvidin er den spesielt høy som eksemplifisert i kasuistikken innledningsvis, den øker parallelt med varigheten av behandling og kan ses hos opptil tredjeparten av de behandlede etter ett år og inntil 70 % etter fem år (9, 10).
Hepatitt C-virus
Hepatitt C-virus (HCV) kan i likhet med hepatitt B-virus føre til kronisk infeksjon med utvikling av cirrhose og karsinom i lever. Ved standardterapi, bestående av pegylert interferon og ribavirin, er det ved HCV-genotype 2 og 3 blitt observert høy responsrate, mens effekten ved genotype 1 har vært dårligere (11). Det har vært vanskelig å påvise hvilke resistensmekanismer som gjelder for disse midlene, men nyere data har brakt mer kunnskap om problemet (3, 12).
Cytomegalovirus
Cytomegalovirus (CMV)-infeksjon er et problem hos immunsvekkede pasienter og har vært vist å gi større risiko for avstøting av f.eks. transplantert nyre (13). Ved alvorlig svekket immunforsvar vil slik infeksjon medføre behov for langvarig antiviral behandling med risiko for seleksjon av resistente virus. Allerede etter tre måneders bruk av f.eks. ganciklovir, som er det mest brukte antivirale middel mot slik infeksjon, kan resistente mutanter påvises hos opptil 6 % av pasientene (14).
Herpes simplex-virus
Herpes simplex-virus (HSV)-infeksjoner kan behandles spesifikt med medikamenter rettet mot virusets DNA-polymerase og brukes mye ved behandling av alvorlig infeksjon i sentralnervesystemet. Eksempel på en slik polymerasehemmer er aciklovir, en nukleosidanalog som selektivt fosforyleres til sin aktive form i herpesinfiserte celler ved tilstedeværelse av virusenzymet tymidinkinase (15). Imidlertid finnes det HSV-mutanter som er tymidinkinasenegative, noe som ses sjelden blant isolater fra immunkompetente (0,3 %), men observeres hos rundt 7 % av immunsvekkede (16, 17).
Varizella-zoster-virus
Varizella-zoster-virus (VZV) har samme resistensmekanisme som Herpes simplex-virus da tymidinkinase også er til stede her. Virusresistens kan være et problem hos aidspasienter med kroniske hudlesjoner forårsaket av varizella-zoster-virus, der virusreplikasjon over lang tid kan resultere i en seleksjon av resistente stammer (3).
Influensavirus A og B
For noen år siden kom neuraminidasehemmere på markedet i Norge for behandling av influensavirus A og B. Foreløpig er det få data publisert om forekomst av resistens mot disse midlene (18), men det er etablert et internasjonalt nettverk for overvåking av dette. Resistens mot amantadin og rimantadin er utbredt overfor influensa A(H3N2)-virus globalt (19).
Behandlingssvikt
Mange faktorer kan føre til at man ikke ser noen effekt av antiviral behandling. Klinisk behandlingssvikt kan enten skyldes at det foreligger resistente virus (virusresistens) eller det kan dreie seg om farmakologiske eller pasientrelaterte årsaker (ramme 2). Det er viktig å finne årsaken til dårlig effekt av antiviral behandling, og det er da aktuelt å kartlegge virusresistens. I Norge tilbys resistensundersøkelser med henblikk på hiv, hepatitt B-virus, cytomegalovirus og influensavirus.
Ramme 2
Viktige årsaker til behandlingsvikt
Pasientrelaterte
-
Immunsuppresjon
-
Medikamentintoleranse
-
Dårlig etterlevelse (complience)
-
Koinfeksjon (f.eks. hiv og hepatittvirus)
Medikamentrelaterte
-
Medikament når ikke frem til målorgan (f.eks. sentralnervesystemet)
-
Lav absorpsjon ved peroral medikasjon
-
Proteinbinding
-
Medikamentinteraksjon
Klinisk betydning av virusresistens
Vanligvis oppstår resistens under pågående antiviral behandling ved at det oppstår virusmutasjoner i genet som koder for målproteinet for medikamentet. Et annet scenario er at pasienten smittes med et virus som allerede har akkvirert resistens. Resistensutvikling varierer svært mye avhengig av hvilket virus og hvilket medikament det dreier seg om, det er også varierende hvor fort resistens utvikler seg. Likeledes kan det være svært forskjellig i hvilken grad resistens observeres, og hvilken klinisk betydning det har ved ulike virusinfeksjoner (20).
Det finnes tallrike eksempler på at antiviral resistens har en svært viktig klinisk betydning. Immunsvekkede pasienter utvikler oftere resistens sannsynligvis på grunn av at immunapparatet ikke holder infeksjonene under kontroll og virusmengden forblir høy (7). Dermed er muligheten større for å generere mutasjoner. Ved persisterende virusinfeksjoner kan forekomst av resistens være avgjørende for livsprognosen. Mutasjoner kan akkumuleres og føre til at virusets følsomhet minker slik at behandlingsregimet svikter (9, 21).
Kryssresistens overfor medikament i samme klasse kan utvikles, og ved vedvarende behandling kan graden av resistens øke. Dette fører til større utfordringer med å finne et regime som virker, samtidig som det tolereres av pasienten. Ved akutte virusinfeksjoner som tas hånd om av kroppens immunforsvar, er resistens vanligvis ikke noe stort problem. Unntaket er pasienter som må behandles for en alvorlig akutt infeksjon og er blitt smittet med resistente virus, for eksempel infeksjon med oseltamivirresistent influensa A-virus.
Resistente virus fører ikke alltid til manglende behandlingseffekt. For eksempel kan det likevel oppnås effekt hos hivpasienter som har fått påvist resistens mot multiple medikamenter (22). Dette skyldes sannsynligvis at mange virus som har utviklet resistens er svekket, og derved er mindre replikasjonsdyktige eller har redusert patogenitet (7). Viruspopulasjonen hos den enkelte pasient er heterogen og varierer over tid, og den kan bestå av en blanding av resistente og sensitive virus. Derfor vil ikke metoden for påvisning av resistens eller den enkelte pasientprøven nødvendigvis reflektere forholdene hos verten fullstendig.
Resistensmekanismer
Virusresistens kan defineres som erverv av en genetisk endring som gjør at virus ikke hemmes av et medikament i en konsentrasjon som normalt ville virke hemmende (7). Antivirale medikamenter er som regel rettet mot virusets egne enzymer ved å hemme formering av nye virus (3). De kan være rettet mot virusets proteiner involvert i replikasjon, slik som polymerase og protease, eller virusets mekanisme for å trenge inn i eller ut av vertscellen. Virus formerer seg rask, og fordi de slurver i denne prosessen, lages et spekter av virus med ulike mutasjoner (ramme 3). Dette gjelder virus generelt, men spesielt RNA-virus, slik som influensavirus og hepatitt C-virus, og virus som går via RNA ved formering, slik som hiv og hepatitt B-virus. I et spekter av ulike mutasjoner vil de som gir viruset et fortrinn, bli selektert og etter hvert dominere (fitness). Under behandling vil virus som klarer å unnslippe hemmende medikamenter, favoriseres og dermed utvikles virusresistens (4). Seponering av antiviral behandling vil imidlertid føre til at villtypevirus igjen dominerer og virusmengden kan stige med økt sykdomsprogrediering som resultat. Resistente virus vil i hovedsak formere seg dårligere enn ikke-resistente villtypevirus, men kan mutere ytterligere for å kompensere for dette, såkalte kompensatoriske mutasjoner.
Ramme 3
Faktorer av betydning for virusresistens
Utvikling av virusresistens er et stort problem ved latente eller kroniske virusinfeksjoner der man ved behandlingen ikke klarer å utrydde viruset. Virus som i latensfase ikke uttrykker gener kodende for virusprotein (f.eks. tymidinkinase) vil ikke ha effekt av et medikament som er avhengig av dette proteinet for å virke. Det primære målet ved behandling av persisterende virusinfeksjoner er å redusere mengde virus maksimalt for å forhindre videre utvikling av sykdom. Dette fører til at pasienten må behandles med antivirale midler i en årrekke, kanskje for resten av livet. Under langtidsbehandling utvikles det som regel resistens før eller siden, slik at ulike medikamenter må benyttes i kombinasjon for å begrense dette.
Metoder for påvisning av resistens
Det er viktig at prøver til resistensbestemmelse tas på det aktuelle tidspunkt der man mistenker resistensutvikling, og mens pasienten fortsatt er under behandling, alternativt i forkant av behandling for å kartlegge resistens før valg av medikamenter.
Det er to tilnærmingsmåter til påvisning av virusresistens, fenotypisk ved testing av infeksiøse virus i cellekultur, eller genotypisk der man påviser de respektive mutasjoner ved molekylærbiologiske metoder.
Fenotypisk resistens påvises in vitro ved at en resistent klon viser redusert følsomhet for et gitt antiviralt middel sammenliknet med villtypevirus (8). Metoden regnes for å være gullstandard, men er svært arbeids- og tidkrevende. Det er derfor ikke en vanlig rutinemetode.
Ved genotypiske metoder påvises unike mutasjoner med påfølgende aminosyreforandringer i spesifikke målområder av virusgenomet (8). For å identifisere nye potensielle resistensmutasjoner må man vise at den respektive mutasjonen er årsak til resistens ved å sammenlikne viruset før behandling med viruset som har gitt en økning i virusmengde (virusgjennombrudd) under behandling. Genotypiske resistens bør ideelt sett konfirmeres med en fenotypisk metode in vitro for å være helt sikkert på at den tilskrevne mutasjonen er årsak til resistensutviklingen, men i praksis gjøres dette i liten grad.
Overvåking
Resistente virus kan spres i befolkningen (6). For å ha oversikt over forekomst av resistens ved virusinfeksjoner er overvåking helt nødvendig. Slik overvåking vil ha betydning for valg av behandlingsregime, men kan også gi nyttig informasjon om utviklingstrekk som er ugunstige, f.eks. kryssresistens og vaksinemutanter. En viktig forutsetning for god overvåking er å sørge for tilgjengelige og gode metoder for mikrobiologisk diagnostikk og resistensbestemmelse.
Overvåking av hivresistens hos nyoppdagede hivpasienter ble innført i Norge i 2006. Resistensdata registreres og oppbevares ved Nasjonalt folkehelseinstitutt som lager årlige rapporter om situasjonen. Resistensbestemmelse av 118 av 275 nydiagnostiserte hivpositive (43 %) viste at 14 (12 %) hadde én eller flere resistensmutasjoner. Det tilsvarer tall for USA og Europa, der man hos 6 – 16 % av behandlingsnaive hivpasienter finner resistens mot minst ett antiviralt middel (6, 23). Resistensundersøkelse anbefales både som en del av utredningen ved nyoppdaget hiv og ved igangsetting av behandling (24).
Spesielt viktig er overvåking av resistens hos influensavirus. Denne overvåkingen kan gi grunnlag for å vurdere forventet virkning av antivirale midler under en pandemi. I tråd med anbefalningene i nasjonal beredskapsplan for pandemisk influensa er det etablert overvåking av resistens hos influensavirus i Norge.
Forebygging
Utvikling av virusresistens kan ikke forhindres, men begrenses. Generelle smitteverntiltak og vaksiner kan forebygge smitte og derved være med på å redusere forekomsten av virusinfeksjoner og resistens. En strategi for bekjempelse av resistens vil være å teste virus for resistens før valg av antiviralt regime. En annen strategi er å gi kombinasjonsbehandling rettet mot flere ulike enzymer eller proteiner hos virus, slik at virusreplikasjonen undertrykkes mest effektivt og resistens utvikles i minst mulig grad. Overvåking av virusresistens gir kunnskap man kan bruke som grunnlag for valg av adekvat empirisk behandling, noe som også vil virke forebyggende (25).
Fremtidsaspekt
Utfordringen fremover blir å lage medikamenter uten bivirkninger der det utvikles resistens i liten grad, og som klarer å utrydde virus hos pasienter med kroniske og latente infeksjoner. De fleste antivirale medikamenter på markedet hemmer virusreplikasjon, men det utvikles etter hvert nye medikamenter som angriper andre stadier av virusinfeksjonen. Nylig ble to nye medikamenter med helt nye angrepsprinsipper mot hiv lansert, integrasehemmeren raltegravir og kjemokinreseptorhemmeren maraviroc (24). Det er fortsatt mange virusinfeksjoner der det ikke eksisterer noen spesifikk antiviral behandling. Utvikling av medikamenter mot virusinfeksjoner med alvorlig forløp blir en viktig utfordring i fremtiden.
Et økende tilbud av antivirale midler er til salgs på Internett med mulighet for å kjøpe preparater uten resept fra lege, uten forutgående diagnostikk og resistensundersøkelse. Dette vil kunne bli en stadig større utfordring da det er mange preparater med usikker virkning, men også preparater med antiviral effekt som av ulike årsaker ikke er godkjent på det norske markedet.
Matematiske modeller indikerer at hivresistens kan bli et økende problem i fremtiden og kan føre til at kombinasjonsbehandling blir mindre effektivt (26), mens for Herpes simplex-virus indikeres det ingen stor økning i resistensforekomst (27, 28).
Konklusjon
Virusinfeksjoner behandles i større grad enn tidligere, og virusdiagnostikk har dermed fått en stadig økende betydning. Det finnes rundt 30 antivirale medikamenter på markedet, og det er viktig å være klar over hvilke muligheter som finnes for behandling og kontroll av ulike virusinfeksjoner. Behandlingen av kroniske virusinfeksjoner utføres i hovedsak av infeksjonsmedisinere fordi det nå gis behandling tilpasset hver pasient med overvåking av behandlingseffekt og resistensbestemmelse. Dette krever tverrfaglig samarbeid mellom spesialisttjenestene, spesielt infeksjonsmedisin og medisinsk mikrobiologi. Stadige kliniske og virologiske kontroller medfører økte kostnader i helsetjenesten, men må ses i sammenheng med helseeffekten hos den enkelte pasient.
Forskning på antivirale medikamenter og virusresistens er viktig. Det er svært tidkrevende å kartlegge nye mutasjoner og betydning av disse i forbindelse med resistens, og ofte mangler internasjonalt aksepterte standarder for resistenstesting og tolking (8). Derfor er det en viktig forutsetning for økt virologisk kompetanse at erfaringer formidles i publikasjoner eller veiledninger, og at det drives nettverkssamarbeid internasjonalt. Overvåking hos den enkelte pasient og i befolkningen er viktig for å kartlegge forekomsten av resistens, spesielt overfor kroniske infeksjoner med hiv, cytomegalovirus og hepatittvirus.