En 78 år gammel mann ble henvist til Rikshospitalet for utredning av aortastenose avdekket ved lokalsykehus. Han var tidligere nyretransplantert og hadde i de senere år utviklet symptomer på hjertesvikt. I tillegg til aortastenose hadde han betydelig redusert venstre ventrikkel-funksjon.
Pasienten hadde de siste årene utviklet hjertesvikt med dyspné i NYHA klasse II-III og asteni. Mest plaget var han imidlertid av uttalte residiverende underekstremitetsødemer. Han hadde også utviklet persisterende atrieflimmer. Det var ingen kjent opphopning av hjertesykdom i familien. Han hadde angivelig fått påvist proteinuri allerede i ungdommen. 20 år før den aktuelle innleggelsen ble han nyretransplantert pga. nyresvikt forårsaket av nefrosklerose. Transplantatet hadde vært velfungerende, men kreatininnivået hadde den siste tiden vært lett forhøyet (120–150 µmol/l, svarende til en glomerulær filtrasjonsrate på 40–50 ml/min).
Pasienten hadde hatt flere innleggelser ved lokalsykehuset pga. forverring av hjertesvikten. Ekkokardiografi viste alvorlig aortastenose og fortykket myokard. Han ble henvist til Rikshospitalet for utredning og ev. behandling av klaffefeilen.
Aortastenose er den hyppigst forekommende klaffelidelsen i den vestlige verden (1). Hos majoriteten av pasientene er årsaken degenerativ klaffesykdom, som er assosiert med de klassiske risikofaktorer for aterosklerose: hypertensjon, røyking, hyperkolesterolemi og høy alder (2). Oftest har pasienten en lang symptomfri periode før venstre ventrikkel svikter. Mange utvikler venstre ventrikkel-hypertrofi som følge av økt trykkbelastning (afterload). Hos enkelte ses redusert venstre ventrikkel-funksjon forårsaket av stenosen.
Når aortastenosen blir symptomgivende, er prognosen dårlig (3). Etter kirurgisk implantasjon av klaffeprotese er imidlertid prognosen meget god – den forventede levealder er tilnærmet lik levealderen i den aldersjusterte befolkningen for øvrig (4). Pasienter med antatt symptomgivende aortastenose skal derfor vurderes med tanke på klaffekirurgi.
Ved første innleggelse ved Hjertemedisinsk avdeling, Rikshospitalet, hadde pasienten bilaterale ankelødemer og stenoselyd grad 4/4 over hjertet, forenlig med aortastenose. Annen hjertetone var opphevet. Blodtrykket var 110/92 mm Hg, pulsen 76 slag/min og uregelmessig. EKG viste atrieflimmer og venstre ventrikkel-hypertrofi, med ST-depresjoner anterolateralt. Blodprøver viste et kreatininnivå på 142 µmol/l, svarende til en estimert glomerulær filtrasjonsrate på 42 ml/min og nyresvikt stadium 3. Urea var tilsvarende forhøyet – 19,7 mmol/l. For øvrig var prøvesvarene relativt upåfallende – SR 15, Hb 15,8 g/100 ml, trombocytter 224 · 10⁹/l, leukocytter 6,4 · 10⁹/l, natrium 147 mmol/l, kalium 4,0 mmol/l og glukose 5,5 mmol/l.
Ekkokardiografi viste moderat dilatert venstre ventrikkel med lett til moderat fortykket vegg. Endediastolisk indre diameter var 6,6 cm, septumtykkelse 1,4 cm og bakre veggs tykkelse 1,2 cm (fig 1). Venstre ventrikkels ejeksjonsfraksjon ad modum Simpson biplan var ca. 30 %. Det var tegn til forhøyet venstresidig fyllingstrykk. Aortaklaffen var trikuspid med betydelig forkalkning av alle tre kusper, redusert åpningsbevegelse og betydelig aortastenose, med areal 0,9 cm2 beregnet etter kontinuitetslikningen. Det var en liten, sentral aortainsuffisiens. Mitralklaffen hadde slanke segl og en liten insuffisiens. Det forelå biatrial forstørrelse (venstre atrium 29,5 cm², høyre atrium 20,5 cm²). Blodstrømshastigheter i mitralostiet, vevshastigheter i mitralringen og dilatert venstre atrium indikerte samlet at det forelå restriktiv fylling av venstre ventrikkel. Myokard hadde et påfallende, granulært ekkokardiografisk uttrykk, og det ble mistenkt primær myokardsykdom i tillegg til klaffefeil. Koronarangiografi viste kalk i proksimale koronarkar, men ingen signifikante stenoser.

Figur 1 Ekkokardiografi. a) Apikalt firekammerbilde viser fortykket venstre ventrikkelvegg, granulært mønster i myokard og biatrial dilatasjon. b) Apikalt langaksebilde i midtsystole viser sklerotisk aortaklaff uten synlig åpning. c) Pulset doppler i mitralostiet viser blodstrømshastigheter med kort deselerasjonstid (124 ms). Pasienten har atrieflimmer. d) Pulset vevsdoppler av septale mitralring viser nedsatt langaksebevegelighet i systole (S₁ = 0,02 m/sek) og tidlig diastole (E’ = 0,04 m/sek)
Nedsatt funksjon av venstre ventrikkel utgjør ingen absolutt kontraindikasjon når det gjelder klaffekirurgi ved aortastenose. Tvert imot kan svekkelse av venstre ventrikkel være indikasjon for kirurgisk intervensjon ved aortastenose (1). Oftest vil venstre ventrikkels funksjon ta seg opp etter vellykket kirurgi (5). Dette forutsetter at hjertesvikten er sekundær til stenosen. I dette tilfellet ga ekkokardiografisk undersøkelse mistanke om at pasientens hjertesvikt ikke alene skyldtes klaffelidelsen, men at han også hadde en myokardial sykdom. Det er viktig å avdekke årsaken til og graden av slik sykdom før man tar beslutning om ev. kirurgi.
Grunnet betydelig svekket venstre ventrikkel ble det besluttet at pasienten skulle få utført stressekkokardiografisk undersøkelse for vurdering av venstre ventrikkels kontraktile reserve. Han ble skrevet ut til hjemmet i mellomtiden.
Stressekkokardiografi kan avdekke om en aortaklaff med lavt beregnet areal virkelig er så trang (fiksert) eller om den bare åpner seg dårlig pga. nedsatt ventrikkelfunksjon (5). Stressekkokardiografi har også vist seg nyttig i å kunne avgjøre om venstre ventrikkel har kontraktile reserver, hvorved man kan forvente bedret funksjon etter ventilkirurgi. Manglende kontraktil reserve predikerer høy operativ risiko (5).
I forkant av neste innleggelse hadde pasienten vært innlagt ved lokalsykehuset for diuretisk behandling og optimalisering av hjertesviktmedikasjonen. Vekten gikk i løpet av dette oppholdet ned med ca. 10 kg. Ved innleggelse ved Rikshospitalet var han tilbake i habitualtilstand.
Stressekkokardiografi med gradert dobutaminbelastning til 20 µg/kg/min viste fiksert stenose med beregnet areal 0,7 cm² (tab 1). Venstre ventrikkels systoliske funksjon var som tidligere betydelig nedsatt. Det ble ingen bedring av systolisk funksjon ved belastning.
|
Tabell 1 Stressekkokardiografi med gradert dobutaminbelastning. Tabellen viser at aortastenosen er fiksert – åpningsarealet (beregnet etter kontinuitetslikningen) forblir uendret. Det fremkommer også at venstre ventrikkel mangler kontraktil reserve – slagvolumet forblir lavt og trykkgradienten over aortaklaffen stiger lite på tross av økende dobutaminstimulus. Minuttvolumet øker noe parallelt med stigende hjertefrekvens
|
|
Dobutamin (µg/kg/min)
|
Dobutamin (µg/kg/min)
|
Dobutamin (µg/kg/min)
|
|
0
|
10
|
20
|
|
Hjertefrekvens (slag/min)
|
61
|
69
|
117
|
|
Systolisk/diastolisk blodtrykk (mm Hg)
|
99/72
|
86/52
|
101/64
|
|
Venstre ventrikkels slagvolum (ml)
|
49
|
57
|
48
|
|
Minuttvolum (l/min)
|
3,0
|
3,9
|
5,6
|
|
Gjennomsnittlig trykkgradient over aortaklaff (mm Hg)
|
26
|
29
|
33
|
|
Beregnet aortaklaffareal (cm²)
|
0,7
|
0,8
|
0,8
|
Den stressekkokardiografiske undersøkelsen viste at pasientens aortastenose var fiksert, men også at venstre ventrikkel manglet kontraktil reserve. Årsaken til at venstre ventrikkel var hypertrofisk, restriktiv og svekket var imidlertid ikke funnet.
Transvenøs biopsi av endomyokard viste avleiring av amyloid (fig 2), der immunohistokjemisk fremstilling avdekket nedslag av transtyretin (prealbumin) (fig 3).
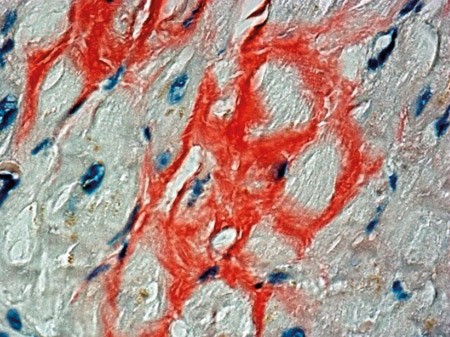
Figur 2 Endomyokardial biopsi. Snittet er farget med kongorødt og viser nedslag av amyloid mellom myocyttene
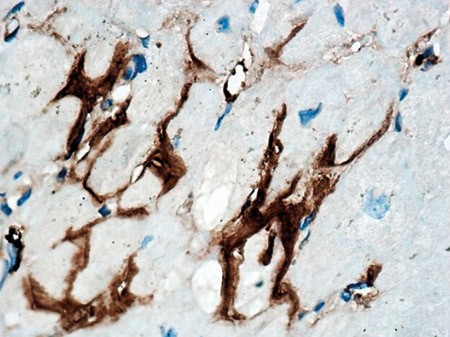
Figur 3 Endomyokardial biopsi. Immunhistokjemisk behandling med antistoffer rettet mot transtyretin viser ekstracellulær avleiring av dette proteinet
Etter en diskusjon som involverte kardiologer og thoraxkirurger ved Rikshospitalet, ble det besluttet ikke å tilby vår pasient operasjon. Høy alder, status med nyretransplantat og nyresvikt gir i seg selv forhøyet operativ risiko. Hans betydelig svekkede venstre ventrikkel uten kontraktil reserve ble ansett å utgjøre en så stor tilleggsrisiko at operasjon ikke kunne tilrådes. Han ble derfor skrevet ut til hjemmet med uendret medikamentell behandling og oppfølging ved lokal hjertesviktpoliklinikk.
Diskusjon
Amyloidose er en tilstand karakterisert ved nedslag av monomorft proteinmateriale i ett eller flere vev. Dette materialet gir et karakteristisk «eplegrønt» skimmer når det farges med kongorødt og betraktes i polarisert lys. Flere naturlig forekommende og muterte proteiner har evnen til å danne amyloid. Etter molekylærbiologiske fremskritt kan man nå skille mellom en rekke typer amyloidose ut fra hvilket protein som felles ut (6). De viktigste systemiske formene for amyloidose er amyloid lettkjede (AL)-amyloidose (tidligere kalt «primær» amyloidose), forårsaket av nedslag av lette kjeder ved monoklonal plasmacelleproliferasjon, og amyloid A-protein (AA)-amyloidose («sekundær» amyloidose). Ved sistnevnte er det nedslag av et leversyntetisert akuttfaseprotein ved langvarig inflammatorisk tilstand (6).
Den vanligste form for kardial amyloidose er imidlertid amyloid transtyretin (ATTR)-amyloidose, også kalt senil systemisk amyloidose. Denne formen for amyloidose forårsakes av utfelling av transtyretin (tidligere kalt prealbumin) (7). Prevalensen av slik amyloidose i autopsimaterialer hos eldre er angitt å være ca. 25 % (8). Langt de fleste tilfeller er asymptomatiske. Selv symptomgivende kardial ATTR-amyloidose har langt bedre prognose enn f.eks. AL-amyloidose, med en forventet levetid på 5–6 år versus under 12 måneder (9).
Kardial amyloidose medfører ofte EKG-forandringer, mest typisk ses små elektriske amplituder i standardavledningene (low voltage). Funnet er imidlertid ikke patognomonisk (9) og fantes ikke hos vår pasient. Ekkokardiografisk ses fortykkelse av myokard med typisk ekkogenisitet og restriktivt fyllingsmønster (10). For sikkert å kunne stille diagnosen kreves imidlertid biopsi – ved systemisk sykdom kan biopsi tas fra rectum eller abdominalt fettvev. Imidlertid er sensitiviteten ved biopsi i ekstrakardialt vev lav ved ATTR-amyloidose (9).
Hos vår pasient fant man betydelig nedslag av transtyretin i myokard. Dette ses ved to tilstander: Ved arvelig sykdom forårsaket av mutasjon i genet for transtyretin, noe som gir hjertesvikt og polynevropati i relativt ung alder, og ved senil systemisk amyloidose, der det utfelles «villtype» (normalt) transtyretin. Denne tilstanden gir kardial amyloidose i høy alder, vanligvis uten sikre symptomer (7). Vår pasient hadde verken nevropati, sykdomsdebut i ung alder eller familiær forekomst av amyloidose eller uforklart hjertesvikt. Vi fant det derfor sannsynlig at han hadde den vanlige, ikke-arvelige varianten av amyloidose med nedslag av normalt transyretin. Det ble ikke gjort elektroforese eller genetisk testing med tanke på ev. mutasjon, da slik diagnostikk ikke utføres i Norge.
Både aortastenose og (subklinisk) kardial amyloidose er hyppig forekommende tilstander i den eldre del av befolkningen. Problemstillingen med samtidig forekommende alvorlig aortastenose og symptomgivende kardial amyloidose er imidlertid lite omtalt i litteraturen. Ved søk i PubMed på «amyloidosis» AND («aortic stenosis» OR «aortic valve stenosis») oppnås bare 35 treff (10.6. 2009), hvorav flertallet av artiklene omhandler de to tilstandene som differensialdiagnoser ved hjertesvikt. Kun én artikkel handler om amyloidavleiring i hjerteklaffer (11). Der fremkommer det at pasienter med familiær amyloidose med polynevropati har nedslag av amyloid også i hjerteklaffene. Imidlertid hadde kun to av 12 pasienter i dette obduksjonsmaterialet signifikant klaffestenose, hvorav én stenotisk aortaklaff var bikuspid. Begge de stenotiske klaffene hadde betydelig forkalkning, der kalknedslaget ikke samsvarte med fordelingen av amyloid i én og samme klaff. Det er således ingen beskrevet sammenheng mellom kardial amyloidose og aortastenose, men temaet er lite belyst.
Denne kasuistikken setter søkelys på en lite omtalt sykdomskombinasjon: aortastenose og amyloidose. Den understreker også viktigheten av grundig utredning og vurdering før beslutning om større hjertekirurgi tas. Stressekkokardiografi med dobutaminbelastning var en avgjørende undersøkelse i den diagnostiske prosessen.