En mann i 60-årene ble innlagt etter et døgns sykehistorie med hodepine, kvalme og oppkast. Etter første undersøkelse i akuttmottak ble det vurdert at det var liten mistanke om alvorlig bakenforliggende sykdom, men han ble innlagt for observasjon og smertelindring. Etter flere dager i sykehus tilkom nye symptomer og laboratoriefunn som pekte mot rett diagnose.
En mann i 60-årene ble innlagt på nevrologisk avdeling med hodepine. Hodepinen hadde debutert kvelden før og utviklet seg til maksimal intensitet over et par timer. Innleggelsesdagen var det en ytterligere forverring med gradvis økning av smertene uten anfallspreg. Han beskrev trykkende smerter på toppen av hodet som strålte mot øynene på begge sider. Han hadde forsøkt å ta ibuprofen mot smertene hjemme, men kastet opp tablettene hver gang. Totalt hadde han kastet opp fem ganger innleggelsesdagen. Han hadde de siste tre dagene jobbet mye ute i varmen og drukket og spist lite.
Fra tidligere hadde pasienten kjent koronarsykdom og var behandlet for angina med angioplastikk for over ti år siden. Han hadde hatt en kronisk smertetilstand i bekken og korsrygg over flere år og fått behandling for dette ved sykehusets smertepoliklinikk. Ti år tidligere hadde han fått påvist et ulcus i oesophagus. Han hadde ingen kjente allergier, røykte ikke og hadde ingen tidligere legemiddelreaksjoner. Han brukte angiotensinkonvertasehemmer (ACE-hemmer) (ramipril tablett 5 mg x 2), betablokker (metoprolol depottablett 50 mg × 1), statin (atorvastatin tablett 20 mg × 1) og platehemmer (acetylsalisylsyre tablett 75 mg × 1). Han var fortsatt yrkesaktiv.
Ved innkomst klaget pasienten over hodepine, hadde på solbriller og ønsket at lyset i rommet skulle være dempet. Han var uttalt lyssky, men ikke nakkestiv. Blodtrykket var 130/88 mm Hg, pulsen regelmessig med frekvens 56 slag/min, og temperaturen 37,2 °C. Orienterende blodprøver viste: leukocytter (LPK) 7,5 · 109/l (3,5–10,0), hemoglobin 14,9 g/dl (13,4–17,0), trombocytter (TPK) 115 · 109/l (145–390), CRP 0,60 mg/l (0,0–5,0), kreatinin 80 µmol/l (60–105), estimert glomerulær filtrasjonsrate (eGFR) > 90 ml/min/1,7 m2, troponin T < 10 ng/l (0,00–14), natrium 140 mmol/l (137–145), kalium 3,9 mmol/l (3,5–4,5), albuminkorrigert kalsium 2,22 mmol/l (2,17–2,53). Nevrologisk undersøkelse viste normale funn, uten hjernenerveutfall eller motoriske eller sensoriske utfall i over- eller underekstremiteter. Donders prøve viste normalt synsfelt og ingen synsforstyrrelser. CT caput ble også beskrevet som normal. Det var ikke feber eller CRP-stigning som tegn på infeksjon. Etter initial undersøkelse var konklusjonen at det var lite sannsynlig med alvorlig bakenforliggende årsak til pasientens hodepine. Pasienten ble innlagt i sykehus for observasjon og smertelindring.
Akutt oppstått kraftig hodepine kan ha mange årsaker og er en vanlig problemstilling ved nevrologiske og medisinske avdelinger. Ved den initiale vurderingen er det viktig å utelukke at hodepinen har alvorlig bakenforliggende årsak som krever rask behandling, slik som subaraknoidalblødning, intracerebral blødning, hjerneinfarkt og meningitt/encefalitt.
Dagen etter innleggelsen hadde han vedvarende sterke smerter, kastet fortsatt opp og greide ikke å holde på verken mat eller medisiner tatt per os. Det ble gjennomført spinalpunksjon med funn av klar og fargeløs spinalvæske (sp) med sp-LPK 1 · 106/l (0–4) og sp-totalprotein 0,77 g/l (0,10–0,50). Sp-glukose viste 2,5 mmol/l (2,5–4,0) og s-glukose 5,1 mmol/l (4,0–6,3), med ratio 0,49. Åpningstrykk ble dessverre ikke målt. Det ble påvist IgG-antistoffer mot Borrelia burgdorferi i spinalvæske, men testen for IgM-antistoffer var negativ. Det var tilsvarende forhøyede verdier av Borrelia burgdorferi-IgG i blod (550 % av påvisningsgrensen), og negativ IgM. Antistoffratio var ikke forenlig med intratekal produksjon av antistoffer. Polymerasekjedereaksjonstesten (PCR) var negativ for enterovirus, varicella-zoster-virus og herpes simplex-virus type 1 og 2 i spinalvæsken. Serologi var negativ for flåttbåren encefalitt og forenlig med gjennomgått infeksjon med herpes simplex-virus og varicella-zoster-virus. På vag mistanke om migreneanfall ble det gjort forsøk på smertelindring med sumatriptan subkutant. Dette hadde ingen effekt.
Ved mistanke om subaraknoidalblødning har man tradisjonelt anbefalt spinalpunksjon 12 timer etter smertedebut, da xantokromi (gulfarging) eller blodtilblanding av spinalvæsken kan avdekke subaraknoidalblødning som ikke er sett på CT caput. I noen studier har man stilt spørsmål ved den kliniske nytten av denne undersøkelsen. Forfatterne av disse heller mot å anbefale CT angiografi som sekundærundersøkelse ved sterk klinisk mistanke om subaraknoidalblødning og negative funn på CT caput (1). Spinalpunksjon har uansett betydning for å påvise andre differensialdiagnoser. Pleocytose kan gi mistanke om meningitt eller encefalitt. Ved cerebral vaskulitt vil det ofte foreligge lett pleocytose og forhøyet protein i spinalvæsken. Lavt åpningstrykk kan gi mistanke om spontan intrakranial hypotensjon. Høyt åpningstrykk vil peke mot en tilstand som gir høyt intrakranialt trykk, som cerebral venetrombose.
Tredje dagen etter innleggelse hadde han vedvarende hodepine uten bedring. Denne dagen bemerket han for første gang dobbeltsyn etter å ha vært oppe og gått en stund. Pasienten var medtatt.
Man hadde fortsatt ikke forklaring på hodepinen og ønsket derfor å utelukke cerebral venetrombose, som er en sjelden, men alvorlig tilstand. Tilstanden kan debutere både akutt, subakutt og kronisk. Tilstanden har en rekke presentasjonsformer, men viser seg vanligvis som et isolert intrakranialt hypertensjonssyndrom (hodepine med eller uten oppkast, papilleødem og synsforstyrrelser), et fokalt syndrom (fokale utfall, kramper eller begge deler) eller som encefalopati (multifokale tegn, mental endring, stupor eller koma). Dette gir diagnostiske utfordringer.
D-dimer var negativ, og ved oftalmoskopi ble det ikke funnet stasepapill. Det var fortsatt ingen nakkestivhet. CT angiografi i venefase ble utført, og viste normale funn.
Fjerde dagen etter innleggelse tilkom en abducensparese på høyre øye. Det ble tatt ny elektrolyttstatus som avdekket at det hadde oppstått hyponatremi, med s-natrium 127 mmol/l (137–145), mot 140 ved innleggelse fire dager tidligere. CRP-verdien hadde steget til 16. Natt til denne dagen hadde hodepinen forverret seg, men smertelindring med tramadol hadde effekt. Det ble ved klinisk undersøkelse bemerket bilateral ømhet over temporalområdet og smerter i øyet.
Fortsatt var det ingen forklaring på pasientens hodepine, og det var nå tilkommet en parese av 6. hjernenerve. På grunn av temporal ømhet og smerter i øyet tenkte man på muligheten for temporalarteritt. Det ble derfor bedt om revmatologisk vurdering.
Det forelå ingen tidligere kjent revmatisk sykdom, det var ingen leddplager eller hudplager i anamnesen, det var ingen palpasjonsømhet over temporalarteriene og pulsen var fin. Blodprøver viste LPK 4,7 · 109/l (3,5–10,0), senkningsreaksjonen (SR) var 16 mm/time (2–20), CRP 16 mg/l (0,00–5,0) og TPK 106 · 109/l (145–390). Konklusjonen var at kliniske funn ikke tilsa klassisk temporalarteritt, og at det heller ikke anamnestisk eller klinisk var holdepunkt for annen vaskulittsykdom.
Revmaprøver ble senere besvart: RF-latekstest < 20 IE/ml (< 20), anti-syklisk citrullinert peptid-antistoff (anti-CCP) U/ml (< 7), negativ for antinukleære antistoffer (ANA), antistoff mot proteinase-3 (PR3-ANCA) 2 enheter (< 20) og myeloperoksidaseantistoff (MPO-ANCA) 3 enheter (< 20). Siden det fortsatt ikke forelå noen diagnose, ble det rekvirert MR caput, men det var ikke kapasitet til å få undersøkelsen utført samme dag. Den nyoppståtte hyponatremien ble diskutert med vakthavende indremedisiner. Det var ingen kjent nyresykdom i anamnesen, og pasienten brukte ikke diuretika, men sto på ACE-hemmer (ramipril, tabletter 5 mg × 2). Man antok at hyponatremien hadde sammenheng med kvalme og oppkast.
Femte dagen etter innleggelse ble hyponatremien forverret til 121 mmol/l (137–145). S-kalium var 4,0 mmol/l (3,5–4,4) og s-osmolalitet 254 mmol/l (280–300). CRP var steget til 76. Det var ingen klar infeksjonsmistanke. Spot-urinprøven viste u-osmolalitet 890 mosmol/kg (300–900), u-natrium 159 mmol/l og u-kalium 32 mmol/l. Klinisk ble pasienten vurdert som normovolemisk.
Urinprøven viste høy urinosmolalitet (> 100 mosm/kg) og høyt natriuminnhold (> 30 mmol/l). Elektrolyttforstyrrelser og urinfunnene var forenlig med patologisk økt utskilling av antidiuretisk hormon (ADH) (kalt SIADH, syndrome of inappropriate ADH secretion). Forhøyet CRP kan ha relasjon til infeksjonssykdom, men kan også være en markør på vevshenfall. Man hadde nå et klinisk bilde med akutt hodepine, mistenkt SIADH og hjernenerveparese (VI), og det ble reist mistanke om hypofyselesjon/-apopleksi.
Nevrolog purret på MR-undersøkelse av caput og ba om regranskning av hypofysen på de opprinnelige CT-bildene av caput. Samtidig ble vakthavende indremedisiner kontaktet. Det ble gitt hydrokortison (Solu-Cortef) 100 mg intravenøst på mistanke om sentral hypofysesvikt med hypokortisolisme, og pasienten fikk tilførsel av isotont saltvann (NaCl 0,9 %). Han ble flyttet til intensiv-/intermediæravdeling for mer nøye overvåking av vitale parametere og elektrolyttforstyrrelser. Det ble videre forskrevet hydrokortison 100 mg intravenøst hver 6. time.
Hormonprøver med tanke på hypofyseaksene viste thyreoideastimulerende hormon (TSH) 0,35 mIE/l (0,39–4,2), fritt tyroksin (FT4) 7,3 pmol/l (11,0–22,0) og fritt trijodtyronin (FT3) 2,3 pmol/l (3,1–6,8). Dette var forenlig med sentral hypotyreose. Kortisolprøven tatt kl 1100 viste lave verdier, 14 nmol/l (ref. kl 07–09: 220–850 nmol/l, kl 19–21: < 50 % av morgenverdi). Prolaktinverdien var 23 mIE/l (100–400), mens follikkelstimulerende hormon (FSH) på 5,7 IE/l (1,0–12,0) og luteiniserende hormon (LH) på 1,6 IE/l (1,0–10,0) var innenfor normalområdet. Testosteronverdien var < 1,0 nmol/l (9,0–35,0) og veksthormon 1,0 μg/l. Prøvesettet var forenlig med hypofysesvikt i flere akser (fig 1).
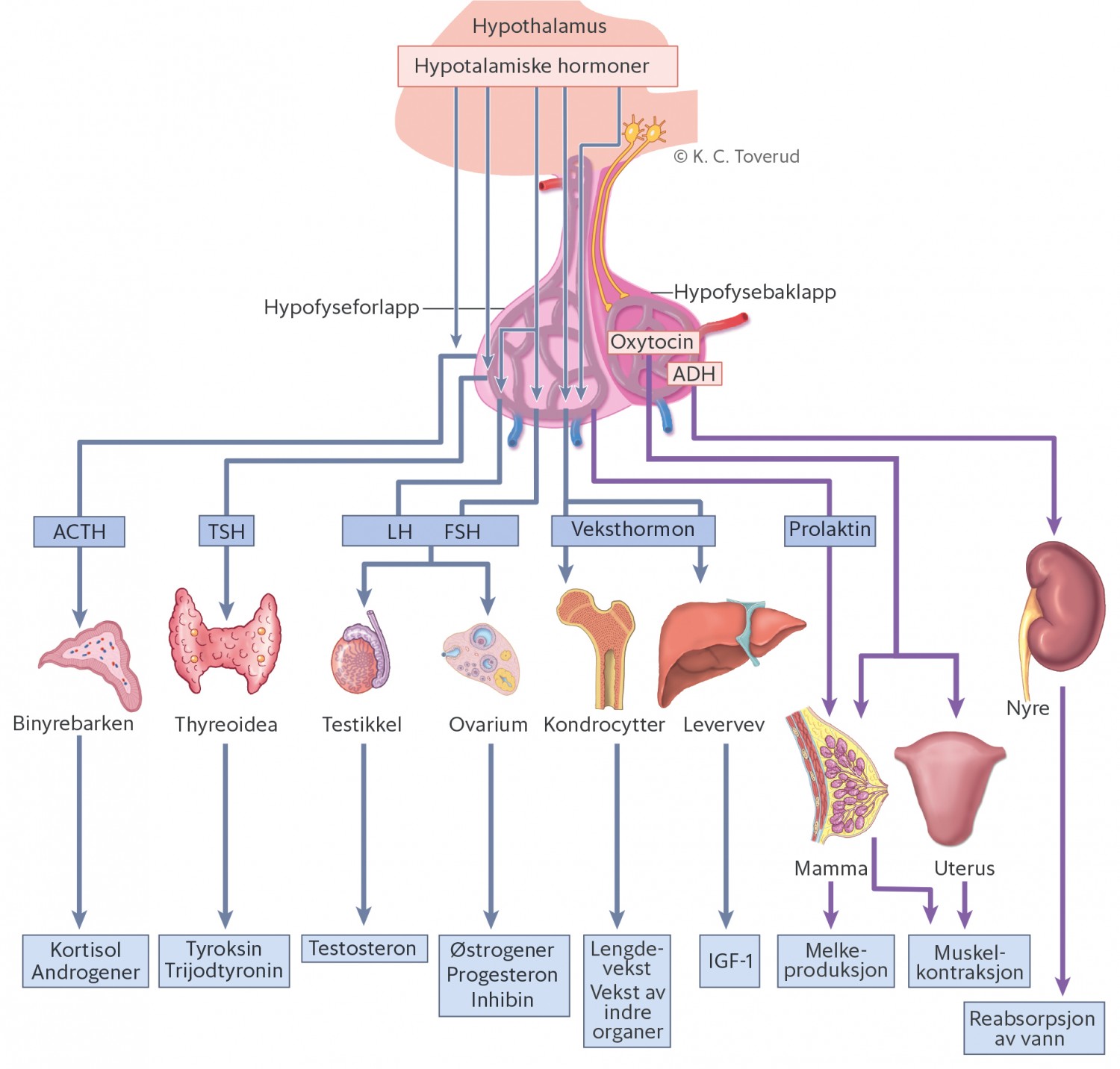
Figur 1 Hypofysens hormonakser.
Ved regranskning så man at CT caput tatt ved innleggelsen viste en lavattenuerende lesjon i hypofysen (fig 2). MR caput tatt som øyeblikkelig hjelp-undersøkelse viste blødning i et hypofyseadenom med bukning inn i sinus cavernosus på høyre side og affeksjon av nervus abducens. Det var ekspansjon av sella turcica med manglende laterale høyre vegg og kraftig uttynning av bakre vegg, som var forenlig med et adenom som hadde utviklet seg over lang tid med remodellering av omliggende ben. Det var også noen uspesifikke lesjoner i hvit substans. Pasienten ble samme kveld overført til nevrokirurgisk avdeling ved universitetssykehus. Han ble operert neste dag med transsfenoidal reseksjon av hypofysetumor og blødning.

Figur 2 CT caput uten intravenøst kontrastmiddel. a) koronalt snitt, b) sagittalt snitt. Ekspansiv lesjon i sella turcica med ekspansjon inn i sinus cavernosus på høyre side. Tumor når opp til chiasma opticum. Remodellering av tilgrensende benstrukturer.
I etterkant av operasjonen gikk diplopien nesten fullstendig i retur, men pasienten hadde vedvarende hypofysesvikt med behov for substitusjonsbehandling med kortison, levotyroksin, testosteron og desmopressin.
Diskusjon
Hypofysær apopleksi ble første gang beskrevet av Bailey i 1898 (2), men fikk ikke navnet før Brougham, Heusner og Adams i 1950 publiserte en artikkel som beskrev fem pasienter med plutselig død, der obduksjon avdekket blødning i hypofyseadenom (3). Tilstanden burde egentlig kalles hypofyseadenom-apopleksi, da infarkt i en normal hypofyse har andre årsaker, som Sheehans syndrom. Hypertensjon, antikoagulasjonsbehandling og større kirurgiske inngrep er risikofaktorer for tilstanden. Hypofysær apopleksi er en relativt sjelden tilstand. Klinisk hypofysær apopleksi inntreffer bare i 0,6–9 % av hypofysetumorer (4). Ved radiologisk undersøkelse finnes imidlertid hemoragiske områder i 10–20 % av hypofyseadenomene. Nye belgiske og islandske prevalenstall for hypofyseadenom er omkring 100 tilfeller per 100 000 personer (5, 6).
De vanligste debutsymptomene er hodepine (80–100 %), kvalme (80 %), nedsatt synsstyrke (56 %) temporalt synsfeltutfall (34–70 %), en grad av oftalmoparese (45–57 %) og redusert bevissthetsnivå (13–70 %) (4). Kompresjon av chiasma opticum gir synsforstyrrelser og synsfeltutfallene, mens kompresjon av sinus cavernosus kan gi affeksjon av 3., 4. og 6. hjernenerve. Det vanligste er affeksjon av 3. hjernenerve (n. oculomotorius), og det nest mest vanlige er affeksjon av 6. hjernenerve (n. abducens). Hypofysær apopleksi er debutsymptomet av hypofyseadenomet hos 50–80 % av pasientene.
Hypofysær apopleksi kan være en farlig tilstand som kan resultere i plutselig død, sannsynligvis på grunn av sentral binyrebarksvikt. Dette er imidlertid sjelden i moderne tid med CT- og MR-diagnostikk. Infarkt eller nekrose av hypofysekjertelen gir hypofysesvikt som forblir permanent hos 50–80 %. Synsfeltutfall kan også bli permanente, men bedres i de fleste tilfeller hvis pasienten opereres tidsnok.
Vår pasient utviklet hyponatremi. Dette oppstår i en del tilfeller (10–40 %) ved hypofysær apopleksi og forårsakes av hypokortisolisme (7). Når adrenokortikotropt hormon (ACTH) og kortisol faller, bidrar dette til økt ADH. Tilstanden presenterer seg derfor med normovolemisk hyponatremi og et biokjemisk bilde som ved SIADH. Ved sentral binyrebarksvikt er renin-angiotensin-aldosteron-aksen bevart, og dette gjør at man ikke får hyperkalemi som ved primær binyrebarksvikt. Dette stemmer med laboratoriefunnene hos vår pasient. SIADH kan oppstå ved en rekke andre tilstander som kan gi akutt hodepine. Eksempler er akutt subaraknoidablødning eller annen hjerneblødning, meningitt og encefalitt. En spesielt aktuell differensialdiagnose i denne kasuistikken er sinus cavernosus-trombose, som kan gi SIADH, hodepine og samme hjernenerveutfall som vår pasient hadde.
Tradisjonelt har de fleste pasientene med hypofysær apopleksi blitt operert, men i tilfeller med stabil situasjon uten større synsfeltutfall eller hjernenerveutfall kan en konservativ tilnærming være en like god løsning. Dette blir i økende grad valgt. Pasienten må da monitoreres nøye klinisk og med synsfeltundersøkelser slik at man kan intervenere ved forverring. Dersom svulsten er et prolaktinom, er sannsynligheten stor for god respons på medikamentell behandling med dopaminagonist. Dette taler for konservativ behandling. Beslutningen om å velge konservativ eller kirurgisk tilnærming bør fattes av et multidisiplinært team. Den viktigste behandlingen initialt er rask tilførsel av kortikosteroider, hemodynamisk stabilisering og korreksjon av elektrolyttforstyrrelser. Ved nedsatt bevissthet eller økende synstap bør pasienten opereres som øyeblikkelig hjelp. Alle pasienter må følges opp av endokrinolog i etterkant med tanke på observasjon og substitusjonsbehandling for hormonforstyrrelser (8).
Denne kasuistikken understreker viktigheten av å utrede og observere pasienter med kraftig, akutt oppstått og vedvarende hodepine på en systematisk måte. Det kan være vanskelig å stille riktig diagnose. I vårt tilfelle tok det fem dager. Vi hadde slått oss til ro med utførte CT-undersøkelser hvor det var oversett forandringer i hypofysen. Da det tilkom begynnende diplopi tredje dagen, kunne man tenkt på patologi ved basis av hjernen. Først da det oppsto klinisk tydelig abducensparese og begynnende hyponatremi den fjerde dagen, ledet det tankene i retning av diagnosen. Tverrfaglig diskusjon mellom nevrolog, indremedisiner og radiolog var viktig.
MR caput er en viktig undersøkelse som burde vært utført tidligere ved en akutt, uavklart nevrologisk tilstand som denne. Da undersøkelsen til slutt ble rekvirert, tok det ytterligere et døgn før den ble gjennomført. Ved vårt sykehus er det begrenset MR-kapasitet, og henvisninger må prioriteres nøye basert på gode kliniske opplysninger. Det kan i tillegg være vanskelig å få gjennomført MR-undersøkelsen til ønsket tid på grunn av stor pågang av øyeblikkelig hjelp-undersøkelser. Innlagte pasienter har kun tilgang til MR på dagtid og ikke i helgene. Både klinikere og radiologer ønsker økt MR-kapasitet, men dette er vanskelig innenfor dagens økonomiske rammer.
En annen lærdom fra denne sykehistorien er at regranskning av tidligere utførte radiologiske undersøkelser i lys av ny klinisk informasjon kan føre til at man oppdager patologi som har blitt oversett.