Infertilitet rammer om lag 10 % av alle par (1). Forekomsten er økende. Parallelt stiger behovet for og bruken av fertilitetsbehandling. Antall barn unnfanget ved denne behandlingen har nå passert åtte millioner på verdensbasis (2).
Assistert befruktning er definert av bioteknologiloven. Begrepet omfatter både teknikker for befruktning av egg utenfor kroppen og for inseminasjon. Befruktning av egg utenfor kroppen inkluderer in vitro-fertilisering (IVF) og mikroinjeksjon (intracytoplasmic sperm injection, ICSI) (3). Teknikkene forutsetter hormonstimulering av kvinnen som gir en kontrollert ovarial hyperstimulering med simultan modning av flere egg og en hormonell induksjon av eggmodning (figur 1). Hormonstimulering gjøres vanligvis med gonadotropiner. Antiøstrogener som klomifensitrat eller letrozol brukes også i enkelte tilfeller. Selv om førstnevnte preparat nå er avregistrert, kan det forskrives på registreringsfritak.
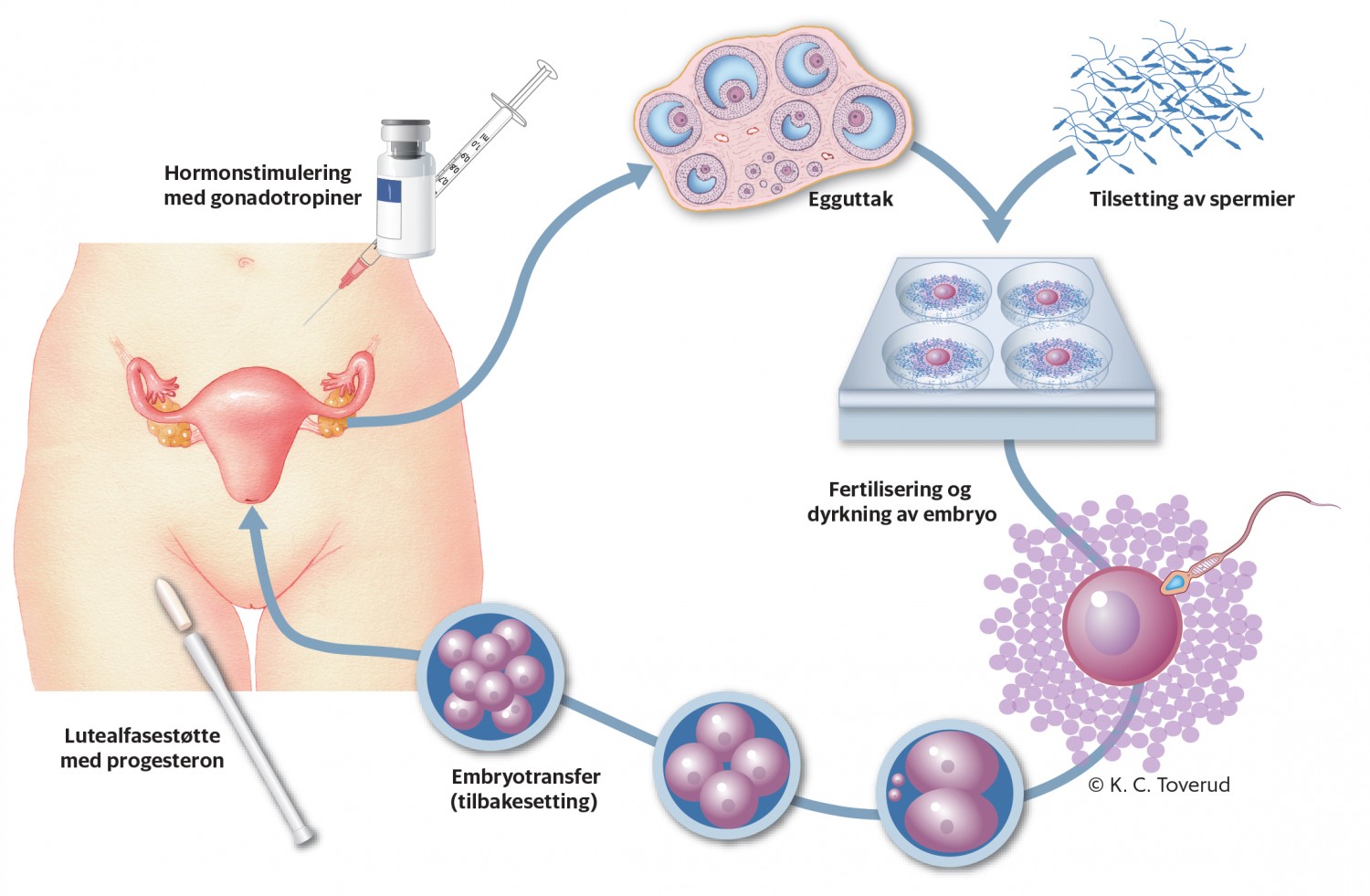
Figur 1 Fertilitetsbehandling med in vitro-fertilisering.
Hormonbehandlingen gir korte perioder med unormalt høye nivåer av gonadotropiner, østrogen og progesteron (4). Disse hormonene er tidligere vist å være knyttet til økt risiko for flere kreftformer (5, 6). Fertilitetsbehandlingen innebærer dessuten at flere follikler punkteres og aspireres. Dette gir skader i eggstokkapselen og muligens celleforandringer med økt risiko for senere kreftutvikling (7). Teorien understøttes av epidemiologiske studier som har vist at kvinner med lengre opphold av eggløsning har lavere risiko for eggstokkreft (8). Barn unnfanget ved fertilitetsbehandling er på sin side vist å ha økt risiko for perinatale komplikasjoner (9), kongenitale malformasjoner (10), somatisk sykdom (11) og kreft (12–14).
I denne oversiktsartikkelen oppsummerer vi kunnskapsgrunnlaget for kreftrisiko hos kvinner etter fertilitetsbehandling og hos barn unnfanget gjennom fertilitetsbehandling.
Kunnskapsgrunnlag
Vi søkte i databasene EMBASE og Medline med søkeord for assistert befruktning i kombinasjon med kreft (se appendiks for søkestrategi og nøkkelord). Søket ble avsluttet 15.11.2017 og var avgrenset til originale, engelskspråklige artikler publisert etter 1.1.2006. Vi inkluderte artikler som omhandlet kvinner som hadde gjennomgått fertilitetsbehandling med hormoner og barn unnfanget etter slik behandling.
Søket ga 3 045 titler, som ble gjennomgått av alle tre forfatterne uavhengig av hverandre (figur 2). Totalt 282 titler ble vurdert som relevante av én eller flere av forfatterne, og disse sammendragene ble lest av alle. Deretter ble 64 artikler valgt ut og lest i fulltekst. Av disse ble følgende artikler ekskludert: 22 fordi de var pasient-kontroll-studier eller ikke omhandlet problemstillingen, 14 fordi de omhandlet eldre typer behandling (1960- og 70-årene), 3 ble ekskludert fordi de ikke sammenlignet risiko hos eksponerte med ueksponerte eller brukte overlappende data fra senere studier, og 2 artikler ble ekskludert fordi type eksponering ikke var tilstrekkelig oppgitt. Referanselister fra 11 oversiktsartikler ble gjennomgått uten ytterligere funn. Totalt ble oversikten basert på 23 originalartikler. Studiene er heterogene, og vi har derfor ikke gjort noen formell sammenligning eller metaanalyse på alle data samlet.
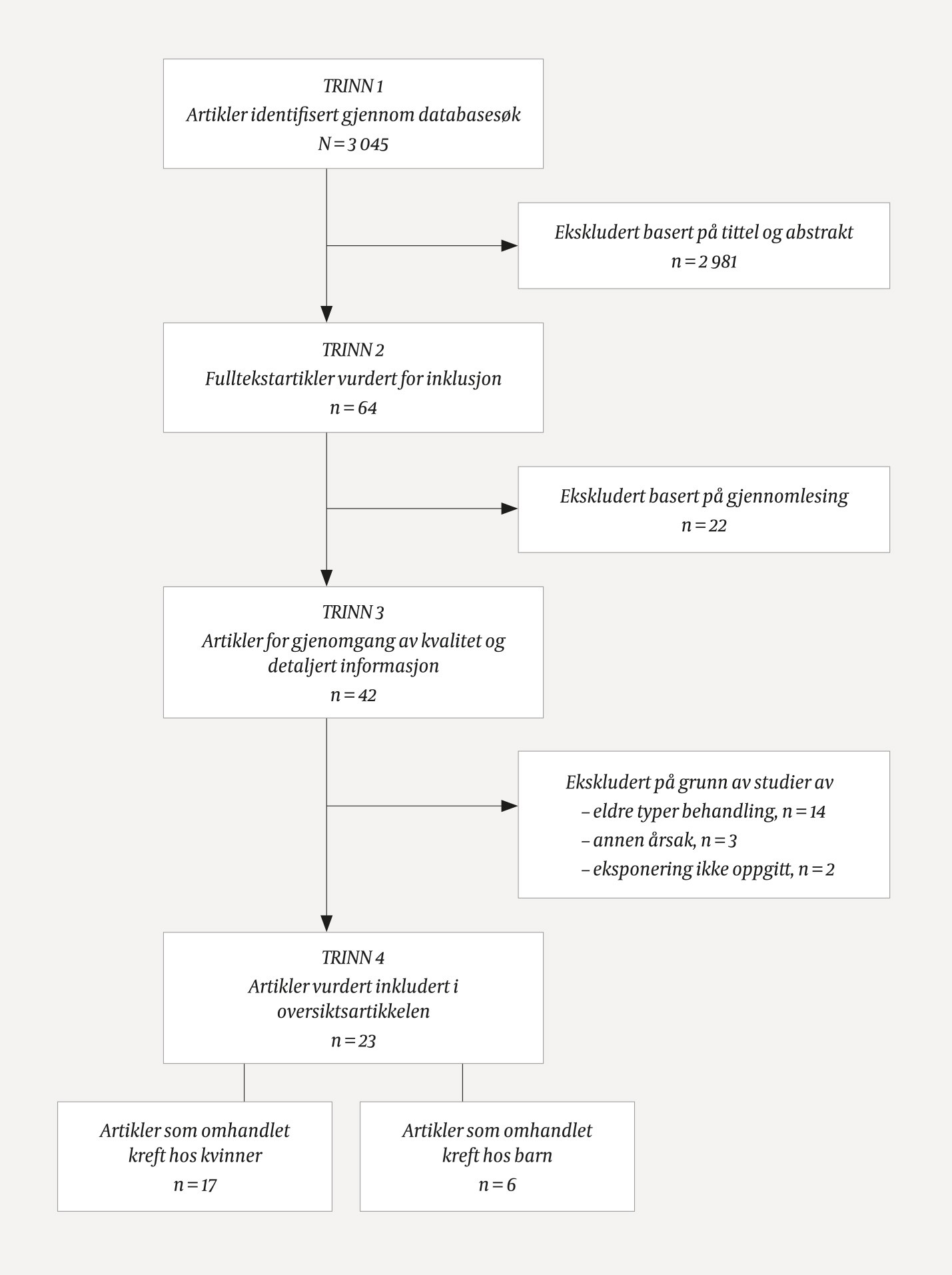
Figur 2 Flytskjema av litteratursøk og grunnlaget for utvelgelse av relevante kohortstudier.
Resultater
17 kohortstudier om kreftrisiko hos kvinner etter fertilitetsbehandling ble inkludert. Tabell 1–3 gir en oversikt over studiene der man har undersøkt brystkreft (15–22), livmorkreft (19, 20, 22–24) og eggstokkreft (19–21, 25–28). I fire av studiene undersøkte man den totale kreftrisikoen (19–21, 24) og i tre studier ble andre kreftformer undersøkt (29–31). Seks artikler omhandlet kreftrisiko hos barn født etter fertilitetsbehandling (32–37). I alle var det sett på totalforekomst av kreft. I tillegg ble i fem av artiklene tall for ulike krefttyper rapportert separat (tabell 4).
Tabell 1
Kohortstudier om brystkreftrisiko hos kvinner som har fått fertilitetsbehandling. HR = hasardratio, OR = oddsratio.
|
Studie
|
Land
|
Antall krefttilfeller / antall eksponerte
|
Antall
krefttilfeller /
antall ikke-eksponerte
|
Risiko (95 % KI)
|
Oppfølgingstid, år
|
|
Lundberg, 2018 (18)
|
Sverige
|
262/38 047
|
13 152/1 302 164
|
HR 0,84 (0,74–0,95)
|
9,6 (gjennomsnitt)
|
|
Reigstad, 2017 (20)
|
Norge
|
112/31 675
|
6 578/1 322 049
|
HR 1,00 (0,81–1,22)
|
11 (median)
|
|
van den Belt-Dusebout, 2016 (15)
|
Nederland
|
619/19 158
|
220/5 950
|
HR 1,01 (0,86–1,19)
|
21,1 (median)
|
|
Reigstad, 2015 (17)
|
Norge
|
138/16 626
|
7 899/792 208
|
HR 1,20 (1,01–1,42)1
|
16,0 (median)
|
|
Brinton, 2013 (22)
|
Israel
|
389/2
|
133/2
|
HR 0,90 (0,71–1,15)
|
8,1 (gjennomsnitt)
|
|
Yli-Kuha, 2012 (19)
|
Finland
|
55/9 175
|
60/9 175
|
OR 0,93 (0,62–1,40)
|
7,75 (gjennomsnitt)
|
|
Stewart, 2012 (16)
|
Australia
|
23/7 381
|
32/13 644
|
HR 1,10 (0,88–1,36)
|
16 (gjennomsnitt)
|
|
Källén, 2011 (21)
|
Sverige
|
91/24 058
|
13 492/1 394 061
|
OR 0,76 (0,62–0,94)
|
8,3 (gjennomsnitt)
|
Tabell 2
Kohortstudier publisert siden 2006 som har undersøkt risiko for livmorkreft hos kvinner som har fått fertilitetsbehandling. HR = hasardratio, OR = oddsratio.
|
Studie
|
År
|
Land
|
Antall krefttilfeller /
antall eksponerte
|
Antall
krefttilfeller / antall ikke-eksponerte
|
Risiko (95 % KI)
|
Oppfølgingstid, år
|
|
Reigstad (20)
|
2017
|
Norge
|
12/31 675
|
565/1 322 049
|
HR 0,76 (0,40–1,45)
|
11 (median)
|
|
Kessous (23)
|
2016
|
Israel
|
10/4 363
|
51/101 668
|
HR 4,6 (1,4–15,0)1
|
11,6 (gjennomsnitt)
|
|
Reigstad (17)
|
2015
|
Norge
|
5/16 525
|
626/789 723
|
HR 0,69 (0,28–1,68)
|
15,9 (median)
|
|
Brinton (22)
|
2013
|
Israel
|
34/2
|
7/2
|
HR 1,94 (0,73–5,12)
|
8,1 (gjennomsnitt)
|
|
Yli-Kuha (19)
|
2012
|
Finland
|
4/9 175
|
2/9 175
|
OR 2,0 (0,37–10,9)
|
7,75 (gjennomsnitt)
|
Tabell 3
Kohortstudier publisert siden 2006 der man har undersøkt risiko for eggstokkreft hos kvinner som har fått fertilitetsbehandling. HR = hasardratio, OR = oddsratio.
|
Studie
|
År
|
Land
|
Antall krefttilfeller / antall eksponerte
|
Antall krefttilfeller / antall ikke-eksponerte
|
Risiko
(95 % KI)
|
Oppfølgingstid, år
|
|
Reigstad (20)
|
2017
|
Norge
|
16/31 675
|
615/1 322 049
|
HR 1,62 (0,78–3,35)
|
11 (median)
|
|
Kessous (23)
|
2016
|
Israel
|
7/4 363
|
51/101 668
|
HR 3,9 (1,2–12,6)1
|
11,6 (gjennomsnitt)
|
|
Reigstad (17)
|
2015
|
Norge
|
16/16 525
|
800/789 723
|
HR 1,56 (0,94–2,60)
|
15,6 (median)
|
|
Brinton (22)
|
2013
|
Israel
|
34/2
|
11/2
|
HR 0,90 (0,45–1,79)
|
8,1 (gjennomsnitt)
|
|
Stewart (28)
|
2013
|
Australia
|
16/7 548
|
22/14 098
|
HR 1,36 (0,71–2,62)
|
17 (gjennomsnitt)
|
|
Trabert (26)
|
2013
|
USA
|
8/952
|
77/8 873
|
RR 1,0 (0,48–2,08)
|
21,9 (gjennomsnitt)
|
|
Yli-Kuha (19)
|
2012
|
Finland
|
9/9 175
|
3/9 175
|
OR 2,57 (0,69–9,63)
|
7,75 (gjennomsnitt)
|
|
Källén (21)
|
2011
|
Sverige
|
26/24 058
|
1 753/1 394 061
|
OR 2,09 (1,39–3,12)1
|
8,3 (gjennomsnitt)
|
|
Van Leeuwen (25)
|
2011
|
Nederland
|
61/19 146
|
16/6 006
|
HR 1,14 (0,54–2,41)
|
14,7 (median)
|
Tabell 4
Kohortstudier om kreftrisiko hos barn unnfanget ved fertilitetsbehandling. HR = hasardratio, RR = relativ risiko, SIR = standardisert insidensrate, OR = oddsratio
|
Studie
|
Land
|
Kreftdiagnose
|
Antall
krefttilfeller / antall eksponerte
|
Antall krefttilfeller / antall ikke-eksponerte
|
Risiko (95 % KI)
|
Oppfølgingstid år
|
|
Wainstock, 2017 (33)
|
Israel
|
Alle diagnoser
|
7/2 603
|
415/237 863
|
HR 1,96 (1,14–3,36)1
|
10,5 (median)
|
|
Reigstad, 2016 (35)
|
Norge
|
Alle diagnoser
Leukemi
Kreft i sentralnervesystemet
|
51/25 782
17/25 782
12/25 782
|
4 503/1 602 895
1 029/1 602 895
1 007/1 602 895
|
HR 1,21 (0,90–1,63)
HR 1,67 (1,02–2,73)1
HR 1,25 (0,71–2,21)
|
6,9 (median)
|
|
Lerner-Geva, 2017 (36)
|
Israel
|
Alle diagnoser
Leukemi
Kreft i sentralnervesystemet
|
21/9 042
2/9 042
2/9 042
|
361/211 763
92/211 763
70/211 763
|
RR 1,18 (0,80–1,75)
RR 0,44 (0,14–1,40)
RR 0,50 (0,20–1,24)
|
10,6 ikke eksponert 9,3 eksponert
(median)
|
|
Sundh, 2014 (34)
|
Nordiske land
|
Alle diagnoser
Leukemi
Kreft i sentralnervesystemet
|
181/91 796
61/91 796
42/91 796
|
638/358 419
638/358 419
114/358 419
|
HR 1,08 (0,91–1,27)
HR 1,06 (0,80–1,41)
HR 1,44 (1,01–2,05)1
|
9,5 (gjennomsnitt)
|
|
Williams, 2013 (32)
|
Storbritannia
|
Alle diagnoser
Leukemi
Kreft i sentralnervesystemet
|
108/106 013
34
22
|
109,7 (forventet)
37,5 (forventet)
25,8 (forventet)
|
SIR 0,98 (0,81–1,19)
0,91 (0,63–1,27)
0,85 (0,54–1,29)
|
6,6 (gjennomsnitt)
|
|
Källén, 2010 (37)
|
Sverige
|
Alle diagnoser
Leukemi
Kreft i sentralnervesystemet
|
53/26 692
18 (observert)
15 (observert)
|
6 405/2 417 878
12,3 (forventet)
8,1 (forventet)
|
OR 1,45 (1,10–1,91)1
2
2
|
Ikke oppgitt
|
Brystkreft
Av åtte kohortstudier viste fem ingen sammenheng mellom fertilitetsbehandling og risiko for brystkreft (tabell 1).
Studier utenfor Norden hadde i hovedsak tall fra sykehuskontroller (15, 16, 18). Ingen fant sammenheng mellom behandling og brystkreftrisiko. Studiene utført i Norden (17–21), hadde tall fra sentrale folkeregistre. I to svenske studier fant man signifikant redusert risiko for brystkreft (18, 21), mens man i én norsk studie fant signifikant økt risiko (17). Gjennomsnittlig oppfølgingstid i de svenske studiene var 8,3–9,6 år. I Norge var median oppfølgingstid nesten 16 år (17). Den første av de svenske studiene (21) hadde informasjon om eksponering fra alle in vitro-fertiliseringsklinikkene, informasjon om alle barnefødsler fra medisinsk fødselsregister og informasjon om krefttilfellene fra Kreftregisteret. En nyere svensk studie (18) hadde mer detaljert informasjon om eksponering fra flere registre.
I en av de norske studiene, med informasjon om eksponering fra medisinsk fødselsregister, fant man signifikant høyere risiko for brystkreft blant kvinnene som ble gravide etter fertilitetsbehandling (17). I den siste norske studien, som brukte eksponeringsinformasjon fra Reseptregisteret, ble det ikke funnet økt risiko for brystkreft, verken hos kvinner med eller uten barn (20), med unntak av forhøyet risiko blant en undergruppe kvinner som fødte etter behandling med klomifensitrat.
Livmorkreft
I fire av fem kohortstudier (tabell 2) fant man ingen signifikant sammenheng mellom fertilitetsbehandling og livmorkreft (19, 20, 22, 24). En israelsk studie (23), derimot, viste en signifikant fem ganger forhøyet risiko. I undergruppeanalyser i den nyeste norske studien (20) ble det sett økt risiko for livmorkreft hos kvinner som var eksponert for mer enn seks sykluser med klomifensitrat, og hos kvinner som forble barnløse etter behandling.
Eggstokkreft
Syv av ni kohortstudier (tabell 3) viste ingen signifikant økning av risiko for eggstokkreft blant fertilitetsbehandlede kvinner, mens to rapporterte signifikant økt risiko (21, 23). I en av studiene fant man økt risiko for kreft i eggstokkene etter in vitro-fertilisering, men risikoen var, overraskende, enda høyere før kvinnene fikk behandling enn etterpå (21). Dette mente forfatterne kunne forklares med at kvinnene hadde en økt risiko både for å være infertile og å utvikle eggstokkreft (21). De høyeste risikoestimatene ble funnet i en studie fra Israel, der man så en nær fire ganger høyrere risiko for eggstokkreft hos kvinner som hadde fått fertilitetsbehandling og født barn på et medisinsk senter (23). Det ble ikke funnet signifikant sammenheng mellom fertilitetsbehandling og eggstokkreft i de to norske studiene, men undergruppeanalyser viste at kvinner som hadde primær infertilitet hadde signifikant forhøyet risiko (24). Det samme gjaldt kvinner behandlet med klomifensitrat alene og kvinner som ikke fikk barn (20).
Risiko for borderlinesvulster i eggstokkene blant kvinner som har fått fertilitetsbehandling, var økt i fire studier, inkludert den norske (19, 20, 25, 27).
Andre kreftformer
En australsk studie viste ingen økt risiko for malignt melanom (29), og i to nederlandske studier ble det ikke påvist økt risiko for verken malignt melanom eller tykk- og endetarmskreft (30, 31). I fire studier der man så på den samlede kreftrisikoen, fant man ingen økt risiko for kreft forbundet med fertilitetsbehandling (19–21, 24).
Barnekreft
Tabell 4 viser resultater for alle barnekreftformer samlet og for leukemi og kreft i sentralnervesystemet, som er de vanligste kreftformene hos barn. I to studier fant man forhøyet risiko for alle diagnoser samlet (33, 37), mens alle studiene viste signifikant forhøyet risiko for én eller flere kreftformer.
I Norge og Sverige viste resultatene at det var flere leukemitilfeller blant barn født etter assistert befruktning enn det som var forventet ut ifra forekomsten i befolkningen (35, 37). I Israel (36), Storbritannia (32) og de øvrige nordiske landene fant man ingen økt risiko for leukemi (34). Mindre konsistente funn rapporteres vedrørende risiko for kreft i sentralnervesystemet (34), hepatoblastom og rabdomyosarkom (32) samt retinoblastom og nyresvulster (36).
Diskusjon
I hovedtrekk kan man si at fertilitetsbehandling ikke gir en generelt økt kreftrisiko verken for kvinner eller barn.
I denne oversiktsartikkelen inkluderte vi studier fra perioden 2006–17. Årsaken til denne begrensningen er at siden sist litteraturgjennomgang (38) er det publisert en rekke nye studier. Behandlingen har også endret seg over tid, og vi ønsket med denne begrensningen å inkludere studier med mer ensartet eksponering. Likevel viste det seg at studiene var relativt ulike med hensyn til metodiske forhold. Noen studier tok høyde for alder, infertilitetsdiagnose og antall barn kvinnene fikk etter behandling eller om de forble barnløse. Andre studier manglet slik informasjon. I tillegg er det svært viktig å kontrollere for overvekt i forbindelse med livmorkreft, noe de fleste studiene ikke gjorde.
En styrke ved de nordiske studiene er at de har benyttet seg av data fra populasjonsbaserte registre, og i tillegg var dataene analysert på individnivå. En svakhet i det norske datamaterialet er at det ikke eksisterer et nasjonalt, syklusbasert register over fertilitetsbehandling. Dette bør man etablere. I det norske Kreftregisteret er komplettheten vist å være nær 100 % (39). Kvalitet og kompletthet er imidlertid ikke like god i alle land (40). I den israelske studien (23) inkluderte forfatterne bare krefttilfellene som var diagnostisert ved samme senter som studiepopulasjonen var hentet fra, og dette er en klar svakhet.
I de nordiske kohortstudiene sammenlignes risikoen for behandlede kvinner med risikoen i den generelle populasjonen. Flere av studiene utenfor Norden har fått data fra infertilitetsklinikker, og har da kunnet sammenligne risikoen for kreft hos kvinner som har fått fertilitetsbehandling med risikoen hos ubehandlede infertile kvinner. For å se effekten av fertilitetsbehandling alene burde man ideelt sett gjøre sistnevnte. Dette er vanskelig i praksis, fordi det vil forekomme en seleksjon av kvinner til behandling, som gjør disse to gruppene ulike. I tillegg er infertile eller barnløse kvinner en heterogen gruppe, og ulike infertilitetsdiagnoser kan i seg selv være forbundet med økt kreftrisiko. For eksempel er endometriose muligens assosiert med høyere risiko for eggstokk- og livmorkreft (41, 42).
En annen viktig utfordring er studiestørrelse og oppfølgingstid. Mange av de inkluderte studiene har få krefttilfeller i den eksponerte gruppen, og flere av studiene har kort oppfølgingstid. Særlig gjelder dette livmorkreft, som i hovedsak rammer eldre kvinner (60–70 års alder).
Konklusjon
Det er ingen klar økt risiko for kreft hos kvinner behandlet med fertilitetsbehandling eller barn unnfanget etter slik behandling.
Siden andelen av kvinner som behandles for infertilitet er økende, er det nødvendig å overvåke deres og barnas helse, kreftsykdom inkludert. Derfor er det fortsatt behov for gode kohortstudier med lengre oppfølgingsperioder.
