De siste 40 år har kreftoverlevelsen hos barn økt fra ca. 15 % til 75 %. Gevinsten er nå 7 000 ekstra leveår for et årskull barn med kreft i Norge. Det skyldes nye behandlingsmetoder, opprettelsen av barneonkologiske sentre, internasjonale barneonkologiske organisasjoner og multisenterstudier som omfatter diagnostikk, behandling og oppfølging. For å få til en ytterligere forbedring av resultatene trengs det bemanningsøkning og videreutvikling og kvalitetssikring av forpliktende deltakelse i multisenterstudier.

Når det er fest, er sykdomsplager og harde cellegiftkurer glemt. Gjengitt med tillatelse fra barnas foreldre. Foto Kliti Komselis
I Norge får 140 barn under 15 år kreft hvert år. Tallet gir et feilaktig inntrykk av at pasientgruppen ikke er ressurskrevende. Prisen for de store fremskrittene innen barneonkologien har vært økt ressursbruk og større belastning for personalet (1 – 5). Selv om vi i Norge så langt har vært blant de beste når det gjelder kreftoverlevelse hos barn (2, 3), betyr ikke det at vi kan slå oss til ro med situasjonen. Ytterligere bedring av resultatene basert på deltakelse i multisenterstudier forutsetter mer ressurser. Det nærmer seg et generasjonsskifte blant norske barneonkologer. Dette og andre faktorer krever økt rekruttering både til barneonkologien og til støttedisiplinene.
Historikk
De gode resultatene innen kreftoverlevelse hos barn er oppnådd ved opprettelse av barnekreftsentre og via samarbeid i multisenterstudier. Et barneonkologisk senter har ressurskrevende oppgaver, behov for spesielle fasiliteter og innebærer høyt spesialisert tverrfaglig samarbeid (6). Det er ikke mulig for et mindre sykehus å ta hånd om barneonkologi. Oppgaven er derfor lagt til regionsykehusene, men barnets nærmeste lokale barneavdeling har en viktig funksjon for å gjennomføre så mye som mulig nær hjemmet.
Før 1960 ble 15 % av barna helbredet. Internasjonale barnekreftorganisasjoner med kompetansenettverk og infrastruktur for drift av multisenterstudier ble opprettet i 1960- og 70-årene. Nordisk forening for pediatrisk hematologi og onkologi (NOPHO) åpnet sin første multisenter leukemiprotokoll i 1981 (1, 7, 8). De fleste barn med kreft inkluderes nå i en internasjonal multisenterprotokoll. Nye protokoller blir stadig mer spesifikke innen alle fagområder. De første protokollene hadde ti sider. Det er nå ca. 40 forskjellige protokoller for barn med kreft – hver av dem på 150 – 350 sider. En multisenterprotokoll beskriver hvordan diagnosen stilles og hvordan barna behandles og kontrolleres. Bak hver protokoll står det en hovedarbeidsgruppe og flere underarbeidsgrupper, som assisterer hovedarbeidsgruppen. Protokollene fornyes hvert 5. – 10. år, som er den tid det tar å samle tilstrekkelig med data fra barn med en og samme kreftsykdom for å kunne vurdere hvilken behandling som gir best resultater. I Norge er det innen barneonkologi etablert et formalisert nettverkssamarbeid mellom regionsykehusene. Tre faggrupper er pålagt kvalitetssikringsoppgaver (9, 10). Fra å være et nærmest ikke-eksisterende fagfelt i 1960- og 70-årene har barneonkologien utviklet seg til et av de mest ressurskrevende innen barnemedisinen.
Barnekreft
Kreft hos barn er ofte utgått fra primitive celletyper. Den har aggressiv vekst, sprer seg tidlig og er som oftest følsom for medikamentell behandling (4). Barnekreft kan være medfødt eller kan oppstå i hele barnealderen. Gjennomsnittsalder ved diagnosetidspunkt er seks år. Det har vært vanskelig å dokumentere hvilken betydning miljøfaktorer har. Behandlingen må ta hensyn til at legemiddelomsetning og sårbarhet for bivirkninger endrer seg opp gjennom barneårene. Barnets vekst- og utviklingsprosess og spesielle psykososiale situasjon må vernes om. Barnekreft er i stor grad øyeblikkelig hjelp-medisin. Få dagers forsinkelse i behandlingen av aggressive kreftformer kan føre til lavere overlevelse (11).
Når det er mistanke om kreft hos et barn, oppstår det en krisesituasjon i hele familien. Barnet og foreldrene legges som regel inn i barneavdelingen ved et regionsykehus samme dag, og barnets base er heretter kreftavsnittet her. Det er viktig at det straks etableres god kommunikasjon mellom fagpersoner og familien når de kommer til barneavdelingen. Etter påvist kreft avsluttes relasjonen tidligst 10 – 15 år senere. En vellykket og tillitsfull kommunikasjon er avhengig av at involverte fagpersoner gir sammenfallende kunnskapsbasert informasjon, viser empati, har tid og er tilgjengelige. Ved ukomplisert behandlingsforløp avtar informasjonsbehovet utover i behandlingsfasen. Ved sykdomsevalueringer, komplikasjoner, mistanke om tilbakefall og når seneffektene opptrer øker informasjonsbehovet igjen.
Faggruppene
Barneonkologen er spesialist i barnesykdommer, med videreutdanning i onkologi og hematologi. Foruten spesialiseringskurs i Norge og utdanningsstillinger ved barnekreftavsnittene har NOPHO etablert et fellesnordisk kursopplegg. Et europeisk utdanningsforslag er godkjent. Det tar mange år å bli erfaren barneonkolog. Barneonkologene må parallelt med klinisk virksomhet og kvalitetssikring lokalt også delta i nasjonale, nordiske og internasjonale faggrupper og arbeidsgrupper for de forskjellige kreftformene. De norske ekspertene i de nasjonale tverrfaglige faggruppene møtes regelmessig og utarbeider felles nasjonale handlingsprogrammer og koordinerer deltakelse i ulike nordiske og internasjonale prosjekter og protokoller. Ressurser til nødvendig kontinuerlig oppdatering og nettverksinformasjon er essensielt. Det er ofte formelt og uformelt nettverkssamarbeid mellom barneonkologer og andre involverte spesialister rundt den enkelte pasient. De nasjonale barneonkologiske koordinatorene driver også et omfattende arbeid med etablering av nye protokoller. Dette skyldes de økte kravene nasjonalt og innen EU innen biomedisinsk forskning.
Oppgavene med diagnostikk og behandling av kreft hos barn er svært komplekse og krever daglig koordinasjon av spesialister, utstyr og prosedyrer. Kreftsykdommen, behandlingen og kompliserende faktorer må evalueres og registreres. Barneonkologene må iverksette individuelle protokollmodifikasjoner når det oppstår hendelser som ikke er beskrevet i protokollene. Få leger utenom barneonkologene kjenner barnekreftprotokollene. Barneonkologene koordinerer tidspunkt for prosedyrer ved andre avdelinger som ledd i den flermodale protokollerte diagnostikk og behandling. For sjeldne tilstander der det ikke finnes etablert standardbehandling, må det flermodale teamet støtte seg til det nasjonale og internasjonale nettverk i tillegg til litteraturen.
Sykepleiere og støtteapparat
Pasientansvarlig sykepleier og prosjektsykepleier følger barnet, foreldrene og søsknene i behandlingsperioden og har en høyt spesialisert funksjon knyttet til kjemoterapi og støttebehandling. Sykepleierne er sentrale i det tverrfaglige arbeidet og er ofte koordinerende bindeledd til primærhelsetjenesten og hjelpeapparatet.
Under innleggelsene får alle barn tilbud om leketerapi og skolegang. Sykehusskolen har kontakt med skolen på hjemstedet og får om nødvendig igangsatt hjemmeundervisning mellom innleggelsene. Familien orienteres og settes i kontakt med psykolog, sosionom, sykepleiekonsulent, prest, tannpleier, ernæringsfysiolog og frisør. Ulike tiltak kan bedre tilværelsen for barn og foreldre både under sykehusoppholdet og på hjemstedet. Sykepleiere med spesialkompetanse reiser til hjemstedet og informerer i barnehage og skole, ofte sammen med barn og foreldre.
Diagnostikk og evaluering
Alle barn med kreftsykdom må gjennom et omfattende utredningsprogram. Man forsøker å unngå unødige smerter og har god hjelp av sentralvenøse katetre, sedasjon og narkose. Vevsprøver av tumor tas ofte som nålebiopsi/cytologiske prøver, noen ganger som åpen biopsi av kirurg eller perkutant av radiolog. Prosedyrene må koordineres, som oftest med tilstedeværelse av anestesiolog, anestesisykepleier, cellebiolog, cytotekniker, patolog og barneonkolog.
Organfunksjonsundersøkelser av nyrer, hjerte, hørsel og nervesystem må ofte repeteres for å balansere behandlingen mot bivirkninger. Enkelte organer under vekst og utvikling er særlig sårbare for skader hos små barn.
Radiologiske undersøkelser
Utviklingen innen ultralyd-, CT- og MR-teknologi har de siste 10 – 15 år gjort det mulig å visualisere og karakterisere svulster i detalj, å kartlegge utbredelse og avgrensning mot naboorganer og kar og å utføre målrettet, bildeveiledet prøvetaking til patologisk-anatomisk undersøkelse. Den bildediagnostiske evalueringen er ofte kompleks og må utføres av radiologer med lang erfaring i slik diagnostikk. For å oppnå ytterligere standardisering nedsatte den europeiske foreningen for barneradiologi (ESPR) våren 2004 en arbeidsgruppe som skal utarbeide anbefalinger for bildediagnostikk ved barnesvulster, med henblikk på modalitet, undersøkelsesteknikk og kontrollintervaller.
Patologisk-anatomisk undersøkelse
Patologisk-anatomisk tumordiagnose er avgjørende for valg av riktig behandling. For 20 år siden var klassifikasjonen kun basert på vanlig lysmikroskopi. Utviklingen innen immunhistokjemi har gitt bedre klassifisering av maligne svulster og leukemi, men har gjort biopsiundersøkelsene mer ressurskrevende. Lite differensierte svulster hos barn blir som regel undersøkt med flere titalls immunologiske markører og må bedømmes av patolog med lang erfaring og kompetanse. Delmateriale sendes ifølge protokoll til revisjon til sertifiserte laboratorier i inn- og utland for enkelte tilleggsundersøkelser og mest mulig eksakt klassifikasjon. Norske barnepatologer møtes regelmessig for kvalitetssikring av tumordiagnosene, og deltar i internasjonalt samarbeid. Den immunologiske diagnostikken har i dag en fremtredende rolle i klassifikasjonen av leukemiene, dermed kan behandlingen rettes mer spesifikt mot den enkelte undertype. Undersøkelsesmetodene brukes også for å finne eventuell minimal restsykdom – dette kan øke sjansen for helbredelse gjennom intensivert behandling. Immunologiske undersøkelser utføres på celler fra beinmarg/tumor ved diagnosetidspunkt, ved responsevaluering og ved mistanke om tilbakefall.
Det er utviklet metoder for molekylærgenetisk diagnostikk ved flere forskjellige kreftformer. Foreløpig har dette størst betydning for leukemiene og enkelte solide svulster. Molekylærgenetisk diagnostikk har konsekvenser for valg av behandling og for prognose. Molekylærdiagnostikk og biobank er i økende grad et krav for å kunne delta i nye protokoller.
Mikrobiologi
Kjemoterapi svekker barnets immunforsvar i behandlingsperioden, og det er svekket i ett år etter avsluttet behandling. Infeksjonsrisikoen er stor. Ved feber i nøytropen fase må man starte sepsisbehandling uten mikrobiologisk diagnose og ta daglige prøver for eventuelt å identifisere et sykdomsfremkallende agens og for å justere antibiotikabehandlingen. Molekylærbiologiske analysemetoder gir økt sensitivitet og spesifisitet i infeksjonsdiagnostikken.
Behandling
Behandling av akutt lymfatisk leukemi kan vare i 2,5 år, den flermodale behandling for solide svulster i 1 – 1,5 år. Akutt myelogen leukemi og noen lymfatiske leukemier og lymfomer kan ha kortere høyintensiv behandling. Barna innlegges ca. 100 ganger i et behandlingsforløp (9), og er da ofte svært syke.
En forutsetning for dagens intensive kjemoterapi, støttebehandling og de hyppige blodprøvekontrollene er en veneport eller et Hickman-kateter, dvs. venetilgang som tunneleres under huden på overkroppen. Hos barn med hjernesvulster kan det i tillegg til reseksjon og eventuell strålebehandling og systemisk kjemoterapi være aktuelt med intratekal kjemoterapi direkte i hjerneventriklene via særskilt tilgang. Barn med leukemi får profylaktisk eller terapeutisk kjemoterapi i spinalkanalen ved jevnlige lumbalpunksjoner i narkose.
Cytostatikabehandling
Cytostatikabehandlingen gis oftest i blokker eller serier med planlagte intervaller. Beinmargen og andre følsomme organer må være restituert før en ny kur, men cytostatikapause omfatter ofte en krevende aplasifase etter forrige kur. Vi benytter 30 – 40 forskjellige cytostatika. Intensiteten av kjemoterapien er ofte på grensen av hva beinmargen kan tåle uten autolog stamcelletransplantasjon. Blodprøver vurderes alltid før, under og etter kjemoterapi. Figur 1 viser utviklingen i antall cytostatikakurer ved Barneklinikken i Bergen. Det har vært en betydelig økning inntil et foreløpig platå.
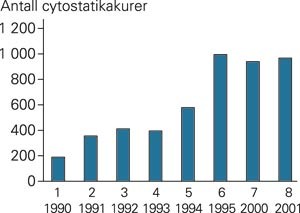
Utvikling i antall cytostatikakurer gitt ved Barneklinikken, Haukeland Universitetssjukehus, i perioden 1990 – 2001
Kirurgi
Nevrokirurgien er den viktigste faktor ved de fleste hjernesvulster, og kirurgi er viktig for helbredelse eller lokal kontroll ved mange andre maligne svulster. Tumorkirurgiske metoder har utviklet seg mye og har ved kreft i ekstremiteter ført til 80 % ekstremitetsbevarende inngrep der det tidligere var amputasjon. Forfinet bildediagnostikk og økt kunnskap om risikofaktorer, bl.a. for lokalt residiv, har hatt betydning for kirurgien. Kirurgen må være med i planleggingen allerede fra vevsprøvetaking og diagnose.
Strålebehandling
Overgangen til konformal strålebehandlingsteknikk har gitt mulighet for mer presis dosefordeling til målvolum og samtidig mer skånsom behandling i forhold til strålingsfølsomme organer. Grunnlaget for dette er teknologisk utvikling og større innsats av onkologene for definisjon av målvolum og kritiske organer i digitale bildematriser, samt mer arbeid sammen med stråleterapeuter og fysikere for å komme frem til den beste strålebehandlingsplanen. Brakyterapi – «innvendig strålebehandling» – kan være egnet, særlig som peroperativ prosedyre ved enkelte maligne svulster. Dette er en spesialisert behandlingsform der det for tiden ikke er noe tilbud i Norge. Stereotaktisk strålebehandling med gammakniv kan være aktuelt på spesielle indikasjoner. Tilpasset den aktuelle behandlingsprotokollen og kjemoterapiprogrammet koordinerer barneonkologene tidspunkt for start av behandlingsplanlegging og behandling. Strålebehandling krever ofte multiple små fraksjoner for å gi færrest mulig seneffekter. Ved enkelte tumorformer må pasienten få behandling flere ganger om dagen, noe som i seg selv er ressurskrevende. Mindre barn som ikke kan samarbeide om behandlingene, trenger sedasjon eller narkose av anestesiologisk team ved hver strålebehandling, ofte 25 – 40 ganger. Strålebehandling av kreft er en balansegang mellom effekt på tumor og bivirkninger. Hos barn blir balansegangen særlig vanskelig. Ressurskrevende nye behandlingsformer som partikkelstråling og intensitetsmodulert strålebehandling (IMRT) er under utvikling og ser ved noen indikasjoner ut til å kunne være mer skånsomt.
Støttebehandling
Økt behandlingsintensitet har medført behov for mer intensiv støttebehandling. Noen innleggelser skjer ved nærmeste barneavdeling. Barneonkologene har da rådgiverfunksjon.
Støttebehandlingen omfatter symptomlindring med farmaka som antiemetika, analgetika, antihistaminer, steroider, H₂-reseptorantagonister, protonpumpehemmere, benzodiazepiner og laksantia. Det gis ofte antibiotika, blodprodukter, væske, elektrolytter, hematopoetiske vekstfaktorer, noen ganger antiepileptika og antikoagulantia. Det er ofte behov for ernæringshjelp, enten via nasogastrisk sonde, perkutan gastrostomi eller parenteralt.
Polikliniske etterkontroller
Etterkontrollene for leukemier og solide svulster skjer henholdsvis månedlig og hver 2. – 3. måned. Intervallet øker med årene. Etter seks år er det årlige kontroller. I starten er man mest konsentrert om mulig residiv, senere er seneffekter viktigst. Kontrollene fortsetter i minst ti år eller til barnet er utvokst ved 18 – 20 års alder. Personer med risiko for spesielle seneffekter følges til langt opp i voksen alder. Omfanget av etterundersøkelsene er protokollert og tilpasset den kliniske situasjon og kan omfatte klinisk undersøkelse, radiologiske undersøkelser, blodprøver inkludert hormonanalyser, organfunksjon, vurdering av pubertetsutvikling, vekst og trivsel. Etter hjernesvulst utføres jevnlig nevropsykologisk testing med anvisning om hjelpetiltak. Rehabilitering etter kirurgiske rekonstruksjoner og amputasjoner pga. svulster i ekstremiteter omfatter livslang flerdisiplinær oppfølging, inklusive tilpasning av proteser. I 2000 hadde Barneklinikken i Bergen 1 092 polikliniske barneonkologiske konsultasjoner. Grunnet stadig flere langtidsoverlevere vil antallet fortsatt øke.
Hvordan bli bedre?
Flere forbedringsmomenter er foreslått i ny nasjonal kreftplan (9, 10). Ved kreft hos barn er beste standardbehandling som regel inklusjon i internasjonale protokoller. For flere onkologiske tilstander er det ofte nødvendig med akutt behandling og overvåking i intensivavdeling. Hendelsene kan ikke døgn- eller årstidsreguleres. Det er små marginer mellom suksess og tragedie. Barneonkologisk ekspertise og/eller pasientkjennskap er ofte en viktig forutsetning. I dag er det intet barneonkologisk senter i Norge som har ressurser til døgnkontinuerlig barneonkologisk vaktberedskap. Av hensyn til pasientsikkerheten må målet være egne vaktordninger for barneonkologi.
Økt rekruttering er nødvendig. Det gjelder ikke bare barneonkologer, men også for andre personellgrupper innen diagnostikk og pleie. Mer sekretærhjelp vil bedre arbeidssituasjonen.
For fortsatt å kunne tilby kunnskapsbasert behandling på høyt nivå og i stor bredde kreves det mer ressurser – for å ivareta faglig fordypning, fagutvikling, videre- og etterutdanning av personell, pasientregistreringer til internasjonale protokoller og forskning. Mer individualiserte behandlingsregimer kan bli enda mer ressurskrevende, men forhåpentligvis ikke så bivirkningsbelastende.
Flere av barneavdelingene er ikke dimensjonert for å ta seg av barn og unge i alderen 15 – 18 år. Aldersgruppen som helhet har sine særegne medisinske og psykososiale utfordringer. Forutsetningen for at barneonkologien ved regionsykehusene kan utvikles optimalt, er at de aktuelle helseforetakene tilrettelegger infrastrukturen for forpliktende deltakelse i multisenterstudier, som er obligatorisk for god barneonkologi. I Tyskland er det et eget utvalg for inspeksjon av tilgjengelige fasiliteter og kompetanse for drift av multisenterstudier ved barnekreftsentrene (12). Mangelfulle fasiliteter for forpliktende protokollert behandling kan gi dårligere resultater og økt dødelighet (6, 11).
I Norden er det ingen etablert praksis for langtidsoppfølging av voksne som ble behandlet for kreft som barn (13). Den store andelen av langtidsoverlevere tilsier kartlegging av senvirkninger hos disse – dette både for å oppdage nye seneffekter med lang latenstid, som sekundær malign sykdom, og for å følge forløp og behandling ved allerede oppstått skade, f.eks. hormonsubstitusjonsbehandling ved nevroendokrine forstyrrelser og tiltak ved infertilitet. Livslang oppfølging anbefales spesielt til hjernesvulstpasienter som har fått strålebehandling, men også til andre grupper.
Skal det for norske barn i fremtiden være optimal sannsynlighet for helbredelse av kreft og samtidig lavest mulig risiko for seneffekter av behandlingen, må ressurstilgangen innen feltet økes betydelig nå. Rekruttering av barneonkologer må snarest settes i gang, ettersom det tar 5 – 10 år før en økning får effekt.