Høyt hemoglobinnivå med erytrocytose er en vanlig årsak til utredning. Vi presenterer en kvinne som samtidig hadde jernmangel, høy erytropoietinverdi og funn av monoklonale plasmaceller i beinmargsbiopsi. Utredningen for å finne årsaken til dette sammensatte sykdomsbildet ble svært omfattende.
En 50 år gammel kvinne ble henvist til medisinsk poliklinikk for utredning av høyt nivå av hemoglobin (Hb). Primærlegen hadde ved flere anledninger i løpet av to måneder påvist verdier høyere enn 17,0 g/100 ml. Samtidig forelå det lavt ferritinnivå og lavt gjennomsnittlig cellevolum i de røde blodcellene (MCV-verdi), men det var ikke målt erytrocyttvolumfraksjon (EVF).
Hun hadde 32 år tidligere blæremola og ble operert med fjerning av et ovarium. Det ble da gitt kjemoterapi i form av flere kurer med metotreksat og aktinomycin-D. Hun hadde menstruasjoner frem til 48 års alder, da uterus og gjenværende ovarium ble operativt fjernet. I begynnelsen av 40-årsalderen ble hun et par år behandlet med jern parenteralt på bakgrunn av påvist jernmangel, og senere fikk hun jern som tabletter. Hemoglobinverdien var på den tiden 12,5–13,5 g/100 ml, og hun kjente ikke til at hun tidligere hadde hatt så høye verdier som nå førte til utredning.
Ved konsultasjonen fortalte hun om økende plager med hodepine, ubehag og tørrhetsfølelse i øynene, episoder med sensibilitetsforstyrrelser i høyre ansiktshalvdel og kalde fingre. Blodtrykket var 180/110 mm Hg og organstatus normal. Ved senere kontroller var blodtrykket normalt. Hb var 17,8 g/100 ml, EVF 0,56 og erytrocytter 7,73 · 1012/l, alle forhøyet. MCV-verdien var 73 fl og ferritin 9 µg/l, begge nedsatt. Det var normale verdier for senkningsreaksjon (SR), retikulocytter, gjennomsnittskonsentrasjonen av hemoglobin i de røde blodcellene (MCHC), leukocytter, trombocytter, elektrolytter, lever- og galleprøver, kreatinin og vitamin B12. Blodutstryk ble bedømt til å være normalt. Serum-erytropoietinverdi var forhøyet til 48,7 IE/l.
Produksjon av erytropoietin foregår hovedsakelig i nyrene, mens en mindre andel produseres i leveren. Ved fallende oksygenkonsentrasjon i nyrene vil mer erytropoietin produseres og frigjøres fra peritubulære celler. Erytropoietinreseptorer finnes på umodne erytroide celler i beinmargen, og erytropoietin stimulerer disse til modning og proliferasjon og hindrer samtidig apoptose.
Forhøyet erytropoietinnivå talte imot polycythaemia vera (ramme 1) (1), da disse pasientene nærmest uten unntak har supprimerte verdier (2). Den påviste jernmangelen kunne neppe forklare økningen i erytropoietinverdi, da det er hypoksi, eventuelt som følge av anemi, som stimulerer til økt erytropoietinproduksjon. Det var ikke sannsynlig at jernmangelen kunne «nøytralisere» den supprimeringen av hormonet man vanligvis ser ved polycythaemia vera. Men muligheten for denne diagnosen måtte likevel utredes videre.
Ramme 1
Reviderte WHO-kriterier for polycythaemia vera (1)
Hovedkriterier:
Hemoglobin > 18,5 g/dl hos menn, > 16,5 g/dl hos kvinner, eller erytrocyttvolumfraksjon > 52 hos menn og > 48 hos kvinner, eller andre parametre som viser økt erytrocyttvolum
Funn av mutasjonen JAK2617VF eller en annen funksjonelt lik mutasjon som mutasjon i ekson 12 i JAK2-genet
Bikriterier:
Beinmargsbiopsi viser hypercellularitet i forhold til alder med trilineær vekst (panmyelose) med tydelig erytroid, myeloid og megakaryocyttisk proliferasjon
Serum-erytropoietinnivå under nedre referansegrense
Endogen erytroid kolonidanning in vitro
For diagnosen må begge hovedkriterier og ett bikriterium oppfylles, eller første hovedkriterium sammen med to bikriterier
Pasienten benektet inntak av erytropoietinholdige preparater. Hun hadde heller ikke kjennskap til andre tilfeller i familien der det var påvist forhøyet hemoglobinverdi. Andre årsaker til høy hemoglobin kunne foreligge, og det ble derfor tatt arteriell blodgass, EKG, røntgen thorax og ultralyd av milt og nyrer, men disse undersøkelsene viste normale funn og ga ikke holdepunkter for årsak til sekundær polycytemi.
Molekylærgenetisk undersøkelse med tanke på mutasjon i genet som koder for Janus kinase 2 (JAK2V617F) i ekson 14 på kromosom 9p var hos vår pasient negativ. I en studie ble mutasjonen påvist hos flere enn 97 % av pasientene med diagnosen polycythaemia vera (3).
Pasienten ble innlagt i medisinsk avdeling til utredning for en eventuell erytropoietinproduserende tumor. Det ble ikke påvist blod i avføringen. Blodprøvene var omtrent som ved den polikliniske konsultasjonen (tab 1), men laktatdehydrogenase (LD) var lett forhøyet. Haptoglobin ble ikke målt. I blodutstryk ble noen makrotrombocytter sett. SR var nå 0, og arteriell blodgass viste lett nedsatt pO2 til 9,9 kPa. Det var normale funn ved CT-undersøkelse av hals, thorax, abdomen og bekken, MR-undersøkelse av hypofysen var normal, gynekologisk undersøkelse var uten annen anmerkning enn det som fulgte av tidligere operasjoner. Verdiene for serum-paratyroideahormon (s-PTH) og plasma-PTH-relatert peptid var normale. Serum-erytropoietin var nå 55,7 IE/l, ferritin 11 µg/l, humant choriongonadotropin (HCG) 3 mIU/l, og stoffskiftet var normalt. Spirometrifunn og total diffusjonskapasitet var også normale.
|
Tabell 1 Pasientens blodverdier under sykdomsforløpet
|
|
Tidspunkt
|
Hb (g/100ml)
|
Erytrocytter (· 1012/l)
|
Erytrocyttvolumfraksjon
|
Erytropoietin (IE/l)
|
Ferritin (µg/l)
|
|
Første polikliniske konsultasjon
|
17,8
|
7,73
|
0,56
|
47,8
|
9
|
|
Tre måneder senere, ved innleggelse
|
17,4
|
7,47
|
0,53
|
55,7
|
11
|
|
Etter gjentatte blodtappinger
|
12,6
|
Ikke målt
|
0,42
|
90,2
|
7
|
|
Etter jerninntak
|
17,4
|
7,33
|
0,56
|
96,7
|
19
|
|
Etter nye blodtappinger
|
13,0
|
5,99
|
0,43
|
123,0
|
6
|
Pasientens diagnose var så langt polycytemi av ukjent årsak. Hun hadde plagsomme symptomer som kunne relateres til denne tilstanden, og det ble derfor i løpet av fire måneder utført blodtappinger til EVF falt til 0,42 og Hb til 12,6 g/100 ml, hvoretter pasientens symptomer nærmest forsvant. Også ved uttalte sekundære polycytemier der det oppstår plagsomme polycytemirelaterte symptomer, kan man foreta blodtappinger. Man fant det ikke korrekt å gi pasienten jerntilskudd så lenge tilstanden ikke var avklart, og jerntilskudd gis heller ikke ved polycythaemia vera og jernmangel.
Siden ikke alle pasienter som har polycythaemia vera med sikkerhet er positive for mutasjonen JAK2V617F med den analyseteknikken som ble benyttet, var det aktuelt å gå videre i utredningen og ta en beinmargsbiopsi.
Histologisk undersøkelse av beinmargsbiopsi viste normocellulær beinmarg med noe økt og venstreforskjøvet erytropoese og moderat økt antall lambdapositive monoklonale plasmaceller. Dette kunne passe med monoklonal gammopati av usikker betydning (MGUS) eller begynnende myelomatose (fig 1). Det var svært få kappapositive plasmaceller, og det var ingen sikre tegn til myeloproliferativ sykdom (fig 2). Beinmargsutstryk viste 30 % normoblastær erytropoese, 46 % myelopoese, 3 % myeloblaster, 2 % promyelocytter, 15 % lymfocytter og 4 % plasmaceller som hadde til dels atypisk utseende og der noen lå litt samlet etter hverandre. Det var normal serum-proteinelektroforese uten påviste M-komponenter og det var normal kvantitering av immunglobuliner, men det ble ikke utført immunfiksering av elektroforese i serum. Det ble ikke påvist frie lette kjeder i urin og det var normale røntgenfunn av skjelettet, bortsett fra artroseforandringer.
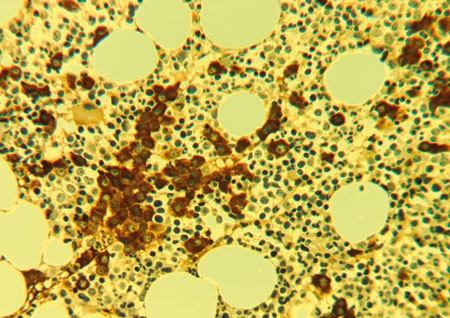
Figur 1 Immunhistokjemisk farging av beinmargsbiopsi der plasmaceller positive for λ-kjeder er godt synlige i preparatet

Figur 2 Skjematisk fremstilling av de viktigste myeloproliferative sykdommer og prosentvis angivelse av positiv JAK2V617F-mutasjon. Prosentvis BCR-ABL-positivitet ved kronisk myelogen leukemi er også angitt. Tre av fargefeltene overlapper hverandre litt; overgangen mellom sykdommene kan være vanskelig å skille
Pasienten hadde en uforklarlig polycytemi med jernmangel og funn av monoklonale plasmaceller uten tegn til MGUS eller sekretorisk myelomatose. Hennes polycytemi kunne være forårsaket av genetisk skade etter cytostatisk behandling for malign blæremola 32 år tidligere. Aktinomycin-D er toksisk både generelt og med hensyn til beinmargen, noe som særlig forsterkes av strålebehandling. I pasientens papirer er det beskrevet at hun fikk kraftige bivirkninger av cellegiftkurene. Det er kjent at pasienter som får cellegiftkombinasjoner der aktinomycin-D eller metotreksat inngår, ev. sammen med alkylerende stoff, har økt risiko for å utvikle sekundære maligne sykdommer. Det er skrevet lite om risikoen for senere utvikling av malign sykdom når kun aktinomycin-D og metotreksat er gitt sammen eller hver for seg.
Fire måneder etter forrige prøve var serum-erytropoietinverdien steget ytterligere til 90,2 IE/l, slik at man kunne mistenke pågående sykdomsutvikling. I denne perioden var det utført noen blodtappinger, men hun utviklet aldri anemi. Det er derfor usannsynlig at den observerte stigningen i serum-erytropoietinverdi var forårsaket av fallet i hemoglobinnivå.
Funnet av monoklonale plasmaceller i beinmargsbiopsi og beinmargsutstryk kunne gi mistanke om begynnende ikke-sekretorisk myelomatose.
Pasienten ble henvist til universitetssykehus for nærmere undersøkelse. Ny beinmargsbiopsi viste samme bilde som tidligere. Pasienten ble henvist til positronemisjonstomografi (FDG-PET) som ledd i forsøk på å lokalisere en erytropoietinproduserende tumor. Noen sikker tumorlokalisasjon ble ikke avdekket ved undersøkelsen. Det ble heller ikke beskrevet diffust økt opptak i beinmargen, noe som kunne indikert at den var hyperfungerende, slik man ser det ved polycythaemia vera (4). Det ble nå påvist spor av frie lette kjeder av typen lambda i urinen. Mengden var så liten at den ikke lot seg kvantitere. Proteinelektroforese var normal, og serum-β₂-mikroglobulin var innenfor referanseområdet. For øvrig var konklusjonen at utredningen ikke ga nye opplysninger utover det som allerede forelå.
Serumprøve tatt litt senere viste sterkt avvikende ratio mellom kappa og lambda lette immunglobulinkjeder i serum, verdien var 0,03, mens referanseområdet er 0,36–1,01. Det var tydelig økt konsentrasjon av lambda lette kjeder. Dette var forenlig med monoklonal gammopati eller myelomatose. Cytogenetisk undersøkelse av beinmarg viste ingen kromosomale avvik.
Ved kontroll en knapp måned senere hadde hun stigende erytrocyttnivå til 6,79 · 1012/l, EVF til 0,46 og hemoglobin til 13,7 g/100 ml. MCV og MCH var under referanseområdet. Etter forslag fra universitetssykehuset fikk pasienten jerntabletter noen uker, og ferritinverdien steg fra 6 µg/l til 19 µg/l. Hemoglobinverdien, EVF og antall erytrocytter steg da kraftig, og pasienten fikk symptomer, slik at ytterligere venesectio måtte foretas. Serum-erytropoietinverdien steg til 123 IE/l.
De aktuelle diagnosene var en erytropoietinproduserende tumor eller «idiopatisk» erytrocytose. Hos noen pasienter som har fått denne benevnelsen, er det beskrevet mutasjoner i ekson 12 i JAK2-genet (5), Ved isolert erytrocytose er det også funnet flere mutasjoner i genet som koder for erytropoietinreseptoren (6). Disse pasientene har imidlertid lave nivåer av serum-erytropoietin.
Det forelå en monoklonal gammopati av usikker betydning, dette basert på funn i beinmargsutstryk, beinmargsbiopsi, funn av små mengder monoklonale lette kjeder i urinen og tydelig avvikende kappa-lambda-lettkjede-ratio i serum. Det er trolig pasientens monoklonale plasmaceller som er kilden til det høye erytropoietinnivået, da nylig utførte analyser av pasientens plasmaceller har påvist omtrent ti gangers økning i uttrykt erytropoietin-mRNA sammenliknet med kontrollcellelinjer (A. Waage, personlig meddelelse).
Diskusjon
Utredning av forhøyet hemoglobinnivå er en vanlig problemstilling ved medisinske poliklinikker. Det foreligger handlingsprogrammer for slik utredning, og det er bestemte hematologiske funn som indikerer at det foreligger tilstander som omfattes av begrepet myeloproliferative sykdommer (7). Ved funn av høy hemoglobinverdi over en viss tidsperiode er det anbefalt å utrede menn med EVF > 0,52 og kvinner med EFV > 0,48. Polycytemier har tradisjonelt vært inndelt i primære (polycythaemia vera) og sekundære polycytemier. De sekundære kan ha en rekke årsaker, og utredningen av høyt hemoglobinnivå dreier seg nærmest alltid om enten å finne en årsak til sekundær polycytemi eller å utelukke at en slik påvisbar årsak foreligger. De fleste erytrocytosene er ervervet. Medfødte former er sjeldne. Noen er mediert ved økt serum-erytropoietinnivå som igjen er forårsaket av hypoksi pga. kroniske lungesykdommer, hypoventilasjonssyndromer, røyking, kardiale shunter eller ulike nyresykdommer. Andre årsaker er tumorsykdommer med økt erytropoietinproduksjon eller medikamenter. Av og til foreligger en «idiopatisk» erytrocytose hvor ingen årsak påvises.
Noen sikker årsak til pasientens polycytemi ble ikke funnet under utredningen ved innleggelsene, men over tid var det stigende serum-erytropoietinverdi, slik at mistanken om en erytropoietinproduserende tumor etter hvert ble styrket. Å lokalisere en slik tumor viste seg å være vanskelig.
Ved sekundære polycytemier er det ikke vanlig å behandle med blodtapping, og slik behandling har ikke særlig lindrende virkning på de symptomer pasienten måtte ha. Sekundære polycytemier som ses ved medfødte cyanotiske hjertefeil, kan imidlertid bli så uttalt at blodtapping er den behandlingen som med rask virkning kan lindre en pasients hyperviskositetssymptomer. Vår pasient som spontant anga symptomer som vanligvis forekommer ved polycythaemia vera, hadde noe overraskende god effekt av denne behandlingen.
Pasienter som gjennomfører blodtapping, vil etter en tid utvikle jernmangel. Det har vært ulike meninger om pasientene skal få jerntilskudd eller ikke, da det antas at mikrocytære erytrocytter kan påvirke blodets viskositet i negativ retning. Vår pasient hadde jernmangel allerede før blodtapping ble iverksatt. Selv om diagnosen var usikker, ble det i utgangspunktet bevisst valgt ikke å gi pasienten jern, i samsvar med hva man vanligvis anbefaler når det foreligger polycythaemia vera (7). Et senere behandlingsforsøk med jerntabletter forårsaket stigende blodverdier og subjektive symptomer.
Både klinisk og ved blodprøver hadde pasienten flere funn som kunne støtte diagnosen polycythaemia vera. Verdier for EVF og hemoglobin var i utgangspunktet så høye at de tilfredsstilte de diagnostiske kriteriene satt i det nordiske handlingsprogrammet og i forslag til revidert program fra Verdens helseorganisasjon (1, 7). To undersøkelser talte imidlertid imot diagnosen: serumverdien for erytropoietin var økt og ikke supprimert, og mutasjonsanalysen for JAK2V617F var negativ. Så å si alle pasienter med diagnosen polycythaemia vera har serum-erytropoietinverdier under nedre referansegrense eller i nedre normalområde (2). Andelen med denne diagnosen der det foreligger mutasjon i genet som koder for JAK2, er generelt angitt å være omkring 95 % (1), men det er også vist at det foreligger mutasjoner i genets ekson 12 hos noen pasienter med polycytemi (5), pasienter som tidligere var blitt omtalt å ha «idiopatisk erytrocytose». Den prosentandelen pasienter som er positiv, er avhengig av hvilke analysemetoder man benytter og hvilke mutasjoner man ved det enkelte laboratorium har analysemetoder for. Ved å anvende ulike analysemetoder er det funnet at mutasjoner i JAK2-genet er til stede hos alle pasienter som har polycythaemia vera (8). Andre funn hos pasienten som ikke støttet diagnosen polycythaemia vera var det morfologiske beinmargsbildet, fravær av leukocytose og trombocytose, og milten var normalt stor.
Genetisk skade av ikke-kartlagt natur er mulig, og to forhold hos pasienten gjør at slik skade er tenkelig. Hun hadde gjennomgått ganske hard cellegiftbehandling vel 30 år tidligere, og denne behandlingen kunne ha gitt genetisk senskade, selv om maligne sekundære hematologiske sykdommer vanligvis opptrer etter kortere latenstid, slik man har observert etter behandling for Hodgkins sykdom (9). Det ble påvist monoklonale plasmaceller i beinmargsbiopsi og beinmargsutstryk, noe som har sin årsak i somatisk genetisk skade.
Pasientens absolutte erytrocytose kunne være såkalt idiopatisk, en tilstand der man sterkt mistenker eller har bekreftet at det foreligger forhøyet cellevolum av erytrocytter, men der verken kriteriene for polycythaemia vera er oppfylt, eller det kan påvises andre ervervede eller medfødte årsaker til tilstanden. Familiære tilstander med erytrocytose og høyt serum-erytropoietinnivå er også nylig beskrevet (10). Hos noen pasienter finner man fortsatt ikke noen sikker påvist årsak til høyt hemoglobin.
Forekomst av polycytemi og plasmacellesykdom er beskrevet av flere, også ett tilfelle der det samtidig var påvist forhøyet serum-erytropoietinnivå (11). Det er også påvist at plasmaceller fra pasienter med plasmacellesykdommer uttrykker erytropoietin-mRNA og erytropoietinreseptor-mRNA (12). Det er grunn til å anta at vår pasients monoklonale plasmaceller kan være kilden til det høye erytropoietinnivået. Analysene som viser at pasientens plasmaceller uttrykker høyt erytropoietin-mRNA, støtter dette. Det gjenstår å vise at funnet fører til økt erytropoietinproduksjon.