En mann ble innlagt i lokalsykehuset med luftveissymptomer av tre ukers varighet. Det skulle vise seg at han var infisert med en uvanlig bakterie.
En 62 år gammel mann ble innlagt i sykehus etter tre uker med økende funksjonsdyspné og radiologiske tegn til hjertesvikt (stuvning og Kerley B-linjer). Bortsett fra hypertensjon, behandlet med losartan og hydroklortiazid, hadde han tidligere stort sett vært frisk. Han hadde kontaktet legevakten to uker tidligere, og det ble da startet antibiotikabehandling med erytromycin mot antatt luftveisinfeksjon. Det var ingen klinisk effekt av denne behandlingen, og medisinen ble seponert dagen før sykehusinnleggelsen.
Pasienten hadde ikke hvile- eller taledyspné. Blodtrykket var 150/59 mm Hg, han hadde regelmessig hjertefrekvens på 105 slag/min, og kroppstemperaturen var 37,5 °C. Ved auskultasjon av hjertet ble det påvist sannsynlig nyoppstått kraftig kombinert systolisk og diastolisk bilyd grad 4, for øvrig var det normal organstatus. Blodprøver avdekket moderat forhøyede inflammasjonsmarkører (C-reaktivt protein 90 mg/l, senkningsreaksjon 49 mm/t, men ingen leukocytose, 7,8 · 10⁹/l), moderat anemi (hemoglobin 10,7 g/100 ml), lett forhøyet myokardskademarkør (troponin I 1,39 µg/l), men nær normal CK-MB (6,8 µg/l) og biokjemiske holdepunkter for hjertesvikt (pro-brain natriuretisk peptid 611 pmol/l). EKG viste sinusrytme med AV-blokk grad 1, venstre akse, R-tap i fremre vegg og tegn til venstre ventrikkel-hypertrofi.
På bakgrunn av akutt hjertesvikt og nyoppstått hjertebilyd fant vakthavende lege indikasjon for ekkokardiografi, som ble utført allerede få timer etter innleggelsen. Venstre ventrikkel var dilatert, med endediastolisk dimensjon på 6,7 cm og endesystolisk dimensjon på 4,7 cm. Ejeksjonsfraksjonen ble estimert til 48 % (nedre normalområde). Slagvolumet var 93 ml, og med en hjertefrekvens på 105 slag/min ble minuttvolumet da 9,75 l/min. Aortaklaffen var trikuspid, med en endokardittsuspekt pendulerende vegetasjon på den ikke-koronare klaffen, 0,7 cm x 0,9 cm, og en nesten like stor vegetasjon på den høyre koronare klaffen (fig 1, videosnutt 1, videosnutt 2). Det var ingen tegn til abscessdanning. Den ikke-koronare klaffen var nesten totalt destruert, og dette ga opphav til stor aortainsuffisiens, med trykkhalveringstid på 56 ms (fig 2, videosnutt 3, videosnutt 4). Høyre ventrikkel var normal, med en liten trikuspidal insuffisiens. Trikuspidallekkasjegradienten var 47 mm Hg, og v. cava målte 1,7 cm, med noe redusert respiratorisk variasjon. Dette indikerte betydelig grad av pulmonal hypertensjon, med et estimert trykk i det lille kretsløp på om lag 60 mm Hg. Det ble også påvist en liten til middels mitralinsuffisiens.
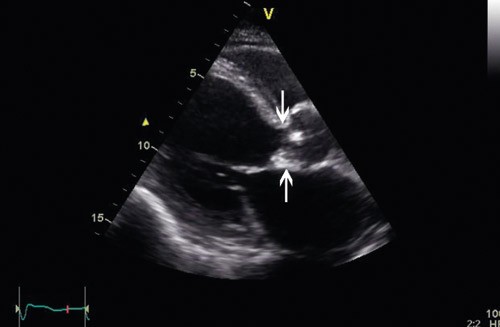
Figur 1 Ekkokardiografi ble utført kort tid etter innleggelsen. Aortaklaffen var trikuspid, med en endokardittsuspekt pendulerende vegetasjon på den ikke-koronare klaffen og en nesten like stor vegetasjon på den høyre koronare klaffen
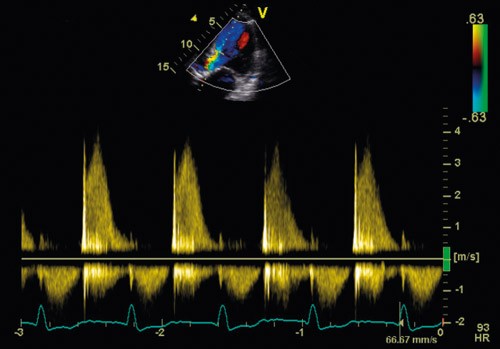
Figur 2 Ifølge ekkokardiografi kort tid etter innleggelsen var det ingen tegn på abscessdanning. Den ikke-koronare klaffen var nesten totalt destruert, og dette ga opphav til stor aortainsuffisiens
I henhold til de modifiserte Dukes kriterier forelå det mulig endokarditt med alvorlig destruksjon av aortaklaffen og påfølgende hjertesvikt (ramme 1) (1, 2). Seks sett blodkulturer ble tatt før empirisk antibiotikabehandling i form av penicillin og tobramycin ble iverksatt.
Ramme 1
Hoved- og bikriterier for diagnosen infeksiøs endokarditt (modifiserte Dukes’ kriterier (1)). Diagnosen stilles enten ved minst to hovedkriterier eller ved ett hovedkriterium og tre bikriterier eller ved fem bikriterier. Pasienten har «mulig endokarditt» ved ett hovedkriterium og ett bikriterium eller tre bikriterier. Denne rammen er basert på en tilsvarende fra Sjursen (2) (gjengitt med tillatelse)
Hovedkriterier – mikrobiologi
-
Typiske bakterier i to blodkulturer (Streptococcus viridans, S bovis, Staphylococcus aureus, HACEK-gruppen, enterokokker) med ikke påvist primærfokus
-
Persisterende bakteriemi (12 t). Vekst i tre av tre eller i tre av fire blodkulturer
-
En enkelt blodkultur positiv for Coxiella burnetii eller antifase 1 IgG-antistoff titer > 1:800
Hovedkriterier – klaffer
-
Typiske ekkokardiografiske funn: Oscillerende intrakardial masse på klaffer eller støtteapparat (transøsofeagal ekkokardiografi anbefalt ved kunstige klaffer og «mulig endokarditt» eller komplisert kjent endokarditt (paravalvulær abscess))
-
Abscess
-
Ny partiell løsning av klaffeprotese
-
Ny klaffelekkasje (økning eller forandring av kjent bilyd er ikke tilstrekkelig)
Bikriterier
-
Predisponerende hjertesykdom eller intravenøst stoffmisbruk
-
Feber 38 °C
-
Vaskulære funn: Arteriell embolus, mykotisk aneurisme, intracerebral blødning, konjunktival blødning, Roths flekker, petekkier, Janeways lesjoner
-
Immunfenomen: Glomerulonefritt, Oslers knuter, positiv revmatoid faktor
-
Positive blodkulturer som ikke oppfyller hovedkriteriene (vekst av andre bakterier enn de som er nevnt under hovedkriterier)
Pasienten hadde ikke vært til tannlege på flere år. Tannlegetilsyn under sykehusoppholdet viste at mulig inngangsport for infeksjonen var flere områder med periodontitt og tannslitasje ned til pulpa med rotrester.
Dagen etter innleggelsen var blodtrykket sunket til 90/60 mm Hg. Det var ingen tegn til perifer embolisering. Tilstanden ble oppfattet som svært alvorlig, og pasienten ble, under ett døgn etter innleggelse i lokalsykehuset, overflyttet til Rikshospitalet for overvåking med tanke på kirurgisk intervensjon. Koronar angiografi påviste kun veggforandringer. Pasienten hadde på dette tidspunkt akutt hjertesvikt med truende lungeødem pga. destruert aortaklaff. Han ble umiddelbart operert med eksisjon av aortaklaffen og innsetting av mekanisk klaff (On-X 23, On-X Life Technologies, Inc., Austin, TX, USA). Den igangsatte antibiotikabehandlingen ble videreført. Det var et ukomplisert postoperativt forløp, og pasienten ble sendt tilbake til lokalsykehuset tre dager etter hjertekirurgien.
Etter fire døgns inkubasjon ble det påvist vekst i alle seks aerobe blodkulturflasker. Mikroskopi av grampreparat viste små gramnegative, til dels pleomorft fargede staver. Det var samme funn i alle flasker. Ved utsæd vokste bakterien langsomt, og den lot seg ikke sikkert klassifisere med ordinære mikrobiologiske biokjemiske analyser, tilgjengelige agglutinasjonsteknikker eller kommersielle identifikasjonsmetoder. På bakgrunn av kliniske opplysninger samt vekstmønster og utseende i mikroskop mistenkte man en bakterieart tihørende HACEK-gruppen (Haemophilus parainfluenzae, Aggregatibacter aphrophilus (tidligere Haemophilus aphrophilus og Haemophilus paraphrophilus), Aggregatibacter actinomycetemcomitans (tidligere Actinobacillus actinomycetemcomitans), Cardiobacterium hominis, Eikenella corrodens og Kingella kingae). Molekylærbiologisk diagnostikk av blodkulturisolat og fjernet aortaklaff ble utført. Bakteriespesifikk 16S rDNA-sekvensering avdekket meget godt (99 %) samsvar med databasesekvens for Cardiobacterium valvarum i begge prøvematerialer.
Resistensundersøkelser med E-testmetodikk (AB Biodisk, Solna) ble utført ved primærlaboratoriet. Det foreligger ikke internasjonalt standardiserte metoder for resistenstesting av C valvarum, men ut fra referanser fra AB Biodisk ble haemophilustestmedium (Oxoid) valgt. Det ble ikke funnet holdepunkter for betalaktamaseproduksjon eller annen in vitro-resistens mot undersøkte antibiotika (minimal inhibitory concentration, MIC (mg/l): penicillin 0,004, ampicillin < 0,016, cefotaksim 0,008, ceftriakson < 0,016, gentamycin 0,19, tobramycin 0,125, ciprofloksacin 0,008).
Ved endokarditt forårsaket av bakterier i HACEK-gruppen anbefales vanligvis ampicillin eller 3.–4. generasjons kefalosporin (1). Penicillin + tobramycin ble erstattet med ampicillin + tobramycin, med senere overgang til ceftriakson i monoterapi. Pasienten fikk i alt fem ukers antibiotikabehandling. Den postoperative fasen var ukomplisert – uten kliniske eller ekkokardiografiske holdepunkter for dysfunksjonell mekanisk aortaventil eller persisterende hjertesvikt.
Diskusjon
Mikrobiologisk diagnostikk
Ved mistanke om endokarditt er adekvat høsting av blodkulturer forut for oppstart av antimikrobiell behandling essensielt. Identifikasjon av type bakterie i blodkultur vil kunne være veiledende for videre antimikrobiell behandling. Kunnskap om aktuell mikrobe vil også kunne gi informasjon om forventet klinisk forløp – spesielt med tanke på behov for akutt kirurgi. Ved høsting av blodkulturer bør det tappes med flere venepunksjoner, f.eks. fra begge armer og ved ulike tidspunkter. Det er ikke avgjørende at høstingen skjer ved frysninger/feber.
Det er spesielt viktig at det mikrobiologiske laboratoriet gjøres kjent med mistanken om endokarditt, slik at blodkulturene kan inkuberes tilstrekkelig lenge og på riktig medium. Dette aktualiseres spesielt med denne kasuistikken, der det var oppvekst av C valvarum, tilhørende HACEK-gruppen, der dyrkingstiden kan være opptil 5–7 dager (2, 3). Så langt vi vet, er C valvarum kun beskrevet som årsak til endokarditt i fem kasuistikker tidligere, første gang i 2004 (4–8). I en av kasuistikkene er det kliniske forløpet ikke beskrevet (6). Siden bakterien er sjelden, er det ikke utarbeidet standardiserte ordinære mikrobiologiske metoder for eksakt identifikasjon. Etter oppdagelsen av C valvarum har molekylærbiologisk diagnostikk vært avgjørende for korrekt identifikasjon, slik det var i denne kasuistikken. Dette understreker viktigheten av anvendelse av molekylærbiologiske metoder i mikrobiell diagnostikk der det er uklare resultater ved konvensjonelle metoder. I ytterste konsekvens kan man konkludere med feil bakterie hvis man kun baserer seg på tradisjonell diagnostikk (6).
Antibiotikabehandling ved endokarditt
Rask igangsetting av antibiotikabehandling med tilstrekkelig behandlingsvarighet er av avgjørende betydning for å unngå destruksjon av den infiserte hjerteklaffen, med påfølgende behov for hjertekirurgi. Endokarditt oppstår i endotel som er skadet, enten pga. høy hastighet på blodstrømmen eller det kan være degenerativ klaffeskade. Vanligvis rammes venstre hjertehalvdel, der det er høyere trykk. Hos narkomane rammes høyre hjertehalvdel oftest. Endotelskade disponerer for fibrinavleiring og blodplateavleiring, som fungerer som vekstmedium for bakteriene, og det dannes vegetasjoner dekket av fibrin. Hjerteklaffene er i utgangspunktet lite vaskularisert. Kroppens immunforsvar med antistoffer og fagocytterende celler har derfor dårlig tilgang til infisert vev, og bakteriene kan vokse relativt fritt.
Ved valg av antibiotika bør flere momenter vektlegges: Type må velges ut fra resistensundersøkelser og måling av minste hemmende konsentrasjon (MIC), medikamentet må ha gode diffusjonsegenskaper i infisert vev, og det må gis i tilstrekkelig høy dose intravenøst. Forut for resistensbestemmelse startes empirisk behandling (vanligvis penicillin og gentamicin) så snart blodkulturer er sikret.
Man har naturlig nok lite erfaring med antibiotikabehandling av endokarditt forårsaket av C valvarum. I tidligere publiserte kasuistikker har behandlingen variert (4, 5, 7, 8). Den nær beslektede C hominins er vanligvis sensitiv for penicillin, men det er påvist betalaktamaseaktivitet hos disse bakteriene. Derfor anbefaler American Heart Association (1) ceftriakson i 4–6 uker mot C hominis, og man må anta at dette er en effektiv strategi også mot C valvarum pga. disse to mikrobenes nære slektskap. I norske retningslinjer anbefales ampicillin i 4–8 uker med tillegg av gentamicin de første to ukene ved HACEK-endokarditt (9).
Karakteristika ved cardiobacteriumendokarditt
Vår pasient hadde en sannsynlig nyoppstått kardial bilyd, funksjonsdyspné og lette infeksjonstegn som viktigste kliniske funn som kunne settes i sammenheng med diagnosen endokarditt. I oversiktsartikler om C hominis er kardial bilyd angitt hos 94–96 %, men dette er også klassisk ved endokarditter forårsaket av andre mikrober (10, 11). Et kjennetegn på C hominis-endokarditt er et snikende eller subakutt forløp med lite feber og allmennsymptomer av lengre varighet forut for sykehusinnleggelsen, til forskjell fra vanligere endokardittpatogener som stafylokokk- eller streptokokkendokarditt. Gjennomsnittlig symptomvarighet for C hominis-endokarditt var i to oversiktsartikler angitt til ca. 20 uker (10, 11), mens det i oversiktsartikler der man har tatt for seg populasjonsstudier der stafylokokk- og streptokokkendokarditter dominerer, angis 4–6 ukers symptomvarighet (12, 13).
Lang sykehistorie forut for oppstart med antbiotika øker risikoen for alvorlig klaffeskade, og C hominis er forbundet med økt risiko for hjertesvikt sammenliknet med andre HACEK-mikrober (11). Vår pasient hadde en relativt kort sykehistorie på tre uker, altså kortere symptomvarighet enn man kunne forvente. Likevel utviklet han hjertesvikt og ble operasjonstrengende. Det er mulig at infeksjonen hadde vart signifikant lenger enn tre uker.
Aortaklaffen synes å bli rammet oftere ved C hominis-endokarditt (11). Dette ser også ut til å være tilfellet for C valvarum, i og med at det i alle de publiserte kasuistikkene (inkludert vår) var nødvendig med utskiftning av aortaklaffen (4, 5, 7, 8).
Indikasjon for kirurgi
Vår pasient hadde destruert aortaklaff og trengte rask kirurgisk intervensjon. En fallgrube ved behandling av venstresidig endokarditt er å undervurdere progrediering av hjertesvikt. Pasientene må overvåkes nøye med henblikk på tegn til sirkulatorisk instabilitet. Det må gjøres regelmessige ekkokardiografiske undersøkelser, og det er foreslått kriterier som øker indikasjonen for kirurgisk intervensjon (ramme 2) (2, 14). Pasienter med vedvarende og ukontrollerbar infeksjon eller tegn på økende hjertesvikt skal overføres til sykehus med hjertekirurgisk kompetanse for vurdering. Systematiske kriterier for akutt kirurgi er tidligere beskrevet (ramme 3) (2, 15, 16).
Ramme 2
Ekkokardiografiske funn som øker indikasjonen for kirurgi, ifølge Bayer og medarbeidere (14). Oversatt og gjengitt med tillatelse fra Sjursen (2)
-
Persisterende vegetasjoner etter alvorlig embolisk episode
-
Store (> 1 cm i diameter) anteriore mitralklaffvegetasjoner
-
Økt vegetasjonsstørrelse etter fire ukers antibiotikaterapi
-
Akutt mitralinsuffisiens
-
Klaffeperforasjon eller -ruptur
-
Periannulær utbredelse av infeksjonen
Ramme 3
Indikasjon for kirurgi ved endokarditt (15, 16). Oversatt og gjengitt med tillatelse fra Sjursen (2)
-
Hjertesvikt som ikke korrigeres av medikamentell behandling
-
Mer enn én alvorlig embolus
-
Infeksjon som ikke responderer tilfredsstillende på antibakterielle midler, spesielt ventilendokarditt
-
Betydelig klaffedysfunksjon
-
Reseksjon av mykotisk aneurisme
-
Alvorlige ledningsforstyrrelser
I alle de fire tidligere publiserte kasuistikkene med C valvarum der det kliniske forløpet er gjengitt (i tillegg til vår), måtte pasientene opereres med innsetting av kunstig hjerteklaff. Dette skiller seg tilsynelatende fra et oversiktsmateriale med C hominis, der kun 40 % (23 av 57) ble operert (10). Man kan spekulere på om C valvarum har økt virulens sammenliknet med C hominis til tross for deres genetiske likhet. En annen forklaring kan være at terskelen for hjertekirurgi er senket som følge av klarere retningslinjer (ramme 3).
Tilgang på kardiolog
Ekkokardiografi er en sentral undersøkelse for å påvise vegetasjoner som følge av endokarditt og i den løpende vurderingen av den sirkulatoriske betydningen av klaffeskade. En fullverdig ekkokardiografisk undersøkelse bør utføres av spesialist i hjertesykdommer, men i Norge varierer det i hvilken grad det er døgnkontinuerlig vaktordning med kardiolog på sykehusene. Ved sykehus uten kardiologisk vaktordning bør man satse på systematisk opplæring av vaktleger i ekkokardiografi, slik at pasienter med mistenkt endokarditt kan få hurtig og adekvat vurdering (17). Vår pasient var heldig, siden vakthavende lege behersket ekkokardiografisk undersøkelse.
Konklusjon
Langsomtvoksende C valvarum kan forårsake alvorlig endokarditt med et snikende forløp med lite allmennsymptomer og feber. Kasuistikken illustrerer betydningen av moderne molekylærbiologisk diagnostikk ved endokarditt og hvor viktig det er å evaluere pasienten fortløpende, både klinisk og med ekkokardiografi med tanke på hurtig kirurgi.